夏枯草通过调控MAPK信号通路抑制甲状腺乳头状癌的恶性生物学行为
陈红跃 杨萌萌 栗粟 武红园 娄永庆
(1河南省中医院甲状腺乳腺科,河南 郑州 450002;2河南中医药大学第二临床医学院)
近十年来甲状腺肿瘤正在以每3.6%年的增长趋势快速发展〔1〕,已跃居全球恶性肿瘤的前十位癌谱,占癌症总发病数的1%以上〔2〕,其中甲状腺乳头状癌(PTC)占比较大。PTC由于滤泡上皮高度分化,病理学常表现为多灶性,长期以来甲状腺切除术是主流疗法,同时术后辅助TSH抑制和I131清甲治疗,规范化诊疗可以使大部分患者的5年生存率提高到97%〔3〕。但面临了手术造成永久性喉返神经和甲状旁腺功能损伤,左旋甲状腺素易诱发绝经妇女骨质疏松,放射性碘可波及唾液腺〔4~7〕等,因此探索更有效防治PTC的药物成了当下的研究热点。中药夏枯草用以防治甲状腺疾病已有千年之久,始记于《神农本草经》“主寒热瘰疬,散瘿结气”〔8〕。现代药理学研究〔9〕发现夏枯草的主要成分咖啡酸、迷迭香酸及三萜类组分发挥抗肿瘤作用,但对甲状腺乳头状癌细胞系B-CPAP的相关研究较少,作用机制尚不明确。故本课题选用B-CPAP细胞,利用多种分子生物学技术,观察中药夏枯草对其恶性生物学行为的影响,以期为临床治疗甲状腺癌提供新的思路。
1 材料与方法
1.1材料
1.1.1实验细胞株 人甲状腺乳头状癌细胞株 B-CPAP,购于上海赛百慷生物技术股份有限公司;
1.1.2实验药物 夏枯草颗粒(编号:B14000020441,国药准字:Z20050519,规格:2 g×8袋)产自江苏晨牌药业集团股份有限公司;
1.1.3实验主要试剂与设备 胎牛血清、RPMI1640、磷酸盐缓冲液(PBS)、0.25%胰蛋白酶(Biological Industries);青链霉素双抗混合液、二甲基亚砜(DMSO)、高效RIPA裂解液、ECL超敏化学发光检测试剂盒、膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(北京索莱宝);CCK-8试剂盒(上海同仁化学科技);苯甲基磺酰氟(PMSF)蛋白酶抑制剂、磷酸酶抑制剂(武汉博士德);聚氰基丙烯酸正丁酯(BCA)蛋白浓度测定试剂盒(碧云天生物技术);蛋白电泳凝胶制备试剂盒(西安晶彩生物技术);Transwell细胞共培养小室(美国Corning公司);超净工作台(JB-CJ-2FC型);柜式恒温培养箱(HZ150L型);日立超速离心机(日本HITACHI型);全波长扫描式多功能读数仪(芬兰Thermo Fisher型);超速低温离心机(美国SIGMA3-K型);蛋白凝胶成像系统(XBCX-S-044型)等。
1.2实验方法
1.2.1细胞培养 人甲状腺乳头状癌B-CPAP细胞,培养于含10%热灭活胎牛血清的RPMI1640培养液中,置于37℃、5%CO2及饱和湿度细胞培养箱内,待细胞生长至对数期时,收集细胞用于后续实验。
1.2.2夏枯草溶液的制备 1 g夏枯草颗粒充分溶解于20 ml RPMI1640完全培养液中,震荡混匀,超声处理30 min,超速离心机1200 r/min,离心10 min,粗过滤去除沉渣杂质,0.22 mm超微过滤器正压抽滤除菌,制得原浓度为40 mg/ml的生药,4℃分装保存备用。
1.2.3CCK8测定细胞存活率 取对数生长期B-CPAP单细胞悬液,按6 000个/孔的密度接种于96孔培养板中,夏枯草生药用2%血清浓度的RPMI1640培养液以10倍比稀释,调整实验组浓度梯度为0.50、0.75、1.00、1.50、2.00 mg/ml,空白组为不含药的2%血清浓度培养液,各组同时设置6个平行孔。24 h后每孔加入CCK8试剂10 μl,37℃温箱继续孵育4 h。自动酶标读数仪调整参数,选择波长为450 nm处的测量OD值。记录数据,并绘制生长曲线。细胞存活率=(空白组OD值-实验组OD值)/空白组OD值×100%,
1.2.4流式细胞技术检测细胞凋亡比例 B-CPAP接种于6孔培养板中培养24 h,加入浓度为0.0、0.5、1.0、1.5 mg/ml的夏枯草溶液。PBS润洗1~2遍,胰酶消化离心,4℃预冷的PBS 重悬细胞一次,加入Annexin V-FITC 5 μl,轻轻混匀细胞,37℃避光孵育15~20 min,上机前5 min加入PI染色剂5 μl,通过四象限图来分析各组细胞所处状态分布。
1.2.5划痕修复检测细胞的侵袭性 用marker笔在6孔板底画好6条等距细线作为参考,B-CPAP细胞后接种于6孔板中,置于恒温培养箱中培养24 h,待细胞铺满整个孔时,用无菌20 μl枪头在6孔板内划出“一”形划痕,吸出培养基,PBS清洗2~3遍,加入浓度梯度为0.0、0.5、1.0、1.5 mg/ml的夏枯草稀释液,置于ZOOM培养箱中培养,设定程序为每4 h拍照1次,ImageJ软件测量划痕愈合率。
1.2.6Transwell小室检测细胞的迁移力 B-CPAP细胞预先撤去血清进行饥饿,常规胰酶消化离心,用不含血清的RPMI1640培养基将细胞重悬,以每孔100 μl的体积接种于24孔板小室上层,下层小室加入浓度分别为:0.0、0.5、1.0、1.5 mg/ml夏枯草溶液500 μl,培养箱孵育24 h后弃去小室内培养基,无菌盐水冲洗,4%组织细胞固定液固定小室中的细胞15~30 min,0.1%结晶紫染色,棉签轻轻擦去上层未迁移的细胞,用倒置显微镜显微以×400倍数计数,每个视图分析3个视野,计数每个视野内透过底层聚碳酸酯膜的细胞数目。
1.2.7Western印迹检测B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)、含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3、整合素连接激酶(ILK)、磷酸化(p)-细胞外信号调节激酶(ERK)/ERK蛋白的表达 常规消化接种细胞,6孔细胞培养板分别加入浓度为0.0、0.5、1.0、1.5 mg/ml的夏枯草溶液,24 h后加入胰酶回收细胞,RIPA裂解液裂解细胞,超低温离心两遍留取上清液。BCA蛋白定量试剂盒测量各组样品的蛋白浓度并计算上样体积,按比例加入5×上样缓冲液,煮沸变性。上样后行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),120 V,90 min,电泳后将蛋白质转移至PVDF膜,240 mA,1.5 h。脱脂牛奶常温下封闭2 h,一抗4℃孵育过夜,TBST洗膜5遍,二抗孵育1h,洗膜5遍,增强型免疫荧光发光试剂(ECL PLUS)化学发光,Image Lab软件定量测定灰度值,取3次测定结果平均值。
1.3统计学方法 采用SPSS21.0软件进行t检验、秩和检验、单因素方差分析。
2 结 果
2.1夏枯草抑制B-CPAP细胞增殖的作用 光镜下观察到空白组细胞生长良好,实验组加入夏枯草作用24 h后细胞逐渐变为圆形或不规则形,折光性变差,细胞活性降低。0.00、0.50、0.75、1.00、1.50、2.00 mg/ml组,细胞存活率分别为(100.00±0.00)%、(82.71 ± 1.30)%、(76.84 ± 0.92)%、(41.71 ± 0.77)%、(21.29 ± 0.25)%、(19.20 ± 0.23)%。实验组B-CPAP细胞存活率明显降低,与空白组相比较差异有统计学意义(P<0.05),随着药物剂量的增加细胞存活率显著下降(P<0.001),计算夏枯草的半量抑制浓度(IC50)约为0.94 mg/ml。
2.2夏枯草诱导B-CPAP细胞凋亡的作用 流式结果(图1)显示夏枯草浓度越高Q1区死亡细胞数目越多,Q4区活细胞数目越少,且细胞总凋亡率(Q2+Q3)也随药物浓度增加而递增,0.5、1.0、1.5 mg/ml组细胞凋亡率显著高于0.0 mg/ml组(P<0.05)。见表1。中低浓度夏枯草主要将B-CPAP细胞生长抑制在晚凋亡期,而较高浓度夏枯草在早凋亡期发挥促凋亡作用。
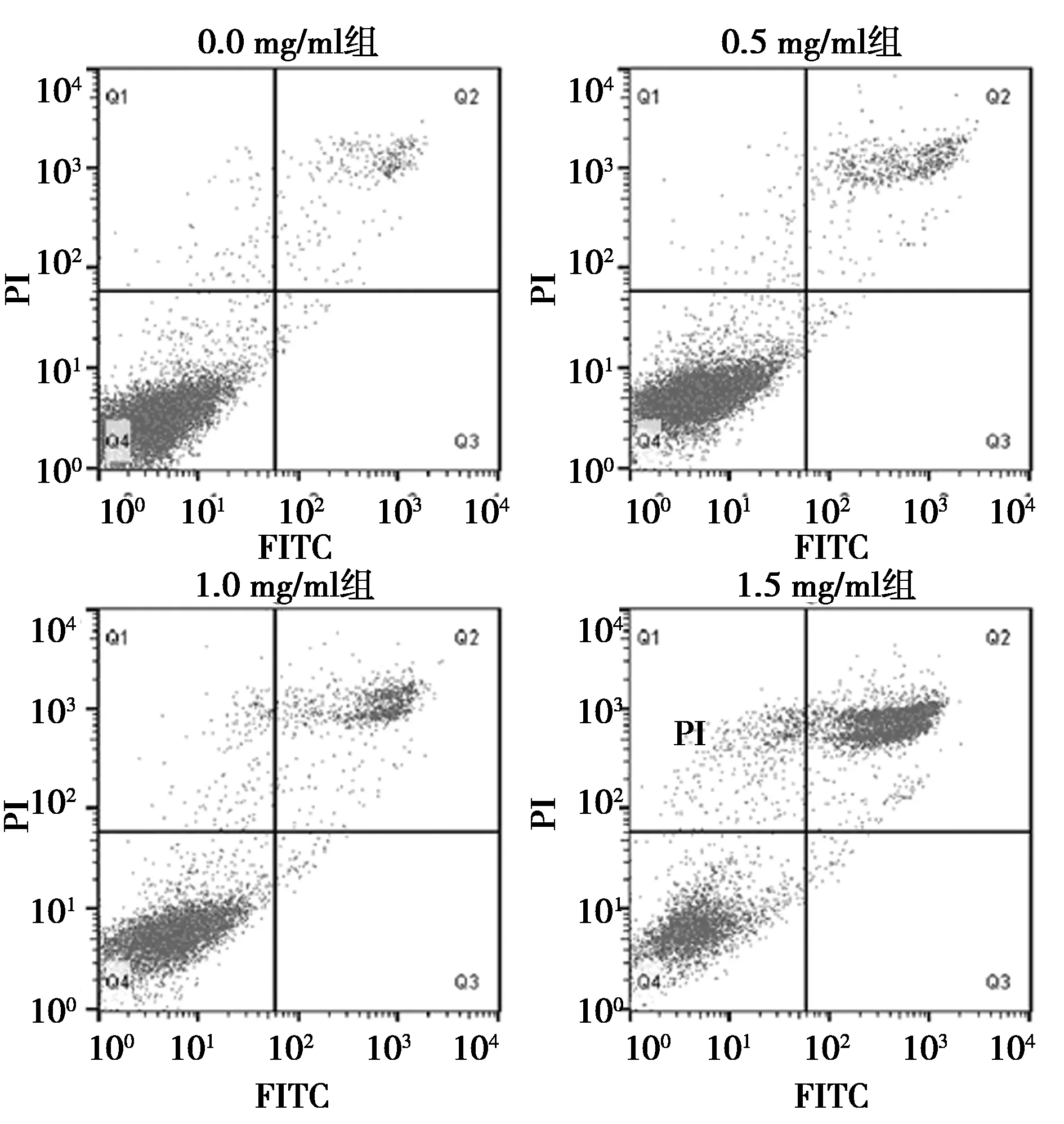
图1 夏枯草对B-CPAP细胞凋亡的影响
2.3夏枯草抑制B-CPAP细胞迁移力的作用 随着加入夏枯草浓度的增高,0.0 mg/ml组透膜的细胞数量最多,0.5 mg/ml组比0.0 mg/ml组稍有减少,1.0 mg/ml组透膜的细胞数量减少了一半,而1.5 mg/ml夏枯草近乎完全抑制了细胞的透膜迁移进程,未见染色细胞。见图2。各加药组的透膜细胞数量均低于0.0 mg/ml组,差异有统计学意义(P<0.001)。见表1。
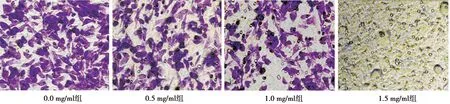
图2 夏枯草对B-CPAP细胞迁移能力的影响(结晶紫染色,×200)
表1 夏枯草对B-CPAP细胞凋亡、迁移能力及Bax、Bcl-2、Caspase-3、ILK及p-ERK/ERK蛋白表达的影响
2.4夏枯草抑制B-CPAP细胞侵袭性的作用 ZOOM显微镜捕捉到划痕逐步愈合的过程(图3),夏枯草分别作用12、24 h后,0.0 mg/ml组划痕区域基本长满细胞,加入夏枯草浓度越高,作用时间越长,划痕分界越明显。相同时间点0.5、1.0、1.5 mg/ml组与0.0 mg/ml组的划痕愈合率比较差异明显;且12 h与24 h的划痕愈合率对比的结果差异更加明显(P<0.05)。见表2。说明夏枯草能够削减B-CPAP细胞划痕伤口的愈合进程,抑制侵袭的作用有着剂量和时间依赖性。

图3 ZOOM显微镜下夏枯草对B-CPAP细胞划痕愈合率的影响(×100)
表2 夏枯草对B-CPAP细胞划痕愈合率的影响
2.5夏枯草对B-CPAP细胞Bax、Bcl-2、Caspase3、ILK、p-ERK/ERK蛋白表达的影响 夏枯草下调了B-CPAP细胞的抗凋亡蛋白Bcl-2和侵袭蛋白ILK的表达水平,而凋亡蛋白BAX和Caspase-3的表达水平上调;同时降低了MAPK通路相关蛋白p-ERK/ERK磷酸化水平,差异均有统计学意义(P<0.05,P<0.001)。见表1、图4。说明夏枯草能够促进B-CPAP细胞凋亡、抑制癌症侵袭进程,具体机制可能通过诱导凋亡蛋白家族表达,下调ILK蛋白与MAPK信号通路交联以发挥抑癌作用。
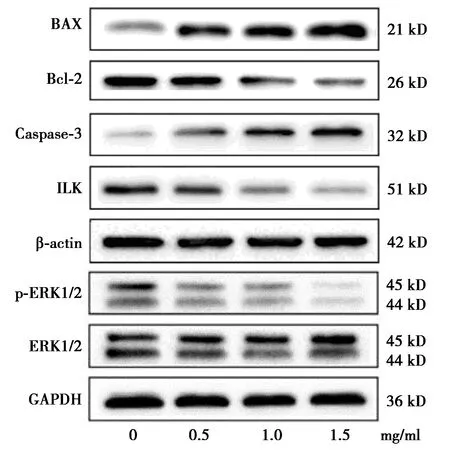
图4 不同浓度夏枯草对B-CPAP细胞Bax、Bcl-2、Caspase3、ILK及p-ERK/ERK蛋白磷酸化水平的影响
3 讨 论
甲状腺癌在中医学隶属“石瘿”的范畴,病机为五脏瘀血、浊气、痰滞〔10〕。中药夏枯草能够化痰散结、清热解毒,已广泛应用于甲亢、亚急性甲状腺炎及桥本甲状腺炎等〔11,12〕疾病的治疗当中。夏枯草能够通过辨证施治,实现减毒增效,有效抑制甲状腺肿瘤的生长,具有开发成为防治PTC药物的潜力,其作用是多靶点、多层次、多种途径的。Yin等〔13〕使用逆转录定量聚合酶链反应证实夏枯草显著增加高分化甲状腺癌细胞系的Bcl-2和Caspase-3基因表达。蒙雯雯等〔14〕研究小剂量山慈姑与夏枯草联合用药对作用于SW579细胞的增殖抑制作用较单药明显,抗增殖作用由核蛋白类调控基因产物(c-myc)蛋白负向调控。张乐乐〔15〕实验发现卷曲螺旋蛋白CCDC67作为抑癌基因在甲状癌中表达缺失,夏枯草提取物不仅能下调甲状腺癌的CCDC67基因表达,还能够增强细胞的自噬能力。熊燚等〔16,17〕实验观察夏枯草对体外培养的不同病理类型人甲状腺癌细胞的抗增殖作用,筛选得出PTC分型的敏感性明显高于其他三型。本实验结果显示夏枯草物作用于B-CPAP细胞的半数致死量IC50为0.94 mg/ml,以剂量和时间依赖性的方式有效抑制细胞增殖,促使凋亡细胞比率的增加,同时削弱癌症的迁移能力及侵袭表型。
甲状腺乳头状癌作为最常见的病理亚型,BRAF V600E基因突变在亚洲人群的检出率高达56%~82%〔18〕。BRAF基因可诱导苏氨酸/丝氨酸发生磷酸酰基化,赋予MAPK通路强活性,内在的线粒体途径激活引起细胞色素c因子释放,促细胞凋亡的Caspase家族被激活,其中起主要作用的是下游效应子Caspase-3因子表达增强,Bcl-2家族与其衔接紧密共同发挥作用。Bcl-2扼制凋亡进程的具体机制是与Bcl-2同源3结构域蛋白共同作用诱发线粒体信号,而Bax蛋白能够与之相对抗,快速启动凋亡的通路〔19〕。
PTC的侵袭进程主要由ILK负责调控,ILK作为上皮细胞外基质黏附的关键组成部分,调节血管内皮配体与表面受体结合,锚定-非依赖性细胞生长增加,介导细胞的黏附功能,在肿瘤转移进程中扮演者重要的角色〔20〕。最适药物浓度范围内夏枯草能够下调B-CPAP细胞ILK蛋白表达,降低MAPK通路相关蛋白p-ERK/ERK的磷酸化水平,因此推测夏枯草能够抑制甲状腺乳头状癌BRAF基因突变诱发的MAPK通路磷酸化水平,与ILK交联并下调其表达,共同削弱癌症的转移侵袭进程。
夏枯草作为新型抗肿瘤中成药,抑制甲状腺乳头状癌恶性生物学行为的效果显著,有望成为该病的潜在治疗手段。在临床手术切除原发癌灶后,可加服夏枯草制剂,实现减毒增效,延缓癌症转移复发,有效改善预后。

