贝伐珠单抗腹腔热灌注联合化疗对晚期卵巢癌患者血清肿瘤标志物水平的影响
肖春晖,邱梅英,李静文,卢辛辛
赣州市妇幼保健院,江西 赣州 341000
卵巢癌作为女性常见的恶性肿瘤,发病隐匿,多数卵巢癌患者确诊时已处于晚期,预后不佳。手术为主、辅以术后化疗为治疗卵巢癌的常用方法,但晚期卵巢癌患者病灶明显转移,肿瘤灶难以通过手术彻底切除。目前化疗已成为晚期卵巢癌治疗的重要手段,常见的化疗方案为紫杉醇联合顺铂(TP)化疗方案,能够抑制肿瘤生长[1]。近年来分子靶向治疗作为一种新的生物治疗模式,以贝伐珠单抗(BEV)为代表的抗肿瘤血管生成靶向治疗已成为卵巢癌的主要方式[2]。BEV 属于重组人源化单克隆抗体,可与肿瘤细胞结合,对癌细胞进行抑制并杀死[3]。鉴于此,本研究将探讨BEV 腹腔热灌注联合TP 化疗方案治疗对晚期卵巢癌患者血清肿瘤标志物水平的影响,并与单纯TP 化疗方案治疗进行比较,以为晚期卵巢癌的治疗提供指导。
1 资料与方法
1.1 一般资料
选择2020 年1 月至2021 年12 月于赣州市妇幼保健院治疗的86 例卵巢癌患者,按随机数字表法将其分为两组,各43 例。本研究获赣州市妇幼保健院医学伦理委员会批准。观察组:年龄范围33~78 岁,年龄(59.72±4.16)岁;国际妇产联盟(FIGO)分期:Ⅲ期、Ⅳ期各有20 例、23 例;病理类型:黏液型、浆液型、混合型各有15 例、23 例、5 例。对照组:年龄范围35~77 岁,年龄(60.23±4.04)岁;FIGO分期:Ⅲ期、Ⅳ期各有18 例、25 例;病理类型:黏液型、浆液型、混合型各有14 例、23 例、6 例。两组一般资料相比,差异无统计学意义(P>0.05)。
1.2 纳排标准
(1)纳入标准:①患者签署知情同意书;②卵巢癌患者均经病理学检查证实;③FIGO分期:Ⅲ~Ⅳ期;④具有可测量的实体病灶;⑤预计生存期≥6 个月。
(2)排除标准:①无法耐受BEV、化疗治疗者;②合并其他部位恶性肿瘤;③合并急、慢性感染者;④精神行为异常,依从性较低者;⑤合并脏器严重疾病者。
1.3 方法
对照组采用TP 化疗方案治疗,第1 天,静滴120 mg/m2紫杉醇注射液(北京协和药厂有限公司,国药准字H20083786,规格:10 mL∶60 mg);第2 天,静滴60 mg/m2注射用顺铂(齐鲁制药有限公司,国药准字H37021358,规格:10 mg);21 d为1 个周期,治疗2 个周期。于对照组基础上,观察组采用贝伐珠单抗注射液(齐鲁制药有限公司,国药准字S20190040,规格:100 mg∶4 mL)腹腔热灌注治疗,患者取仰卧位,局部麻醉后,于超声引导下行腹腔穿刺置管术,通过热灌注治疗机将5 mg/kg BEV+3 000 mL生理盐水灌注到腹腔内,灌注量为3 000~4 000 mL,灌注液温度43~45 ℃,灌注结束后引流灌洗液,1 次/周,持续治疗6 次。
1.4 观察指标
观察两组临床疗效、血清肿瘤标志物、生存质量及不良反应。临床疗效:治疗2 个周期后依据RECIST 实体瘤治疗疗效评价标准[4]评估,病灶完全消失且持续≥1 个月为完全缓解;病灶体积缩小≥50%为部分缓解;病灶体积缩小<50%、增加<25%为稳定;出现新病灶,或病灶体积增大≥25%为进展。疾病控制率(DCR)依据稳定、部分缓解、完全缓解病例计算。血清肿瘤标志物:治疗前、治疗2 个周期后采集两组空腹静脉血,3 000 r/min 离心10 min,采用酶联免疫吸附法测定癌抗原125(CA125)、癌胚抗原(CEA)、血管内皮生长因子(VEGF)水平。生存质量:治疗前、治疗2 个周期后采用KPS 评分评估,评分范围0~100 分,评分越高则生存质量越好。
1.5 统计学方法
采用SPSS 22.0 软件分析数据,计数资料以例(%)表示,用χ2检验;计量资料用表示,用t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效比较
观察组治疗后DCR 高于对照组,差异有统计学意义(P<0.05)。见表1。
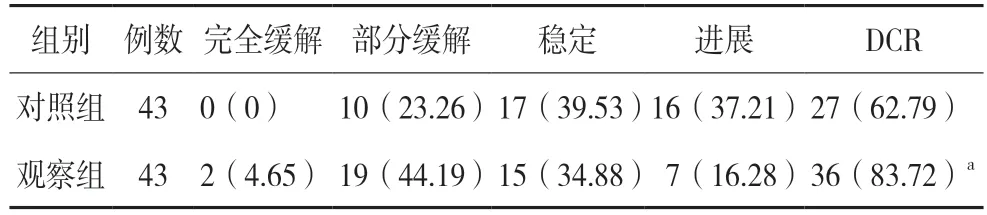
表1 两组临床疗效比较[例(%)]
2.2 CA125、CEA、VEGF 水平及KPS 评分比较
治疗前两组CA125、CEA、VEGF 水平及KPS评分比较,差异无统计学意义(P>0.05);治疗后观察组CA125、CEA、VEGF 水平低于对照组,KPS 评分高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组CA125、CEA、VEGF水平及KPS评分比较()
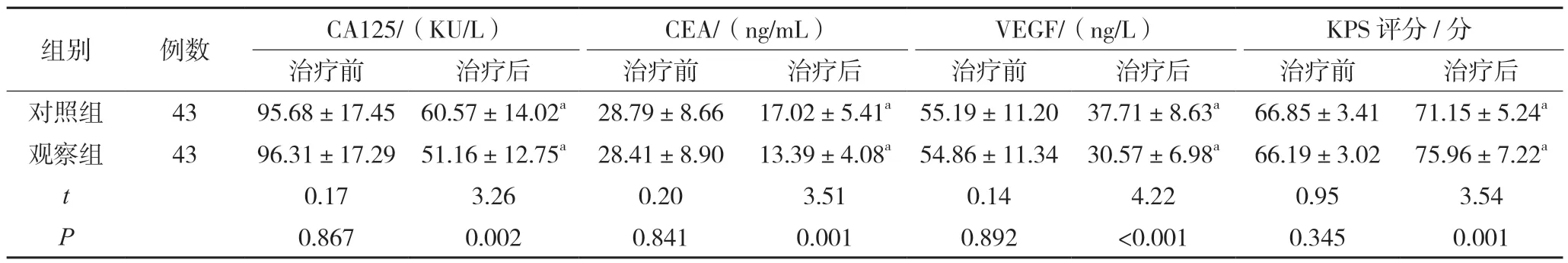
表2 两组CA125、CEA、VEGF水平及KPS评分比较()
注:与同组治疗前比较,aP<0.05。
2.3 不良反应比较
两组恶心/呕吐、骨髓抑制、腹痛腹泻、肝肾功能损害、白细胞下降发生率比较,差异无统计学意义(P>0.05)。见表3。
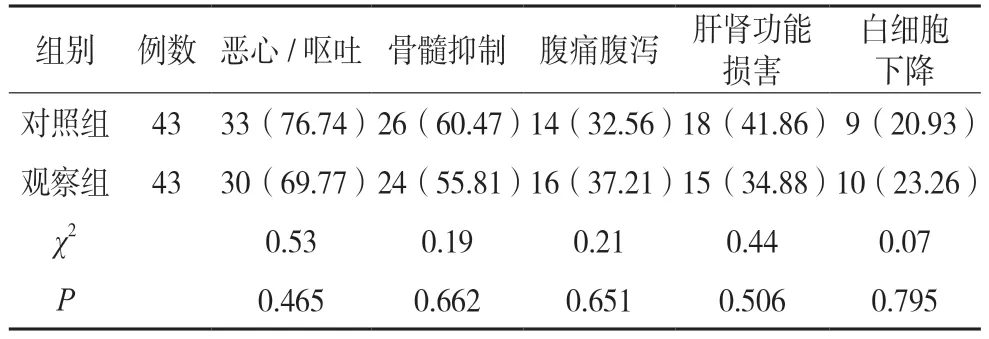
表3 两组不良反应比较[例(%)]
3 讨论
多数晚期卵巢癌患者已出现胸部及腹腔积水、病灶转移,采用手术治疗难以将癌细胞彻底清除,故晚期卵巢癌患者往往通过非手术治疗以缓解临床症状,延长患者生存期。目前临床上主要采用多种化疗药物治疗卵巢癌,如TP 化疗方案(顺铂与紫杉醇联合使用),顺铂可对DNA 复制进行干扰,抑制癌细胞扩散或转移[5];紫杉醇主要通过加速微管蛋白聚集,促使微管稳定性得以提高,对肿瘤细胞有丝分裂进行抑制,抑制癌细胞生长[6]。
肿瘤的形成、增殖及发展是多基因参与、多因素作用的病理过程,新生血管的生成参与了肿瘤的生长[7]。VEGF 是卵巢癌病理过程中重要的调控因子,VEGF 可在诱导卵巢内膜生长、抑制卵巢内膜上皮细胞凋亡及增强卵巢内膜血管通透性等方面发挥作用[8]。CA125 属于常用的血清肿瘤标志物,多来源于卵巢癌上皮组织,由肿瘤分泌于血清中,卵巢癌患者血清中CA125 水平较高。CEA 属于结构复杂的可溶性糖蛋白,在多种癌组织中水平均升高[9]。本次研究结果显示,观察组治疗DCR 高于对照组,治疗后CA125、CEA、VEGF 水平低于对照组,KPS 评分高于对照组;两组不良反应发生率比较相近。邓晓燕等[10]研究中得出,BEV 腹腔热灌注、静脉化疗联合治疗晚期卵巢癌效果优于单纯静脉化疗,可降低血清VEGF、MIF、HE4、CA125水平,与本次研究结果较为相似。提示出BEV 腹腔热灌注、TP 化疗联合治疗晚期卵巢癌抗肿瘤效果优于单纯TP 化疗治疗,有利于提高DCR,降低CA125、CEA、VEGF 水平,提高患者生存质量,且不良反应并未增加,临床应用安全可靠。BEV 是一种重组人源化单克隆抗体,可选择性与内源性VEGF 结合,阻碍VEGF 与位于卵巢癌血管内皮细胞的VEGF 受体结合,可对卵巢癌细胞分化、增殖进行抑制,抑制卵巢癌血管生成,抑制肿瘤生长[11]。卵巢位于盆腔深部,采用常规方法治疗晚期卵巢癌患者时,药物可能无法穿透腹膜达到盆腔,而BEV腹腔热灌注治疗可直接作用于病灶处,药物浓度高,有利于增强对肿瘤细胞的杀灭作用[12]。同时BEV腹腔热灌注治疗中温热效应与药物可发挥协同作用,利用热效应机制,能够增加血供,促进血液循环,加速药物运动,增加药物的渗透性,经加热后的癌细胞会合成热休克蛋白,使机体对癌灶产生特异性免疫应答,增强机体免疫力,有利于杀灭肿瘤细胞。针对卵巢癌患者,采用BEV 腹腔热灌注、TP 化疗联合治疗可维持较高的血药浓度,可对肿瘤细胞产生持续杀伤作用,控制肿瘤生长。
综上所述,BEV 腹腔热灌注联合TP 化疗治疗晚期卵巢癌有利于降低CA125、CEA、VEGF 水平,提高患者生存质量,增强卵巢癌治疗效果,且不良反应并未增加。

