不同益生菌对猪流行性腹泻病毒-德尔塔冠状病毒二联灭活疫苗小鼠免疫及肠道微生物的影响
燕 阳,张 宇,吴 琪,韩如意,刘林萍,高淑黠,叶以哲,叶 昱,2,黄冬艳,2,丁 珍,2,唐玉新,2,宋德平,2*
(1.江西农业大学 动物科学技术学院,江西 南昌 330045;2.江西省动物疫病防控制剂工程研究中心,江西 南昌 330045)
【研究意义】猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)和猪德尔塔冠状病毒(Porcine deltacoronavirus,PDCoV)是当前主要的猪病毒性腹泻病原[1]。然而,现有市售PEDV疫苗免疫后因抗体水平低且持续时间短而难以对猪群,特别是新生仔猪提供充足的保护。研究发现,益生菌可以改善宿主肠道菌群和免疫水平,从而达到促进疫苗抗体水平的效果[2-3]。发掘有效促进PEDV 和PDCoV 疫苗免疫效果的益生菌将有利于该疫苗的临床推广应用。【前人研究进展】PEDV 和PDCoV 均属于套式病毒目(Nidovirales)、冠状病毒科(Coronaviridae),其中PEDV 为α 冠状病毒属(alpha coronavirus)成员,PDCoV 为δ 冠状病毒属(delta coronavirus)成员。2010年,高毒力的PEDV 变异株引发的腹泻疫情迅速在全国各省市猪群暴发,甚至经典毒株疫苗免疫过的猪群也不能幸免,PED疫情至今仍持续暴发[4]。2012年,中国香港学者首次从猪粪便样品中检测到PDCoV[5]。2014年,美国在爆发PED 猪群样品中检测并分离出PDCoV,并通过动物试验证实该病毒可导致猪只腹泻和死亡[6]。随后,在中国大陆、加拿大、墨西哥、泰国、韩国及欧洲多国相继报道PEDV 和PDCoV 引起的腹泻疫情[7-9]。在临床上,PEDV 和PDCoV 均可造成各年龄阶段的猪只感染和腹泻,以新生仔猪的感染和发病最为严重,是新生仔猪发病和死亡的主要原因。流行病学调查显示,变异株PEDV在腹泻样品中的检出率超过60%,PDCoV的检出率也接近30%,远超过其他腹泻相关病毒的检出率[10-11]。尽管已有PEDV 疫苗上市使用,但以PEDV 为主要病原引起的腹泻疫情依然持续存在,主要原因可能与疫苗激发的抗体水平较低,持续时间短有关[12]。因此,如何提高疫苗抗体水平是猪群,特别是新生仔猪抵抗PEDV 和PDCoV 感染的关键。益生菌(Probiotics)是指对机体有一种或多种有益作用的一类微生物,可天然存在或经人工添加后定植于自然界、动物和人体肠道、呼吸道、生殖道或皮肤[13]。研究发现,益生菌的作用非常广泛,可促进或调节环境或机体的菌群平衡,促进营养物质吸收;抵抗外来微生物入侵,降低机体应激反应,提高免疫力等作用[14]。益生菌可通过自身产生分泌物、分解代谢营养物质(如短链脂肪酸、丁酸、丙酸等)及作为抗原等发挥保护及治疗机体,从而调节机体免疫功能,尤其是肠道免疫[15]。益生菌调节免疫主要是促进肠道淋巴细胞生成,增强淋巴细胞和效应B 细胞的活力,从而释放相关细胞因子,如白细胞介素2(interleukin 2,IL-2)、IL-10、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α);益生菌可促进机体免疫球蛋白的生成,如免疫球蛋白M(immunoglobulin M,IgM)和免疫球蛋白A(immunoglobulin A,IgA)[16]。
【本研究切入点】研究表明,益生菌或其代谢产物对一些病毒疫苗具有免疫刺激和提高抗体水平及保护效果的作用[17-18]。Inatomi 等[19]发现饲喂芽孢杆菌(Bacillus subtilis)、丁酸梭菌(Clostridium butyricum)和粪肠球菌(Enterococcus faecalis)组成的复合益生菌可显著提高免疫PEDV 弱毒疫苗怀孕母猪的IgA 和IgG水平,同时也可提高所产仔猪的出生重和成活率。Jin等[20]给断奶仔猪饲喂乳酸杆菌(Lactobacillus)后接种传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)疫苗,发现可显著提高血清中抗TGEV IgG 水平。Isolauri 等[21]发现在轮状病毒疫苗中加入干酪乳杆菌(Lactobacillus casei)可显著提高特异性IgM 的细胞比例及转变率。胡兴义等[22]使用复合益生菌饲喂断奶仔猪,发现可明显提高断奶仔猪血清中IL-6和TNF-α 水平。以上研究表明益生菌可提高疫苗的抗体水平及宿主的免疫功能。针对当前PEDV等腹泻病毒疫苗抗体水平低、保护力弱的问题,或许益生菌是一种值得尝试的增效手段。【拟解决的关键问题】本研究以SPF 级雌性昆明鼠为试验材料,拟比较单一和复合益生菌对PEDV 和PDCoV 疫苗抗体、宿主免疫因子及肠道形态、肠道菌群丰度的影响或变化,以此评估益生菌对疫苗和动物健康的作用,为筛选对PEDV和PDCoV二联灭活疫苗提质增效的益生菌提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 无特定病原体(specific pathogen free,SPF)级雌性昆明鼠32 只,6~8 周龄,体质量18~22 g,由湖南斯莱克景达实验动物有限公司提供(实验动物生产许可证编号:SCXK(湘)2021-0002)。
1.1.2 试验益生菌与疫苗 复合益生菌:有效微生物(effective microorganism,EM)(2.0×109cfu/mL)由江西农业大学预防兽医学实验室制备和提供,包括乳酸菌(Lactobacillus,84.02%)、拟杆菌(Bacteroides,1.89%)等5个科28个属的多种细菌[23]。枯草芽孢杆菌(6.0×109cfu/mL)和乳酸杆菌(2.0×109cfu/mL)由山东宝来利来生物工程股份有限公司提供。试验用猪流行性腹泻病毒(PEDV)、猪δ 冠状病毒(PDCoV)二联灭活疫苗(JX01株+JGS01株)由江西农业大学预防兽医学实验室制备(灭活前PEDV、PDCoV 含量均不低于107.5TCID50/mL)。
1.2 试验设计
随机将32 只昆明鼠分成4 组,每组8 只。在试验第1 天和第14 天每只小鼠皮下接种PEDV-PDCoV二联灭活疫苗(JX01株+JGS01株)0.2 mL。3组小鼠分别在试验第1天开始灌胃EM益生菌0.3 mL/只(EM组)、枯草芽孢杆菌(Bacillus subtilis)0.3 mL/只(Bac组)和乳酸杆菌(Lactobacillus)0.3 mL/只(Lac组),第四组为饲喂基础日粮的对照组(NC组)。
1.3 测定项目与方法
1.3.1 组织样品采样和组织切片检查 试验小鼠安乐死,剖检观察小鼠各个器官与肠道病变。每组3只小鼠采集空肠、回肠各2~3 cm,放入生理盐水中轻轻洗去肠内容物后,置于4%多聚甲醛固定48 h。参照夏莹莹等[24]的方法进行切片制备、HE染色,参考陈燕君等[25]的方法检测分析绒毛长度(villus height,VH)、隐窝深度(crypt depth,CD)、绒毛长度/隐窝深度值(VH/CD)。
1.3.2 抗体水平检测 在试验第1,7,14,21,28 天采集所有小鼠的血液。参照彭棋等[26]方法测定小鼠血清中PEDV 和PDCoV 中和抗体,简要方法为:将长满单层的Vero81 细胞用胰酶消化吹后用DMEM 吹匀,按每孔3×104~5×104个细胞接种于96 孔细胞培养板,待细胞长满时用0.01 mol/L PBS(pH 值7.2)洗涤2 次。待检血清56 ℃水浴灭活30 min,备用;在96 孔细胞培养板上,用含10 μg/mL 胰酶的无血清的DMEM 细胞培养液将待检血清做连续倍比稀释。从1∶4 至1∶128,每个稀释度做4 个重复,每孔50 μL;用含10 μg/mL 胰酶的无血清DMEM 培养液将病毒稀释为200 TCID50/0.1 mL,然后加入到血清稀释孔中,每孔50 μL,置5% CO237 ℃孵育1 h后加入已洗涤的96孔细胞板内,每个稀释度接种4孔,每孔0.1 mL;37 ℃含5% CO2的培养箱吸附1 h,吸弃接种液,同时设有血清毒性对照、病毒对照和正常细胞对照;每日观察并记录细胞病变(CPE)情况,96~120 h 后按Reed-Muench 法计算被检血清中和抗体效价。PDCoV 中和抗体效价测定方法同PEDV,但测定用细胞为LLC-PK1 细胞。
1.3.3 血清免疫因子水平测定 采用液相悬浮芯片技术Luminex LabEx 多因子检测系统LX-MultiDTM-10(Bio-Rad 公司)检测EM 和NC 组小鼠血清中TNF-α、γ 干扰素(interferon γ,IFN-γ)、白介素1β(interleukin 1β,IL-1β)、IL-2、IL-4、IL-5、IL-6、IL-10、IL-12p70、趋化因子配体1(C-X-C motif chemokine ligand 1,CXCL1)水平,由上海乐备实优宁维生物技术有限公司完成[27]。
1.3.4 肠道菌群组成高通量测序(1)样品采集。分别在试验第1,14,28 天采集各组小鼠粪便样品,每只小鼠采集3~4 粒粪便,置于1.5 mL EP管中,-20 ℃保存[23]。
(2)高通量测序。采集小鼠试验28 d粪便样品,利用QIAamp Stool DNA Extraction Kit(Cat#51504,QIAGEN)提取DNA,由杭州谷禾信息技术有限公司采用Illumina MiSeq系统进行微生物16S rRNA V4区测序。
(3)生物信息学分析。由Illumina Miseq测序得到原始数据先经过质量过滤再用于下游分析:Cutadapt软件用于去除reads 中的adapter 序列并修剪reads 末端质量小于Q20 的碱基。使用FLASH 连接Miseq Pair-end两端Reads,并根据barcode信息进行分样,同时切除两端引物和barcode,舍弃不含barcode和两端引物的序列[28]。得到的有效序列采用QIIME 2.0分析流程进行分析,具体流程参照宋德平等[29]方法。
1.4 统计学分析
采用SPSS 25.0软件对数据进行统计学分析,小鼠血清IgG 抗体、肠绒毛长度和隐窝深度数据采用单因素方差分析(ANOVA),P<0.05 表示差异显著,P<0.01 表示差异极显著。采用Mann-WhitneyU检验对肠道菌群α 多样性指数及肠道菌群丰度差异显著性进行分析。采用Graphpad 5.0 软件进行抗体水平数据作图。
2 结果与分析
2.1 不同益生菌对猪病毒性腹泻疫苗抗体水平的影响
在试验28 d 内,无论是对照组(NC 组)还是饲喂益生菌组(Lac、EM 和Bac)小鼠血清中PEDV 和PDCoV 中和抗体水平均呈上升趋势,第二次免疫(14 d)后出现了抗体水平上升的拐点(图1 和图2)。与对照组(NC)相比,试验结束时饲喂益生菌小鼠血清中PEDV和PDCoV中和抗体水平有不同程度提高,其中EM组小鼠血清中PEDV和PDCoV中和抗体水平要明显高于其他组。

图1 不同益生菌对小鼠PEDV抗体水平的影响Fig.1 Effect of different probiotics on antibody titers against PEDV in mice

图2 不同益生菌对小鼠PDCoV抗体水平的影响Fig.2 Effect of different probiotics on antibody titers against PDCoV in mice
2.2 益生菌对血清细胞因子浓度的影响
对PEDV 和PDCoV 抗体水平促进效果最明显的EM 添加组与对照组小鼠试验第28 天时血清中免疫相关细胞因子水平分析发现,EM 组的TNF-α、IFN-γ、IL-1β、IL-5、IL-6、IL-10、CXCL1 平均浓度分别为(19.58±0.99),(3.21±0.12),(1.93±0.11),(5.60±0.46),(0.12±0.03),(2.55±0.29),(37.87±1.93)pg/mL,均极显著高于对照组相应因子的浓度;而IL-4、IL-12p70的浓度分别为(0.15±0.03),(2.19±0.24)pg/mL,均极显著低于对照组相应因子的浓度;IL-2则在EM组和对照组均无差异(表1)。
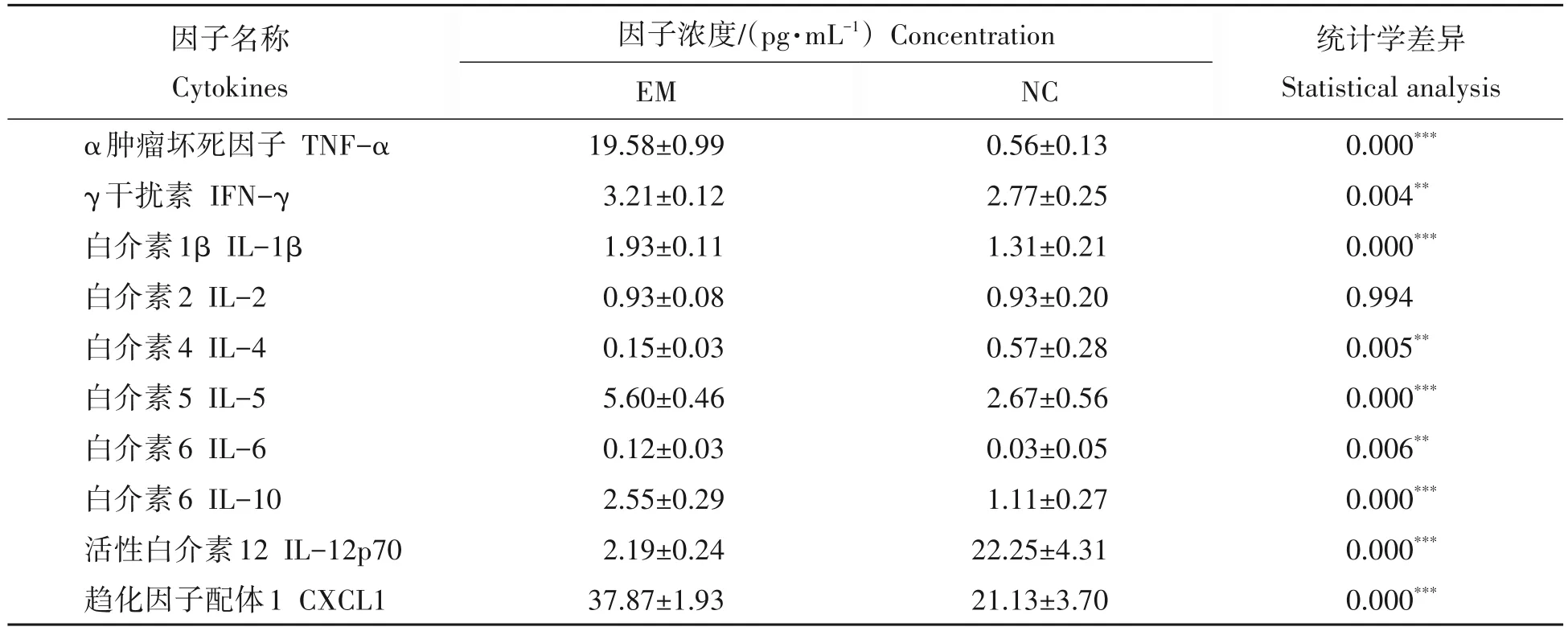
表1 EM益生菌对小鼠血液中免疫分子的影响Tab.1 Effect of EM probiotics on serum immune cytokines in mice
2.3 不同益生菌对小鼠肠道形态的影响
对空肠和回肠组织切片观察发现各组肠上皮细胞形态、绒毛长度和隐窝深度存在差异(图3)。EM 组空肠绒毛长度显著大于其他3 组,试验组回肠绒毛长度均显著大于NC 组(P<0.05)(表2)。隐窝深度方面,NC 组空肠隐窝深度显著大于试验组,而NC 组回肠隐窝深度显著小于Lac 和Bac 组(P<0.05)。

图3 不同处理组小鼠空肠和回肠形态Fig.3 Morphology of jejunum and ileum in mice under different treatments

表2 不同处理对小鼠肠绒毛、隐窝深度的影响Tab.2 Effect of different treatments on intestinal villus height(VH)and crypt depth(CD)in mice
2.4 不同益生菌对小鼠肠道菌群群落结构的影响
2.4.1 16S rRNA 高通量测序数据 本试验的36 个临床样本共产生了3 576 606 条pair-end 的原始读长(raw read)序列,用QIIME 2.0软件包对数据进行质控、过滤及嵌合体去除后获得了3 326 988条有效读长(clean read),平均每个样本92 416条。将所有有效读长与Greengenes数据库进行比对,根据序列97%相似性进行OTU 划分,共被划分为3 743 个代表性OTUs(表3)。随着试验时间增加,添加益生菌小鼠肠道菌群OTU 数量增加趋势比NC 组小鼠肠道菌群OTU 数增加趋势更为明显,EM 组的OTU 数量平均最高。试验开始时(0 d)各组小鼠肠道菌群OTU数量及alpha指数无显著差异;14 d时,EM菌组Observed species指数与NC组相比存在显著差异(P<0.05),表明给小鼠人工灌喂EM 菌能够改变其肠道内菌群种类数量。与EM 组相比Lac组、Bac组Observed species 指数存在显著差异,表明给小鼠人工灌喂不同菌种其肠道内菌群种类数量也不同。28 d时,EM 组Observed species 指数与NC 组相比存在显著差异(P<0.05),表明给小鼠人工灌喂EM菌能够改变其肠道内菌组成和丰度。

表3 16S rRNA高通量测序小鼠肠道菌群OTU及Alpha多样性指数Tab.3 OTU numbers and alpha diversity indexes of mice intestinal microbiota sequenced by 16S rRNA highthroughput sequencing
2.4.2 门水平菌群分布与优势菌群分析 试验开始时(0 d)各组小鼠菌群组成无显著差异,饲喂益生菌与对照组以及各益生菌组之间在试验第14 天时菌群分布和丰度存在差异。各组小鼠从试验开始至第28 天结束时肠道菌群也呈现动态变化过程,其中所有试验组小鼠肠道菌群中拟杆菌门细菌丰度逐渐增加而厚壁菌门细菌丰度逐渐下降的趋势;添加益生菌组小鼠肠道放线菌门的丰度逐渐上升趋势(图4)。

图4 不同益生菌对小鼠肠道门水平菌群丰度的影响Fig.4 Comparison of microbiota abundances at phylum level during the experiment
从试验不同阶段组间肠道菌群分析发现,第14 天小鼠肠道菌群丰度>1%的菌群主要有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线杆菌门(Actinobacteria)、变形菌门(Proteobacteria),其中80%以上菌群分布于厚壁杆菌门和拟杆菌门(表4)。Bac组与EM组、对照组,EM组与Lac组之间厚壁菌门丰度具有显著差异(P<0.05);Bac 组与其他3 组,Lac 与对照组在拟杆菌门丰度具有显著差异(P<0.05)。试验结束时,各组主要菌群为厚壁菌门、拟杆菌门、放线菌门和变形菌门。EM 组放线杆菌门相对丰度显著上升,拟杆菌门相对丰度显著下降(表5)。对照组与Bac组和EM组,EM组与Lac组在放线菌门丰度具有显著差异,EM 组与对照组在拟杆菌门丰度具有显著差异,Bac 组与EM 组在变形菌门丰度具有显著差异;对照组与3个试验组在疣微菌门(Verrucomicrobia)丰度具有显著差异(P<0.05)。
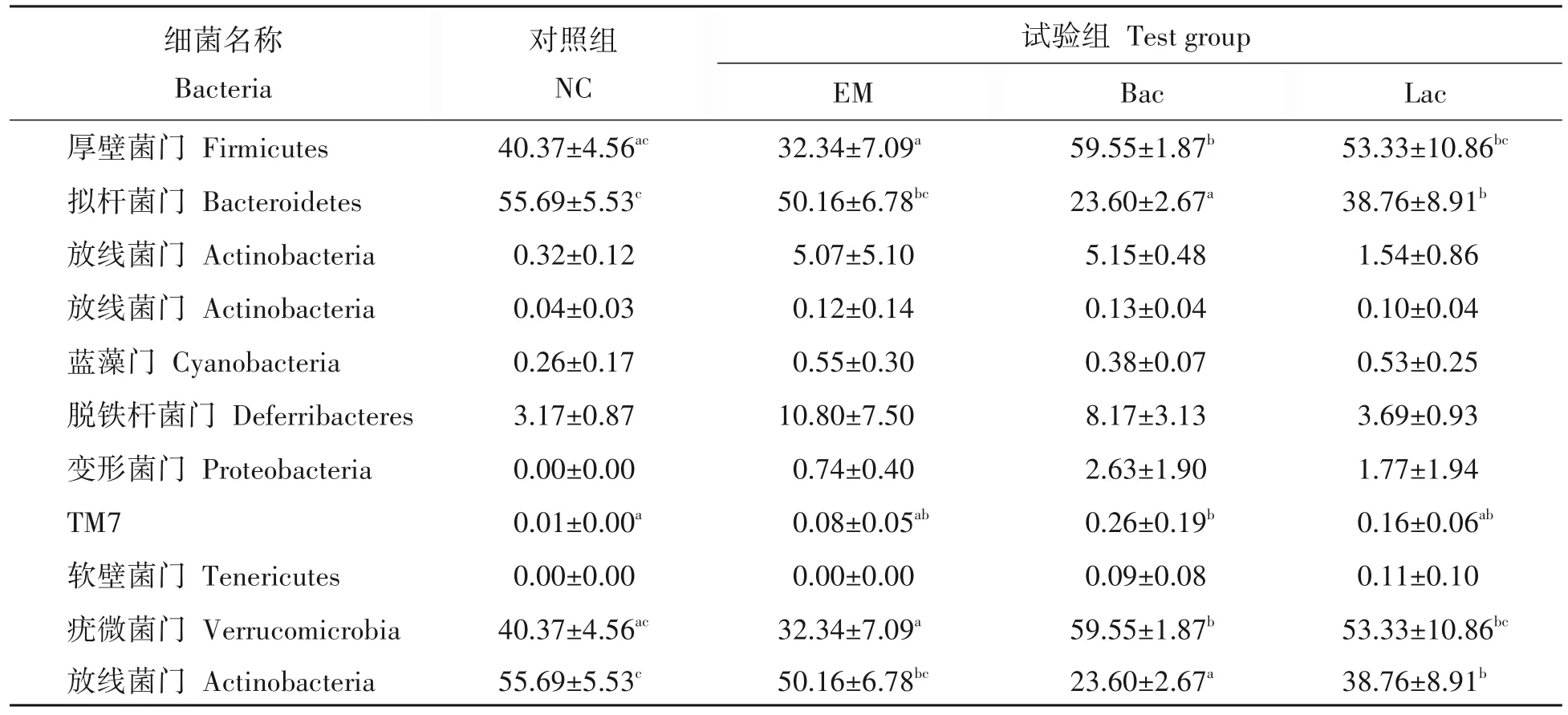
表4 不同益生菌对小鼠肠道门水平下的优势菌群丰度的影响Tab.4 Distribution of dominant microflora at phylum level at 14 d

表5 不同益生菌对28 d小鼠肠道菌群门水平下的优势菌群丰度的影响Tab.5 Distribution of dominant microflora at phylum level at 28 d
2.4.3 属水平菌群分布与优势菌群分析 在属水平上,添加了益生菌组小鼠肠道的拟杆菌属(Bacteroides)和疣微菌(Verrucomicrobia)丰度显著低于NC 组。EM 组小鼠肠道的放线菌属(Actinobacteria)和变形菌属(Proteobacteria)丰度高于其他组,饲喂益生菌组的厚壁菌属(Firmicuteria)丰度均高于对照组(表6)。
试验28 d时,EM 组小鼠肠道内乳酸菌属(Lactobacillus)和普雷沃氏菌属(Prevotella)细菌的丰度显著高于其他3组,EM组和Lac组的Akkermansia属菌丰度显著高于其他两组(P<0.05)(表7)。NC组的Bacteroides属均丰度显著高于EM 组和Lac 组,NC 组的Corynebacterium属菌丰度显著低于Bac 组和EM 组,Bac组和Lac组的Staphylococcus属菌显著高于EM组和NC组。
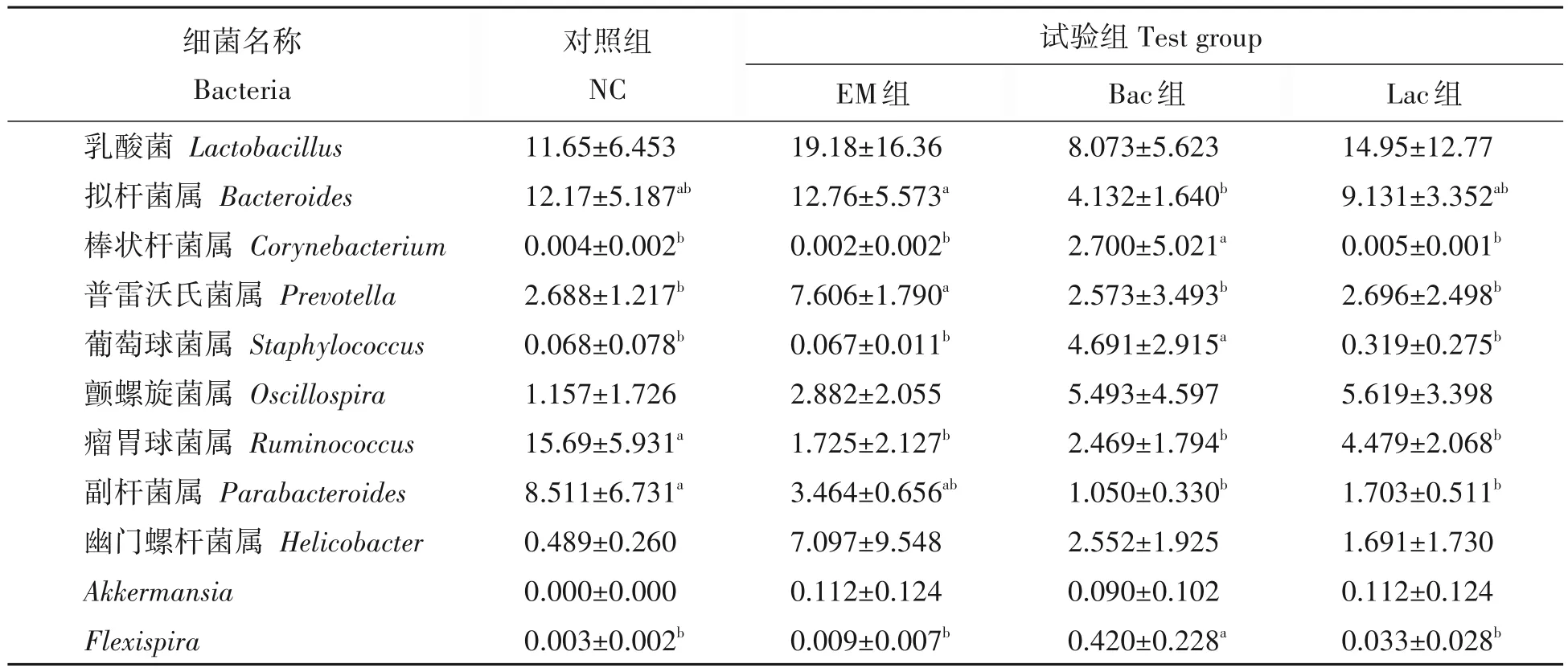
表7 不同益生菌对28 d小鼠肠道属水平下的优势菌群丰度的影响Tab.7 Distribution of dominant microflora at genus level at 28 d
3 结论与讨论
PEDV 和PDCoV 是当前导致新生仔猪腹泻和死亡的主要病原,目前用于预防PEDV 的主要手段为疫苗,但临床上发现疫苗常常因抗体水平不高而导致保护力不足。益生菌是一种新型绿色环保添加剂,可通过定植于肠道而调节肠道微生物平衡,乃至调节动物免疫、循环和其他组织系统的作用,是重要的动物饲料添加剂,也可以作为动物疾病防治产品而被广泛使用[22]。为探索益生菌对PEDV和PDCoV疫苗的作用,本试验比对了复合益生菌(EM)和单种益生菌(枯草芽孢杆菌和乳酸杆菌)对PEDV和PDCoV二联灭活疫苗的抗体水平的影响。结果发现,添加益生菌可提升血清中两种病毒的抗体水平,复合益生菌对抗体水平的提升效果优于单种益生菌。有研究表明,益生菌主要影响先天免疫反应,通过这种方式调节感染早期抗病毒炎症反应以及随后的细胞和体液免疫反应[30]。由此推测,本试验中添加益生菌可能促进了宿主的先天性免疫和细胞、体液免疫,从而使得宿主产生更强的抗PEDV和PDCoV反应,从而促进了疫苗抗体的生成。
已发现多种特异性益生菌菌株可增强先天性免疫反应,特别是吞噬活性和NK细胞杀伤活性,其中,双歧杆菌能够增强IgA 的分泌,促使小肠粘膜上的淋巴细胞的分化及增殖[30],并激活自然杀伤细胞和巨噬细胞,生成IL-1、IL-6、IL-12、TNF-ɑ 及IFN 等细胞因子,激活肠粘膜免疫系统,调节机体的免疫应答,进而增强机体免疫力[31-32]。本试验中,添加了EM 益生菌的小鼠血清中TNF-α、IFN-γ、IL-1β、IL-5、IL-6、IL-10、KC 浓度均极显著高于未添加组。感染性腹泻病原体主要侵袭肠上皮细胞,可引起肠液分泌增多和吸收障碍或者炎症[33]。益生菌可直接黏附于上皮细胞,从而在肠道黏膜表面定植,形成一道屏障,阻挡肠内有害病原的侵入[31]。IL-6、TNF-α、内毒素等属于炎症反应类指标,其上升提示机体处于免疫应答状态,研究表明,人体中大部分免疫细胞和分泌的炎症介质都集中在肠道中,益生菌定植于肠道内,因此益生菌与人体免疫系统之间有最直接的关系[34]。基于本试验结果推测益生菌的使用可刺激机体免疫系统,上调了免疫相关分子,从而促进抗体水平的提升,但其具体分子机制还需要进一步研究。大量研究表明,益生菌增强机体免疫的途径主要是促进肠道淋巴细胞生成,增强淋巴细胞和效应B 细胞的活力,从而促进机体免疫球蛋白的生成,如IgM 和IgA[20,31]。部分益生菌活菌制剂已被证明具有强大的抗体应答作用。Kaila 等[35]比较乳酸杆菌的活菌制剂和灭活制剂对患轮状病毒腹泻的作用,结果表明活菌制剂能够提升轮状病毒的特异性IgA抗体应答,而灭活菌制剂不能。本研究发现添加益生菌14 d后单一或复合益生菌均可不同程度地提升PEDV 和PDCoV 二联疫苗的抗体水平,与Inatomi[19]和Jin 等[20]在PEDV、TGEV 疫苗上的研究结果相似。因此,添加益生菌不仅可促进肠道内益生菌的定植,同时也可增强机体的免疫反应,从而促进疫苗抗体水平。
试验通过观察测量各组小鼠的空肠和回肠的肠绒毛长度、隐窝深度、绒毛长度/隐窝深度值发现,EM组空肠绒毛长度显著长于其他3 组;NC 组空肠绒毛长度和隐窝深度与其他3 组均有显著差异;Bac 组回肠绒毛长度显著长于其他3组;NC组回肠绒毛长度与其他3组均有显著差异;NC组和EM 组隐窝深度与Lac 组与Bac 组均有显著差异。结果表明,饲用益生菌可以促进肠道上皮细胞的健康,这可能与益生菌可以促进营养物质消化吸收,缓解肠道细胞凋亡,维持肠道形态结构完整的特性有关[15]。
病毒性腹泻常常会导致肠道菌群失调,肠道内环境紊乱,进而降低肠道黏膜屏障功能,容易造成继发感染和免疫力降低。本团队曾比较分析感染PEDV 母猪和仔猪肠道菌群的变化,发现感染PEDV 后,肠道内菌群种类减少,益生类菌群(如乳酸杆菌、双歧杆菌等)丰度大大降低,而致病性菌群丰度显著上升,如产气荚膜梭菌(Clostridium perfringens)等[36]。本试验中,复合益生菌制剂组与自然恢复相比复合益生菌制剂组香浓指数值明显上升,辛普森指数明显下降;与正常组相比益生菌组Chao1 指数及辛普森指数无明显差异,表明益生菌复合物制剂可明显促进肠道菌群失衡模型小鼠肠道菌群多样性恢复。黄蕊蕊等[37]分析了复合益生菌粉对抗生素清除菌群小鼠肠道菌群恢复动力学,发现益生菌组与正常组相比Chao1 指数、ACE 指数及辛普森指数无明显差异,添加益生菌组肠道菌群的辛普森指数与自然恢复组相比明显上升,表明益生菌制剂可在一定程度上促进肠道菌群失衡模型小鼠肠道菌群多样性恢复。试验添加益生菌小鼠肠道菌群OTU 数量比NC 组呈增加的趋势,EM 组的OTU 数量平均最高。试验前所有小鼠肠道80%以上的菌群分布于厚壁杆菌门和拟杆菌门,从第14天开始饲喂益生菌组小鼠肠道菌群组成和丰度均存在改变。试验结束时,EM 组小鼠肠道内乳酸菌和普雷沃氏菌属丰度显著高于其他3 组,EM组和Lac组的Akkermansia菌属显著高于其他两组。乳酸菌是一类利用碳水化合物产生乳酸的革兰氏阳性菌,大多数为厌氧菌。作为人类和动物肠道的正常菌群,乳酸菌可以增强肠道上皮细胞的屏障功能,诱导粘液蛋白和IgA的分泌,从而达到增强宿主天然免疫和获得性免疫应答的调节[38]。普雷沃氏菌是一类非运动的革兰氏阴性杆菌,包括50多个不同的物种,大多数定植于口腔和肠道;该类菌主要发酵产物为乙酸和琥珀酸及少量异丁酸、异戊酸和乳酸[39]。此外,普雷沃氏菌也是肠道内重要的维生素B1(Vitamin B1,VB1)合成菌,而VB1是三羧酸循环过程中酶的辅助因子,可为初始B细胞提供能量而促进其激活,从而有利于B细胞分化产生浆细胞,促进抗体产生[40]。Akkermansia菌属是一类厌氧、无运动的属于疣微菌门的革兰氏阴性菌,肠道中低丰度的Akkermansia可能表明黏液层较薄,从而导致肠道屏障功能减弱。该菌目前被认为是肠道最为关键的益生菌种之一,在改善代谢紊乱(如肥胖、糖尿病、脂肪肝)、肠道炎症、免疫和神经退行性疾病等方面具有巨大的应用前景[41]。基于本试验结果中饲喂益生菌后以上3种类型菌群丰度的显著增加,推测这些菌群可能参与了宿主肠道屏障、免疫细胞激活及降低肠道炎症等方面具有重要作用,增加的有益菌可通过调节免疫因子的产生间接上调了免疫系统从而增强了疫苗抗体水平的上升。
日粮添加EM 益生菌可促进PEDV、PDCoV 二联灭活疫苗抗体产生及上调相关免疫因子,保护肠道上皮细胞形态,调节宿主肠道菌群的组成与丰度,增加乳酸菌(Lactobacillus)和普雷沃氏菌(Prevotella)等有益菌的丰度。研究结果将为提高PEDV、PDCoV疫苗免疫效果和调节宿主肠道微生物提供试验依据。
致谢:国家级大学生创新创业训练计划项目(202110410008)对本研究给予了资助,谨致谢意!

