CT引导下射频消融治疗157例肺癌合并气胸并发症的研究
刘继伟,杨 瑞
河南省胸科医院暨郑州大学附属胸科医院医学影像科,河南 郑州 450000
肺癌是世界上常见的恶性肿瘤,发病率呈逐年上升趋势[1]。消融技术已被国内外多项研究[2-3]证实为肝脏、肺部肿瘤治疗的重要手段,射频消融(radiofrequency ablation,RFA)是目前治疗实体瘤应用最广泛的消融技术[4],在肺癌的治疗中已得到广泛应用,但其并发症较常见,部分可能造成严重后果,必须引起重视[5],气胸是肺癌术中及术后发生率最高的并发症[6]。本研究选取2016年6月—2020年7月河南省胸科医院收治的157例肺癌患者作为研究对象,对计算机体层成像(computed tomography,CT)引导下RFA治疗肺癌的气胸发生及其相关风险因素进行分析,报道如下。
1 资料和方法
1.1 一般资料
选取2016年6月—2020年7月河南省胸科医院收治的157例肺癌患者,其中男性97例,女性60例,年龄46~83岁,平均年龄(63.2±7.6)岁。所有患者由医院伦理委员会批准,均经纤维支气管镜或CT引导下经皮肺穿刺活组织病理学和/或细胞学检查确诊。
纳入标准:① 通过经皮肺穿刺或纤维支气管镜活组织病理学检查确诊为肺癌;② 增强CT或正电子发射体层成像(positron emission tomography,PET)/CT评价无全身其他部位的转移;③ 因心肺功能差、高龄等不能耐受手术者;④ 拒绝行手术切除术。排除标准:① 伴有阻塞性肺不张、肺纤维化或严重肺炎;② 合并大量恶性胸腔积液;③ 穿刺部位或病灶周围存在严重感染;④ 有严重出血倾向及凝血功能障碍等;⑤ 肝、肾、心等各脏器功能严重不全者,且无法在短期内得到纠正或改善,致无法耐受RFA。
1.2 影像学检查及治疗方法
采用美国RITA公司生产的RITA1500肿瘤RFA治疗仪,功率1~250 W。引导装置采用荷兰Philips公司生产的Ingenuity型64排螺旋CT。
术前检查及准备:① RFA术前1周内进行全身相关检查,以评估患者的身体状况;② 停用抗凝、抗血小板聚集及抗血管生成药物至少1周以上;③ 充分告知患者和家属手术内容和相关风险,并签署知情同意书;④ 禁饮食2 h;⑤ 指导患者进行呼吸训练,力求呼吸频率及幅度一致,提高穿刺的精确性;⑥ 建立静脉通道,进行面罩吸氧,实时监测患者的生命体征,如血氧饱和度、呼吸频率、脉搏、心电及血压;⑦ 术前30 min所有患者均采取磷酸可待因片15 mg口服、地西泮注射液(安定)10 mg肌内注射、甲氧氯普胺注射液(胃复安)10 mg 肌内注射等镇咳、镇定、止吐预防性措施;⑧ 根据患者的个体化情况,术前根据检查结果,对患者病情进行充分的讨论并制订详细的手术方案。
RFA治疗:结合患者实际情况,采用最合适体位(仰卧位、俯卧位及侧卧位),嘱患者平静呼吸,在闭气状态下进行胸部CT扫描。根据病灶位置进行规划扫描,尽量减少患者受辐射范围。扫描参数一般设定:管电压120 kV,管电流200 mA,层厚2 mm,高分辨肺窗为窗位-600 HU、窗宽-1 500 HU,软组织窗为窗位40 HU、窗宽350 HU。对设定好的穿刺点区域进行常规消毒,并局部麻醉后,快速将消融针穿刺至靶病灶,然后采用上述相同的扫描参数,进行局部扫描,确定治疗针准确无误后,固定消融针,开始RFA治疗。术中所有患者均同时给予地佐辛注射液5 mg加入250 mL生理盐水静脉滴注和盐酸吗啡注射液10 mg肌内注射。RFA结束,拔针并进行局部包扎,然后再次进行胸部CT平扫。扫描参数设定:管电压100 kV、管电流200 mA、层厚5 mm。确认靶区已完全消融,并观察胸部并发症的发生情况(出血、气胸等)。术后监测患者血压、血氧饱和度等生命体征。
1.3 随访
随访时间为患者病灶完全消融治疗结束至2021年7月。按照术后第1、3、6个月的原则进行随访,之后每隔6个月复查1次,以胸部增强CT结果来评判消融效果,观察病灶是否完全消融、肺内有无新发病灶、肺外转移、肺内或胸腔内是否出血以及并发症等情况。
术后随访观察安全性情况,根据美国介入放射学会(Society of Interventional Radiology,SIR)的标准进行评估分级,包括不良反应、轻微并发症及严重并发症。不良反应包括疼痛、消融后综合征、咳嗽和胸膜反应等;并发症包括气胸、胸腔积液、出血、感染、空洞形成等[7]。
1.4 统计学处理
采用SPSS 21.0统计分析软件,计量数据以表示,定量资料的比较用t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
共157例患者(共196个病灶)纳入本研究,肿块最长径0.39~6.18 cm,平均(3.57±1.23)cm。经皮穿刺活检确诊者100例,纤支镜活检确诊者57例。按肿瘤类型分类:非小细胞肺癌133例,小细胞肺癌24例;根据肿瘤部位分类:右上肺39例,右中肺22例,右下肺35例,左上肺27例,左下肺34例。共进行228次RFA,其中3例进行了2次,技术成功率达98.68%,每次消融时间(从消融开始至结束)9~36 min,平均(22.69±5.42)min,总手术时间(从患者进入手术室开始至离开)33~69 min。
随访至2021年7月,共27例患者死亡,其中23例死于肿瘤进展(其中18例为非小细胞肺癌,5例为小细胞肺癌),4例死于肺部感染(均为非小细胞肺癌)。所有患者治疗后均未出现手术相关的肺内或胸腔内出血以及严重并发症。
治疗相关的气胸发生共17例(10.83%)。其中15例术后常规胸部CT显示少量气胸,13例自述无明显胸痛、胸闷、呼吸困难等症状,血氧饱和度均在正常范围内,未行任何处理,3 d后复查常规胸部CT显示气胸消失;另2例患者有轻微的胸闷,行抽气后症状好转,3 d后复查常规胸部CT显示气胸消失。2例术后行常规胸部CT示中等量气胸,血氧饱和度为83%~90%。经胸腔闭式引流及吸氧等对症处理2 d后好转,1周后复查胸部CT示气胸完全吸收(图1)。
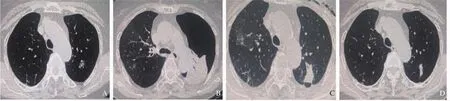
图1 典型病例1(患者,男性,79岁)左肺叶结节CT图像
单因素分析结果表明,肿瘤最长径、肿瘤位置、穿刺次数及消融时间是治疗相关气胸发生的不利风险因素(P<0.05,表1)。多因素分析结果表明,肿瘤位置、穿刺次数是治疗相关气胸发生的独立风险因素(P<0.05,表2)。
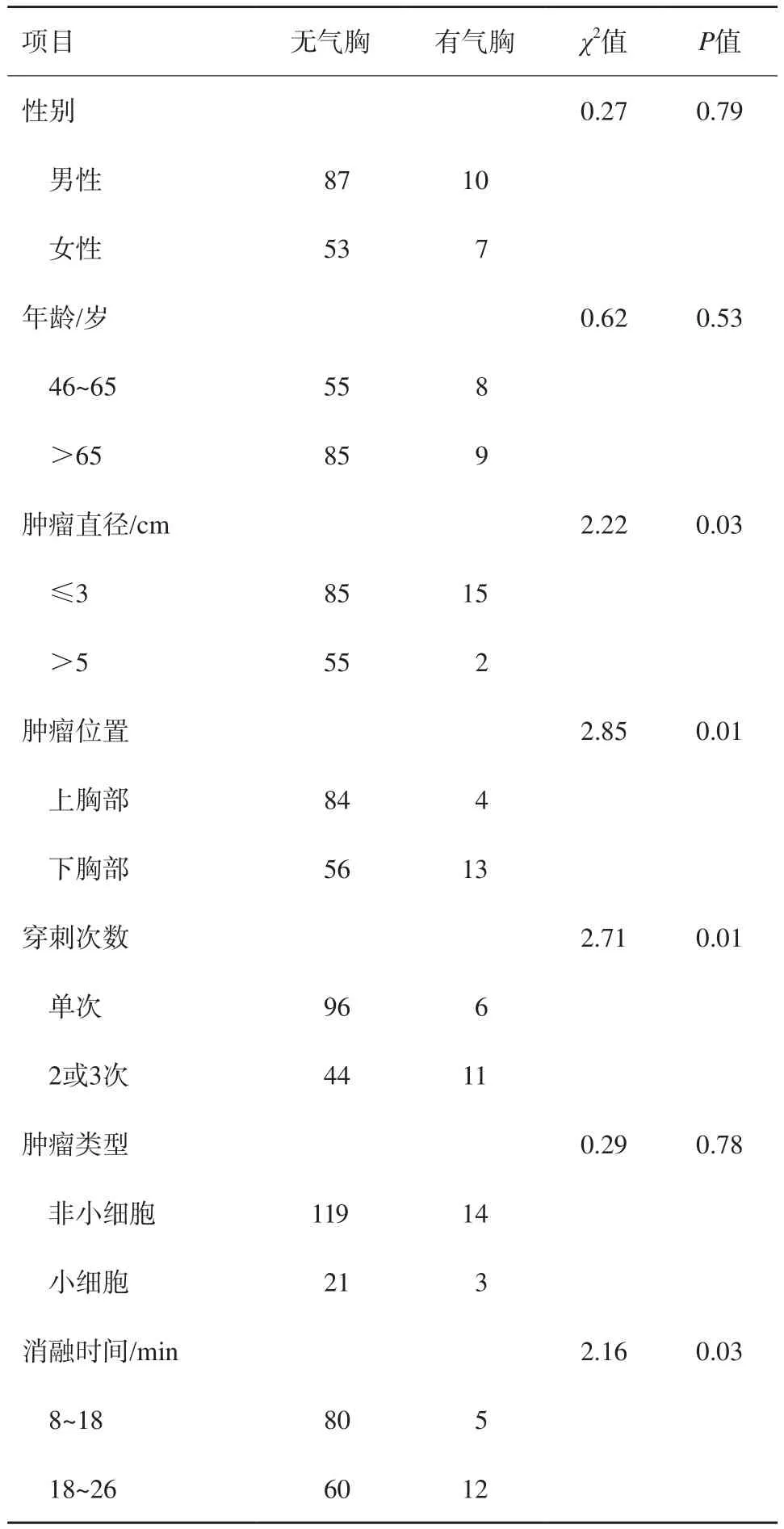
表1 影响RFA治疗肺癌患者术后气胸发生的单因素分析n
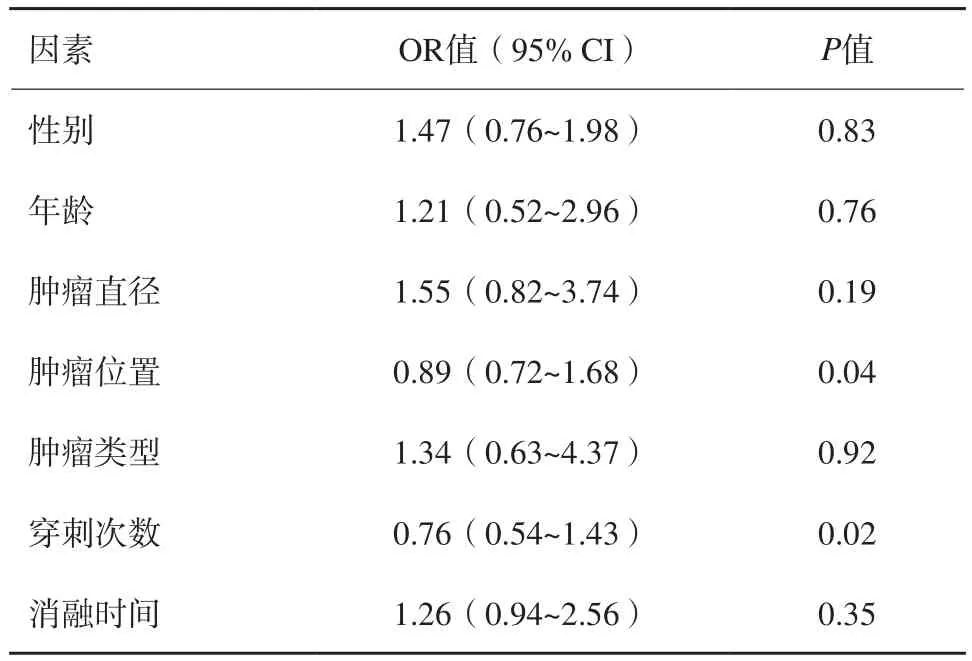
表2 影响RFA治疗肺癌患者术后气胸发生的多因素logistic回归分析
3 讨 论
2018全球癌症统计数据报告[8]显示,肺癌已成为第一癌症相关死因,是人类健康的“头号杀手”[9]。影像学引导下消融治疗肺癌、肺转移癌已被多个国际、国内临床指南及共识所推荐[10],RFA凭借其微创、安全、有效、可重复等诸多优点,已经广泛用于肺癌的治疗[11],但其并发症较常见,部分可能造成严重后果,必须引起重视[5],气胸是肺癌术中及术后发生率最高的并发症[6]。气胸可表现出不同程度的胸闷、气促、呼吸困难,严重者会在短时间内出现纵隔受压移位、肺脏萎缩等现象,造成心肺功能障碍[6]。
本研究中治疗相关的气胸发生共17例(10.83%),低于陶广昱等[6]报道的CT引导下胸部病变穿刺气胸的发生率(12.2%),并且既往对于肺穿刺气胸发生的报道,发生率一般在20%左右[12]。Schneider等[13]报道,由于消融的热凝固作用,局部区域的即刻加热能够使肺实质内的小血管及小气管受热闭塞,减少了肺内出血和气胸的发生;且刘钦等[14]在活检同步消融一体化诊疗方案治疗肺肿瘤的单中心临床分析中指出,胸部病变穿刺活检后紧接着消融能有效降低并发症的发生率。这就说明胸部病变的消融治疗所造成的穿刺气胸发生率要低于单纯穿刺造成的,建议临床非必要时,可将穿刺活检放在消融前进行,可以有效减少气胸的发生。
本研究中患者治疗相关气胸发生的单因素分析结果表明,肿瘤最长径、肿瘤位置、穿刺次数及消融时间是治疗相关气胸发生的不利风险因素(P<0.05)。多因素分析结果表明,肿瘤位置、穿刺次数是治疗相关气胸发生的风险因素(P<0.05),由此可见肿瘤位置、穿刺次数是治疗相关气胸发生的独立风险因素。气胸的发生一般是脏层胸膜损伤后气体进入胸膜腔所致,穿刺本身及消融都可以损伤脏层胸膜[5],穿刺次数的增加,就会相应增加对病灶周围胸膜和肺实质内小气管的穿刺损伤,从而增加了局部胸膜的损伤程度,造成气胸的发生的风险加大。因此减少穿刺次数,避免电极针留在胸壁,可以有效地降低气胸的发生率。另外本研究结果表明,病变位置也是治疗相关气胸发生的风险因素,并且本文中下肺野病变RFA所造成的气胸发生率要高于中上肺野(中上肺部气胸发生率为4.55%,下肺部气胸发生率为18.84%),根据解剖位置和呼吸运动的关系,呼吸运动会造成脏层和壁层胸膜之间的相对滑动,而消融针则是相对固定的,由于其受胸壁肌肉的牵制,那么呼吸运动时相对的滑动会对脏层胸膜产生切割作用,进而造成胸膜的损伤,并且下肺野的呼吸运动幅度要远大于中上肺野,所以穿刺下肺野病变时产生气胸的概率会大于中上肺野者。因此对于下肺野病变患者消融时术前要交代患者进行呼吸训练,力求呼吸频率及幅度一致,不但可以提高穿刺的精确性,而且可以降低因呼吸运动带来的相对切割而造成胸膜的损伤,从而降低气胸的发生。
为了尽可能减少治疗相关的气胸发生,可以采取以下措施:① 由经验丰富的介入治疗科医师完成;② 尽量减少进针次数;③ 术前进行患者的呼吸训练,充分的沟通,能有效缓解患者术中的紧张情绪。
综上所述,CT引导下RFA治疗肺癌是一项安全、微创的方法,降低穿刺次数可有效减少治疗相关气胸的发生,对于下肺野的病变应格外注意。

