MRI放射组学特征预测胶质母细胞瘤患者预后
李京龙,王占秋,顾长聪,赵月梅,陈 涛,李文菲
1.秦皇岛市第一医院影像科,河北 秦皇岛 066000;
2.襄阳市中心医院核医学科,湖北 襄阳 441000
胶质母细胞瘤是一种高度恶性的脑肿瘤,特点是复发率及死亡率高,多学科治疗后的中位生存期仅为15个月[1]。目前胶质母细胞瘤的标准治疗方案是最大限度地安全切除肿瘤术后结合放化疗,可以有效延长患者的生存期[2]。研究[3]证实,替莫唑胺辅助放疗可以进一步改善术后患者的无进展生存期(progress-free survival,PFS)和总生存期(overall survival,OS)。然而,由于肿瘤异质性,并非所有胶质母细胞瘤患者都能从替莫唑胺辅助放疗中获益,因此识别可能受益于替莫唑胺辅助放疗的高风险亚组是改善胶质母细胞瘤患者预后的关键。
依赖于活检并不能够全面地反映肿瘤的异质性,甚至可能由于活检的操作不当导致大脑部分精细功能的丧失[4]。在影像学上,基于常规磁共振成像(magnetic resonance imaging,MRI)影像信号、强化方式反映肿瘤内部的显著异质不可避免地存在主观差异。多项研究[5-6]发现,放射组学特征可以客观、定量地提取纹理特征,反映肿瘤的异质性,进而鉴别胶质母细胞和转移瘤,预测胶质母细胞瘤的分子亚型及患者预后[7-9]。目前基于放射组学特征评估胶质母细胞瘤患者预后的研究较少,本研究旨在通过构建影像组学评分模型预测胶质母细胞瘤患者预后,确认高风险患者能否从替莫唑胺辅助放疗中获益。
1 资料和方法
1.1 临床资料
从癌症影像档案(The Cancer Imaging Archive,TCIA)数据库下载获得166例胶质母细胞瘤患者多参数MRI数据。纳入标准:① 根据2016年世界卫生组织(World Health Organization,WHO)中枢神经系统肿瘤分类,组织病理学诊断为胶质母细胞瘤的患者;② 术前MRI检查包括增强T1加权成像(T1-weighted imaging,T1WI)。排除标准:① 没有治疗前MRI数据(n=12);② 缺少T1WI增强扫描序列(n=10);③ 存在MRI伪影(n=7);④ 缺少预后信息(n=7)。最终130例患者被纳入放射组学分析。患者临床资料通过癌症基因组图谱数据库(The Cancer Genome Atlas,TCGA)获取。本研究临床及影像数据均来自公共数据库,符合2013年修订的《赫尔辛基宣言》要求。
1.2 图像处理及分析
本研究使用软件3D Slicer 4.11.0和Pyradiomics包来提取放射组学特征。每个胶质母细胞瘤分为3个区域:肿瘤坏死区、肿瘤增强区及瘤周水肿区。T1WI增强图像用于描绘胶质母细胞瘤的坏死核心,通常位于肿瘤的中心区域。T2加权成像(T2-weighted imaging,T2WI)和T2加权液体抑制反转恢复(fluid attenuated inversion recovery,FLAIR)序列用于对照识别水肿和坏死核心。图像分割由高年资放射科医师(具有10年神经放射经验)绘制,所有感兴趣区均使用阈值分割、种子生长和手动半自动绘制。从胶质母细胞瘤患者全域(瘤周水肿区、肿瘤强化区及肿瘤坏死区)中分别提取了628个基于3D纹理的放射组学特征和14个基于形状的特征。
1.3 放射组学评分模型的构建
所有组学特征采用Z-score方法进行归一化处理。其次,进行单因素Cox回归分析获取与预后显著相关的特征(P<0.05)。接下来,将剩下的因素纳入最小绝对值收缩与选择算子(least absolute shrinkage and selection operator,LASSO)回归模型中,采用10折交叉验证方法对模型进行验证,最终选定特征的加权建立放射组学评分模型。根据X-tile软件定义合适的阈值将患者分为高风险组和低风险组。并使用相同的临界值评估胶质母细胞瘤的PFS及预后,对高风险组和低风险组患者进行亚组分析,观察替莫唑胺辅助放疗是否有助于延长高风险患者的OS。
1.4 统计学处理
采用R 4.0.2软件进行所有的统计学分析。为了验证开发的放射组学风险评分是否是胶质母细胞瘤患者的独立危险因素,多因素Cox回归分析利用以下临床变量作为协变量进行分析,例如年龄、性别、异柠檬酸脱氢酶1(isocitrate dehydrogenase,IDH1)基因突变状态、DNA修复酶O-6-甲基鸟嘌呤-DNA-甲基转移酶(O6-methylguanine-DNA-methyltransferase,MGMT)的甲基化状态及治疗方案。生存分析使用Kaplan-Meier法绘制生存曲线,P<0.05为差异有统计学意义。
2 结 果
2.1 患者临床特征
本研究纳入1 3 0例患者,平均年龄(59.3±14.2)岁,其中男性患者83例,女性47例。中位OS和PFS分别为12.2和6.4个月。单因素Cox回归筛选与预后显著相关的组学特征后,剩下87个显著特征,然后经过Cox-LASSO模型选择了16个特征用于构建放射组学评分模型。其中4个来自瘤周水肿区域,9个来自肿瘤的增强区域,其余3个来自胶质母细胞瘤的坏死核心区域(表1)。
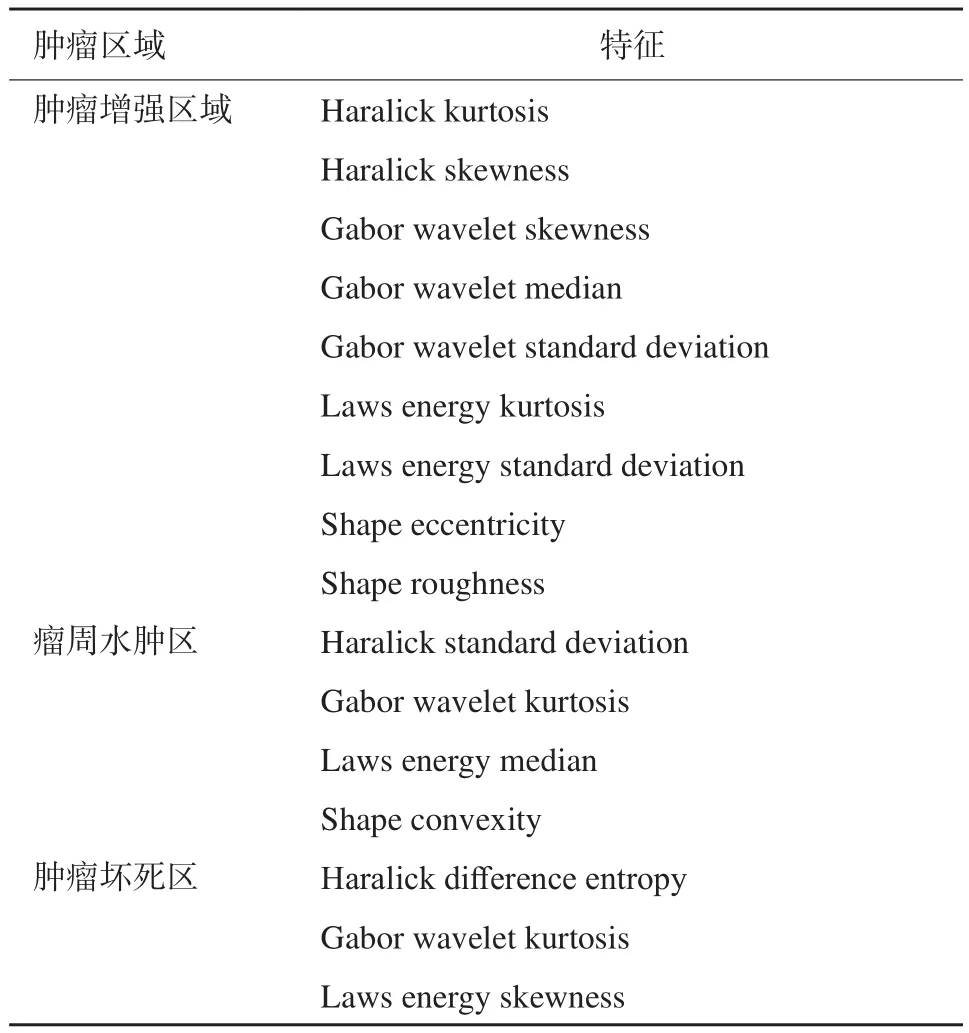
表1 胶质母细胞瘤患者预后相关的最佳特征
2.2 放射组学模型评估预后临床价值
放射组学评分根据最佳阈值(6.67)对胶质母细胞瘤患者进行分层。最终患者分为高风险组(n=61)和低风险组(n=69),患者基线特征见表2。Kaplan-Meier生存分析显示高风险组胶质母细胞瘤患者中位OS为10.4个月,低风险组患者中位OS为14.7个月,差异也有统计学意义(图1A,P=0.000 3),同时本研究发现PFS两组间差异也有统计学意义(图1B,P<0.000 1)。单因素Cox回归分析表明年龄、分子亚型、治疗方案及组学模型是影响胶质母细胞瘤患者的危险因素,多因素Cox回归模型表明年龄、治疗方式及组学模型是胶质母细胞瘤患者的独立危险因素(表3)。亚组分析显示,高风险组患者接受替莫唑胺辅助放疗预后较好(图2A,P=0.000 16),低分险组患者在接受不同治疗方案后OS差异无统计学意义(图2B,P=0.44)
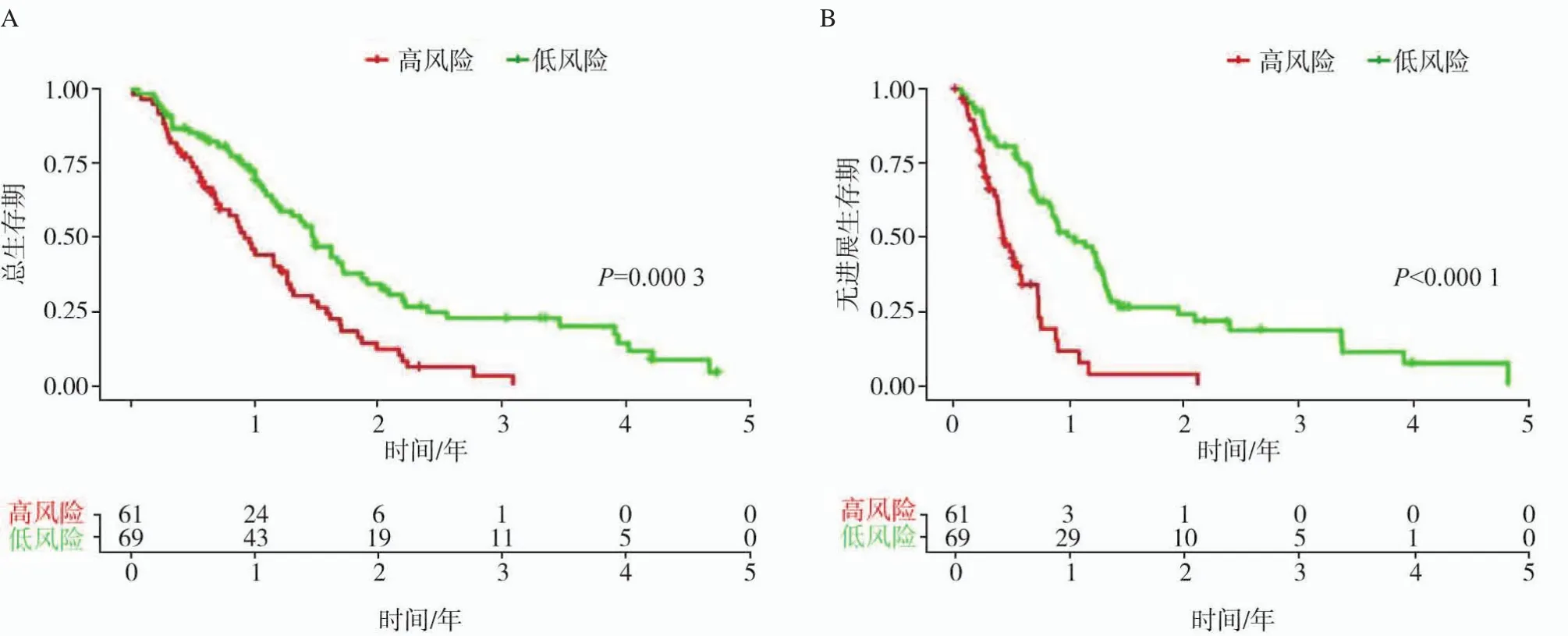
图1 胶质母细胞瘤生存曲线
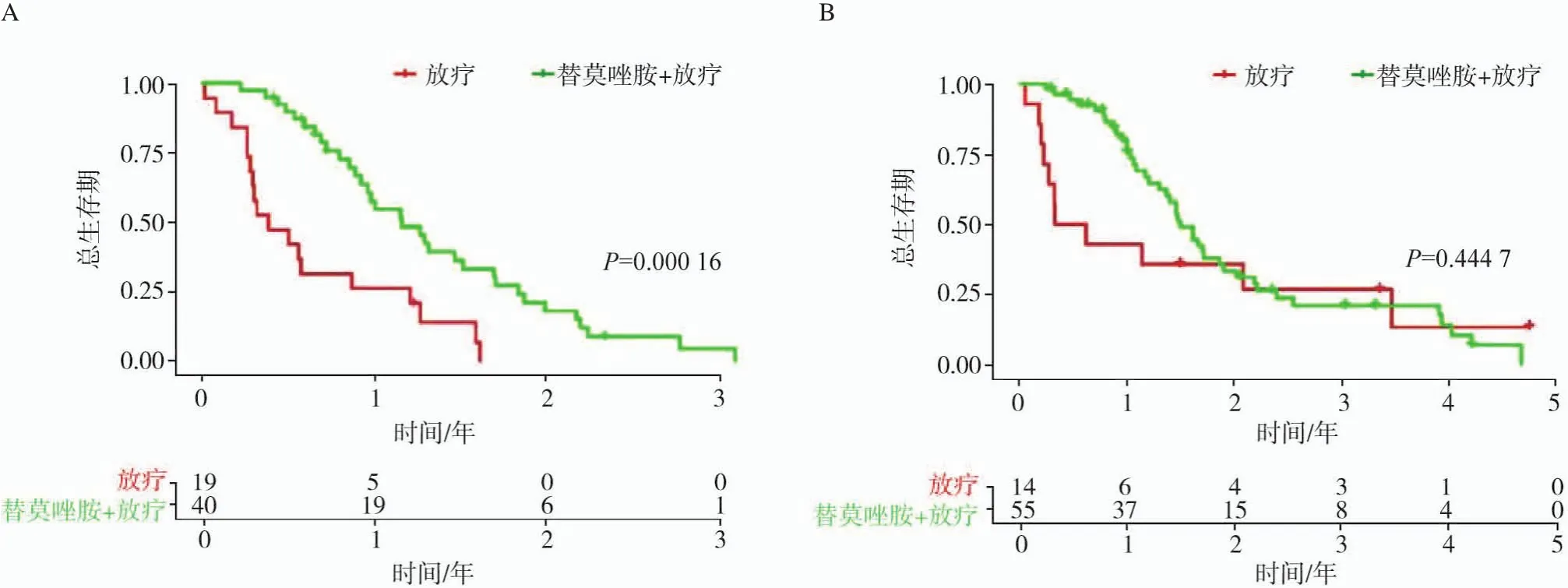
图2 不同治疗方案对胶质母细胞瘤OS影响
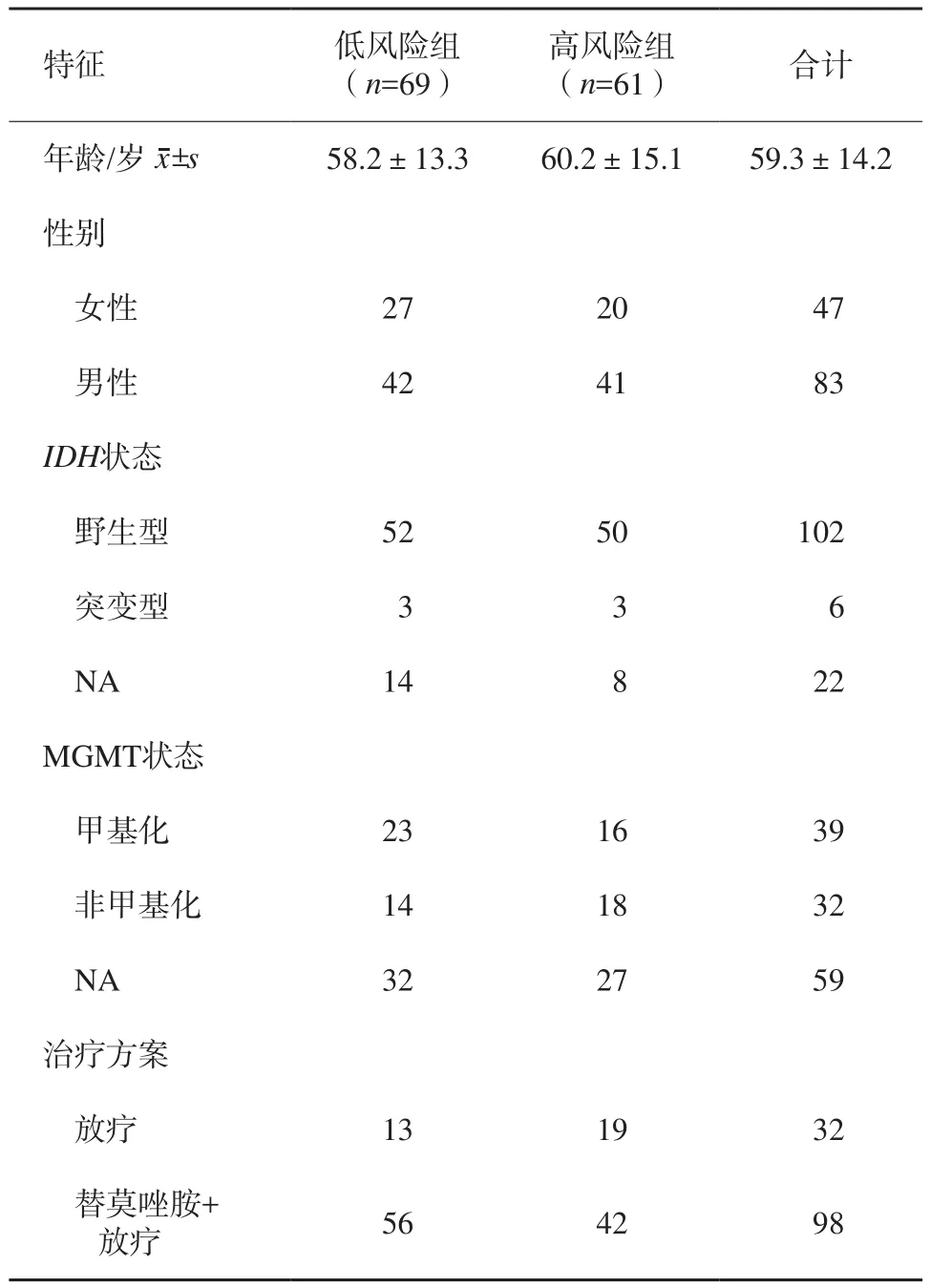
表2 高风险组和低风险组胶质母细胞瘤患者基线特征n
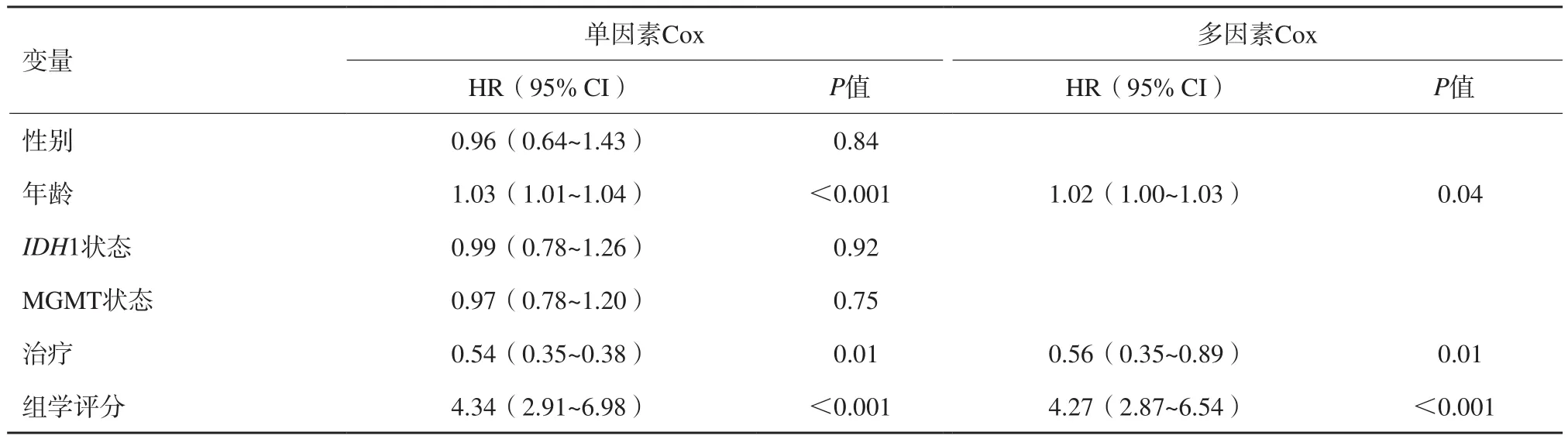
表3 单因素及多因素COX回归分析
3 讨 论
本研究基于常规MRI构建放射组学评分模型预测胶质母细胞瘤患者预后,研究表明,放射组学评分对于胶质母细胞瘤复发及预后的风险分层有重要意义;其次,在多因素Cox回归分析中,放射组学风险评分是胶质母细胞瘤患者预后的独立危险因素;最后,基于放射组学评分的高风险组患者可以从替莫唑胺辅助放化疗中获益,而低风险组患者不能获益,可能会增加潜在的不良反应。
影像组学是通过从医学影像数据中提取大量的定量特征来量化分析肿瘤潜在异质性的方法,具有无创性,并且可以避免活检的取样误差[10-11]。近年来国内外多项研究[9,12]基于影像组学对胶质母细胞瘤的分子亚型进行评估。目前国内利用肿瘤全域影像组学特征预测胶质瘤患者预后的研究较少。已经建立的胶质母细胞瘤患者的放射组学预测模型主要基于常规T1WI图像,并未对肿瘤全域进行组学特征提取[13-15]。本研究发现除了肿瘤增强区域,瘤周水肿区域及坏死区域获得的纹理特征也与胶质母细胞瘤患者预后显著相关,提示使用常规MRI全域组学特征可以有效反映肿瘤内异质性。这可能是因为坏死区与细胞凋亡过程有关,增强的特征与信号转导和蛋白质折叠过程有关,而水肿区域特征主要反映细胞周期的过程[16-17]。研究[18-19]表明,放射组学特征不仅可以预测胶质瘤基因突变,还可以预测胶质母细胞瘤的预后和进展。本研究发现放射组学特征不仅可以有效对预后进行分层,还可以对胶质母细胞瘤的复发风险进行分层。在Tan等[18]的研究中,多变量Cox回归分析确定放射组学特征、年龄和IDH是预测胶质瘤预后的独立危险因素。本研究表明,放射组学风险评分增加了胶质母细胞瘤患者的进展风险(HR=4.27),与既往研究[19]一致;然而IDH状态并不是独立危险因素,可能与本研究中IDH野生型比例较多有关。
在放射组学评估胶质瘤预后的研究中,Prasanna等[19]通过利用TCIA公共数据库提取放射组学特征可以有效预测胶质母细胞瘤患者预后。但上述研究并未表明高风险患者采取何种治疗方式可以获益。研究[20]表明,放疗可大大改善肿瘤的局部控制,但胶质瘤复发已成为放疗失败的主要方式。尽管研究[21-22]证实,替莫唑胺同步放疗可以使20%的复发性胶质母细胞瘤患者生存获益,但这意味着超过80%的患者不仅不能从该方案中获益,与此同时还需承担化疗带来的严重不良反应和经济负担。正因为如此,识别该方案的受益患者是非常重要的。本研究建立了基于MRI的放射组学作为预测同步放化疗的一个强有力的指标,即高风险患者可以从替莫唑胺辅助同步放疗方案中获益,而低风险患者则不能。
本研究的局限性主要表现在以下几个方面:首先本研究是回顾性的,样本量较小,未来需要多中心验证提高放射组学模型的泛化性。其次,本研究提取特征耗时较长,包括手动勾画感兴趣区,限制了其在临床实践中的应用,未来使用自动分割技术可望有效解决这个问题。第三,放射组学特征受到不同厂家设备的影响,这可能导致放射组学模型在多中心应用中失败,未来需要对影像组学数据标准化进行规范。
总之,本研究开发并验证了从MRI获得的放射组学模型可以有效对胶质母细胞瘤患者进行风险分层。高风险组患者放化疗OS明显优于单纯放疗,基于MRI的影像组学能为胶质母细胞瘤患者精准个性化治疗提供一定帮助。

