面向食品类专业的基础化学综合实验设计
王秀霞,王艳丽,王修中
(青岛农业大学化学与药学院,山东青岛 266109)
0 引言
实验教学对培养学生实践能力、创新能力、分析问题和解决问题能力至关重要,是高校培养创新型人才的重要环节[1]。基础化学实验是高等农、林院校有关专业重要必修基础课,其教学任务不仅仅是让学生获得有关化学实验的基本理论和基本操作技能,培养学生严肃、严密、严格的科学态度和良好的实验素养,更重要的是通过本课程的教学活动,培养其分析和解决实际问题的能力,为后续课程和将来从事的专业工作奠定坚实的基础[2]。我校的基础化学实验教学辐射范围广,面向全校生物类本科学生,如植物保护、农学、生物科学、动物科学、水产养殖、园艺、食品科学与工程和食品质量与安全等20 多个专业,但以往各专业开设实验内容千篇一律,缺少与各专业特点相适应的个性化实验,对后续专业课缺少足够强度的支撑,学生普遍觉得实验课枯燥乏味,因此,学习的积极性不高,普遍存在抄袭实验报告,应付任课老师等现象,不利于学生综合能力和创新能力的培养。随着我校食品科学与工程学院的食品科学与工程和食品质量与安全两个专业分别获批国家级和省级一流本科专业建设点,做强一流本科、建设一流专业、培养一流人才需要一流的本科课程作为基础和支撑已成共识。因此,针对不同的专业设置紧贴专业培养目标的实验项目,推进基础化学实验课程的教学改革,增强大学生分析和解决实际问题的能力,解决课程建设与学生需求的矛盾已迫在眉睫[3]。为此,将大学生科技创新项目成果应用于本科生实验课程的教学改革,以食品学院两个一流专业为试点,为他们量身定制了龙胆紫褪色法检测食品中亚硝酸盐的含量这一基础综合化学实验。开设两年来学生普遍对这种与生活和应用密切相关的实验表现出了极大的学习兴趣和热情,取得了良好的教学效果。
1 实验设计思路与安排
1.1 设计思路
亚硝酸盐是食品中普遍存在的一种无机含氮盐,其主要来源:①蔬菜的腌制过程中富集的硝酸盐经硝酸盐还原酶大批转化为亚硝酸盐;②人为添加到食品中作为食物的发色剂和防腐剂。亚硝酸盐具有很强的毒性和致癌性,食入0.3~0.5 g的亚硝酸盐即可引起中毒,3 g即可导致死亡。2017 年10 月27 日,世界卫生组织国际癌症研究机构将其列入2A 类致癌物清单中[4]。随着人们对食品安全和人体健康的关注程度越来越高,检测食品中的亚硝酸盐含量具有至关重要的意义。
本文利用龙胆紫褪色反应[5],研究了NO2-作为催化剂对碘酸钾氧化龙胆紫褪色反应的催化作用及其动力学条件,建立了催化动力学光度法测定痕量亚硝酸根的新方法。该方法具有较好的准确性和较高的灵敏度,操作方便、快速、分析成本低、便于推广等综合优点。在食品类专业中用该实验代替原有的邻二氮菲吸光光度法测铁实验,在掌握分光光度法的实验原理、标准曲线的绘制和仪器设备的操作技能基础上,还能解决与生活息息相关的重要复杂问题,从而激发学生的学习兴趣,培养学生的创新意识,让教与学同专业特色挂钩,有的放矢,为学生后续专业课的学习以及大四的毕业设计打下坚实的基础,也为学生将来从事专业相关的工作提供帮助。
1.2 实验教学安排
实验前,要求学生通过查阅文献了解食品中亚硝酸盐的来源、危害及其测定方法;通过观看书本或视频等回顾之前基础化学实验中学过的分析天平称量、配制溶液、样品前处理、抽滤等基本操作;通过查阅文献或观看视频了解紫外-可见分光光度计的测定原理和操作方法。实验过程中,要求学生能熟练配制各种溶液和操作仪器,准确记录各项实验数据,对可疑数据进行科学分析和取舍。实验结束后,学生根据测得的数据进行计算分析和讨论并撰写完整的实验报告[6-7]。实验学时以4~6 学时为宜,亚硝酸盐、龙胆紫和碘酸钾的储备液可以由实验员提前配制好备用,也可以由学生实验开始时配制,可根据教学计划等因素灵活安排[8]。
2 实验目的
2.1 实验目的
(1)了解食品中亚硝酸盐的来源、危害及其测定方法。
(2)巩固和加强基础化学实验中配制溶液、样品前处理等操作技能。
(3)掌握紫外-可见分光光度计的测定原理和操作方法。
(4)具备合理分析和解释实验数据的能力,并能综合信息得到合理有效的结论。
2.2 实验原理
测定亚硝酸盐的方法很多,催化动力学分光光度法是较为常用的一种,此法是在普通分光光度法的基础上发展起来的新型分光光度法。根据待测物质对某些化学反应的催化作用,通过测定与反应速率成正比例关系的吸光度变化,计算待测物质的浓度[9-10]。此法灵敏度高、操作简便、分析成本低。
龙胆紫,又称甲基紫、结晶紫,是一种碱性阳离子染料[11]。在磷酸介质中,亚硝酸根对碘酸钾氧化龙胆紫褪色反应具有较高的催化活性,在最大吸收波长535 nm处,亚硝酸根的浓度与体系吸光度呈良好线性关系,适用于食品中亚硝酸盐含量的测定。其原理如图1 所示,未加入亚硝酸盐时,龙胆紫分子本身醌式结构在535 nm处具有明显的吸收峰,加入催化剂之后,发现535 nm处光吸收强度明显减弱甚至消失,表明其分子的醌式结构已被氧化破坏[12]。该波长处吸光度的变化与加入的催化剂在一定浓度范围内具有定量关系,据此实现对亚硝酸根含量的测定。

图1 催化反应原理图
3 实验仪器、试剂及实验内容
3.1 实验仪器
紫外-可见分光光度计(UV-1601),超声波清洗器(E60H),酸度计(PB-10),真空泵(SHB-B88),台式离心机(TGL-16C),恒温水浴锅(XMTD-8222),电子分析天平(BSA12-4S)。
3.2 实验试剂
实验中所用试剂龙胆紫,盐酸,硫酸,磷酸,氢氧化钠,亚硝酸钠,碘酸钾,硫酸锌全部为分析纯,实验用水均为二次去离子水。
3.3 实验内容
(1)亚硝酸盐溶液。将分析纯亚硝酸钠置于110℃烘箱中烘干2 h,放入干燥器中冷却至室温,用分析天平准确称取0.5 g 于烧杯中,加少量二次去离子水使其溶解,然后转移到500 mL 容量瓶中,定容,摇匀,配置成约1.0 g/L 的储备液室温保存,使用时适当稀释。
(2)龙胆紫溶液。准确称取0.02 g 龙胆紫粉末于烧杯中,加适量二次去离子水,超声至完全溶解,然后转移到500 mL容量瓶中,定容,摇匀,配制成约0.1 mmol/L的储备液保存备用。
(3)碘酸钾溶液。准确称取0.21 g 的碘酸钾于烧杯中,加适量二次去离子水完全溶解后转移至100 mL容量瓶中,定容,摇匀,配制成约0.1 mol/L的储备液保存备用。
(4)实验方法。根据参考文献[13]的方法,稍加改进,取两支比色管,分别依次加入0.2 mol/L 磷酸0.8 mL、0.1 mol/L的碘酸钾0.5 mL,第1 支作为空白对照,第2 支加入一定量的亚硝酸盐标准溶液。然后分别向两个比色管中加入0.1 mmol/L 的龙胆紫溶液0.1 mL,二次去离子水定容,充分摇匀,60 ℃水浴中恒温加热5 min,冷却至室温,在波长535 nm 处用1 cm比色皿测定溶液的吸光度。
(5)样品溶液的处理和测定。将从当地超市中购买的普通火腿肠随机取样,准确称取10 g 左右,用研钵研磨成匀浆,然后完全转移至烧杯,加入0.25 mol/L氢氧化钠20 mL,转移至100 mL 容量瓶中,加入0.40 mol/L硫酸锌5 mL沉淀蛋白质,二次去离子水25 mL,混匀[14]。置于50 ℃水浴恒温15 min,定容至100 mL,放置1 h,真空抽滤,收集滤液。每次取适量作为分析液,用紫外-可见分光光度计测定其吸光度。
4 实验结果与讨论
4.1 测量波长的选择
用紫外-可见分光光度计在495~555 nm 波长范围内,分别扫描加入亚硝酸根前后体系的吸光度,分别记作A0和A,绘制ΔA(A-A0)—λ 曲线。如图2 所示,吸收曲线在535 nm处出现峰值,所以,测量波长选择535 nm。
4.2 酸性介质及其用量的选择
该实验只能在酸性介质中进行,分别选择0.2 mol/L的盐酸、硫酸和磷酸溶液作为反应介质。在磷酸介质中,龙胆紫的褪色效果最为明显。实验测试了0.2 mol/L的磷酸溶液用量在0.2~1.2 mL 内ΔA的变化情况。如图3 所示,当磷酸溶液用量超过0.8 mL时ΔA达到最大值且基本平稳,实验选择0.8 mL磷酸溶液用量。

图3 磷酸溶液用量对反应体系吸光度的影响
4.3 碘酸钾溶液用量的选择
实验测试了0.1 mol/L 碘酸钾溶液用量分别为0.1、0.3、0.5、0.7、0.9 mL 时反应体系ΔA的变化情况。实验结果如图4 所示,当碘酸钾溶液用量大于0.5 mL时ΔA达到最大值且不再增加,所以实验中碘酸钾溶液用量选择0.5 mL。
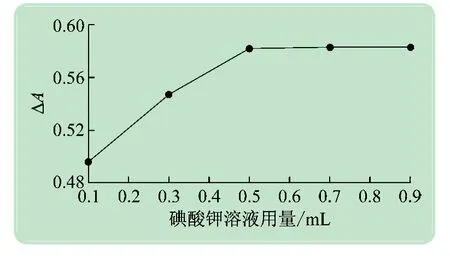
图4 碘酸钾溶液用量对反应体系吸光度的影响
4.4 反应温度的选择
实验测试了反应温度分别为20~100 ℃时反应体系ΔA的变化情况。实验结果如图5 所示,从图中可见温度达到60 ℃之后ΔA变化趋缓,当温度超过90℃以后颜色会急剧加深,不符合该反应规律,所以选取最佳反应温度为60 ℃。
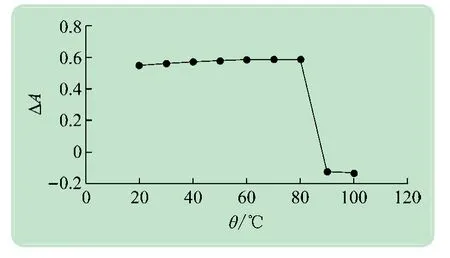
图5 温度对反应体系吸光度的影响
4.5 加热时间的选择
实验测试了加热时间分别为1~9 min 时反应体系ΔA的变化情况。实验结果如图6 所示,水浴加热时间超过5 min 之后龙胆紫溶液褪色变化基本不变,所以加热时间选取5 min。

图6 加热时间对反应体系吸光度的影响
4.6 龙胆紫用量的选择
实验测试了0.1 mmol/L 的龙胆紫溶液用量分别为0.1~0.8 mL 时反应体系ΔA的变化情况,实验结果如图7 所示。通过实验结果可见龙胆紫溶液用量为0.5 mL时,ΔA最大。因此0.1 mmol/L的龙胆紫溶液最佳用量为0.5 mL。
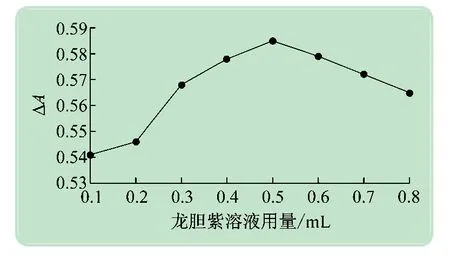
图7 龙胆紫溶液用量对反应体系吸光度的影响
4.7 标准曲线的绘制
加入不同体积的亚硝酸根标准溶液,对应亚硝酸根浓度分别为:5.0 ×10-5,1.0 ×10-4,5.0 ×10-4,1.0×10-3,2.0 ×10-3,3.0 ×10-3,4.0 ×10-3,5.0 ×10-3g/L。作标准曲线,如图8 所示,该方法在亚硝酸根浓度5.0 ×10-5~5.0 ×10-3g/L范围内呈良好的线性关系,线性方程为:ΔA=64.741c+0.108 9,R2=0.999 4。根据11 次空白实验测定值的标准偏差计算其检出限为3.5 μg/L。
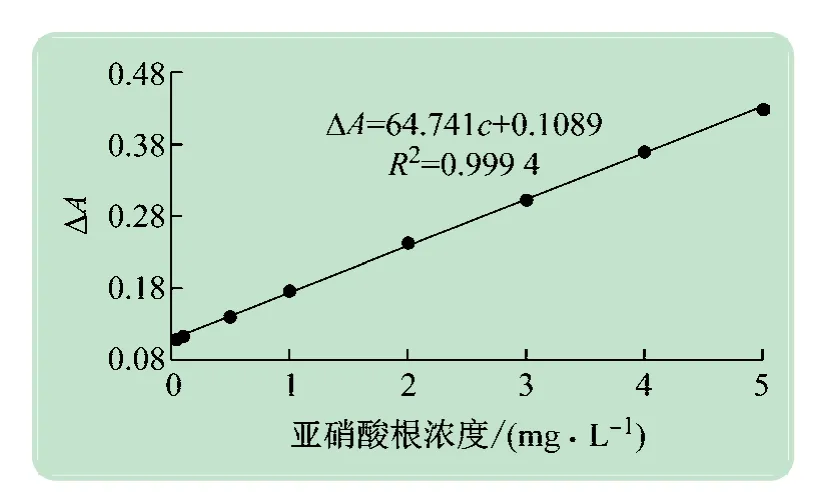
图8 亚硝酸盐浓度和吸光度变化的线性关系
4.8 样品测定结果
当地超市购买两种不同品牌火腿肠,准确称取适量,处理样品和制备待测液,测定体系的吸光度,分别平行测定3 次取平均值,实验结果平均值为0.186 和0.210,计算出两种火腿肠的亚硝酸根含量分别为12.00 mg/kg和13.56 mg/kg,均低于国家标准。所作回收率实验的回收率分别为101.7%和102.6%,方法可靠,结果如表1 所示。

表1 样品中亚硝酸盐含量的分析结果
5 结语
本文探讨了我校将大学生的科技创新成果应用于本科生基础化学实验课程的教学改革实践。本实验以分析化学课程中的分光光度法为理论基础,以紫外-可见分光光度计作为操作仪器来测定食品中亚硝酸盐含量,尤其适合食品类专业二年级本科生基础化学实验的教学。
本实验的教学已经在2019 和2020 学年食品科学与工程和食品质量与安全两个专业的二年级第一学期试开展,通过对多名学生的调研得知,学生认为本实验是基础化学实验项目中最贴合我校食品学院的专业特点和学科特色,侧重实际应用的实验,也是最能提高学生实验兴趣,引导学生运用所学知识解决实际问题的实验,学生希望可以多设置一些此类实验。
本实验的开展也为基础化学实验结合其他专业的特点进行个性化实验设置具有参考和借鉴意义[15-16]。比如在农学专业开展土壤的相关测定实验,在资源与环境专业开展水质的相关测定实验,在动物科学专业开展与动物健康密切相关的几种化学成分的测定(如血液中钙的含量)、动物饲料营养成分的测定等。根据不同的专业设置不同的实验内容,改变过去各专业授课内容完全一致的局面,使课程内容更加满足各专业不同的需求,必将会收到积极的效果。

