阿达木单抗治疗坏疽性脓皮病一例并文献复习
臧 箫 李洪达 刘永霞 卢宪梅 杨 青 王伟伟 吴卫志
山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,山东济南,250022
坏疽性脓皮病(pyoderma gangrenosum,PG)是一种少见的非感染性炎症性皮肤病,以皮肤出现疼痛性坏死性溃疡为特征,皮损较顽固,易反复发作,给患者带来极大痛苦。本病有四种主要的临床类型,溃疡型最为常见,治疗主要包括糖皮质激素、免疫抑制剂、抗TNF-α拮抗剂等。现有文献显示依那西普、英夫利昔单抗等TNF-α拮抗剂治疗PG有良好疗效,但是应用阿达木单抗治疗PG的病例较少。本文报道阿达木单抗治疗坏疽性脓皮病一例并文献复习。
1 临床资料
患者,男,53岁。因“左股内侧红斑、丘疹6个月,溃疡3个月”就诊于我院。患者6个月前左股内侧出现散在分布的红斑、丘疹,无明显瘙痒、疼痛等自觉症状,外用多种药物(具体不详)治疗效果欠佳。3个月前皮损增大,局部出现溃疡,伴轻微疼痛。有高血压病史10余年,最高130~140/100~109 mmHg,现口服“厄贝沙坦”;糖尿病史1年,空腹血糖约8 mmol/L,现口服“二甲双胍”,自述血糖控制尚可;双侧股骨头坏死6年;9个月前因“冠心病、急性心肌梗死”植入冠脉支架1枚。既往史、个人史无特殊,家族中无类似病史。体格检查:神志清楚,表情正常,心肺听诊无异常。皮肤科查体:左侧股内侧见散在分布大小不一的数处圆形、椭圆形溃疡,周围绕以红晕,边界较清楚,表面少量脓性分泌物,上覆厚层黑褐色结痂(图1)。实验室检查:血常规、血沉、肝肾功、电解质、免疫球蛋白+补体、CRP、ANA+dsDNA、肿瘤标志物、淋巴亚群、免疫细胞因子均无明显异常。葡萄糖6.6 mmol/L,糖化血红蛋白6.5%。甲肝、乙肝、丙肝、HIV、梅毒螺旋体等抗体、TB-IGRA均为阴性。胸部X线无明显异常。细菌培养示:摩根摩根菌阳性。组织病理示:(左侧股内侧)切片一侧溃疡形成深达脂肪层,溃疡下方血管周围淋巴细胞、中性粒细胞、浆细胞、组织细胞浸润。Masson染色:未见胶原纤维穿通现象。PAS染色:未见真菌菌丝、孢子。符合坏疽性脓皮病(图2)。根据病史、临床表现及病理检查结果诊断为坏疽性脓皮病。入院第一天开始给予雷公藤多苷片20 mg日2次、沙利度胺片50 mg日2次,3天后仍有散在新发红斑、丘疹,入院第3天、第10天分别加用皮下注射阿达木单抗80 mg、40 mg,溃疡深度逐渐变浅,基底部出现较多新生肉芽组织,第17天皮损好转出院(图3)。出院7天停用雷公藤多苷片、沙利度胺片,每2周皮下注射阿达木单抗40 mg。第4次注射阿达木单抗时(出院后21天)溃疡愈合,皮损完全消退(图4),继续每14~28天皮下注射阿达木单抗40 mg维持治疗。半年后随访,皮损未复发。
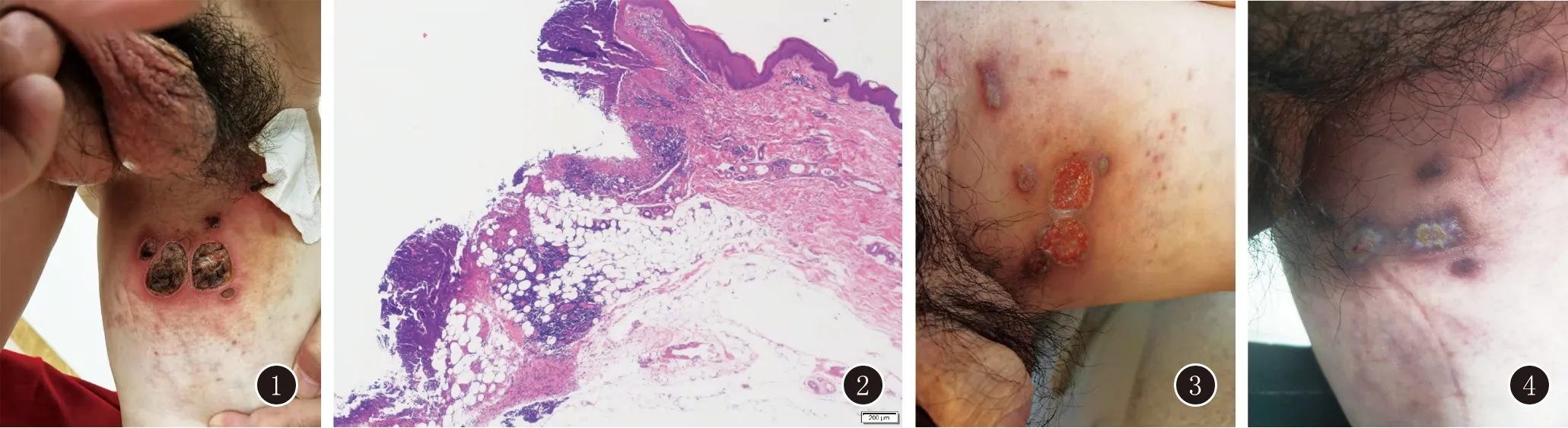
图1 左侧股内侧见数处圆形、椭圆形溃疡,周围绕以红晕,边界较清楚,表面少量脓性分泌物,上覆厚层黑褐色结痂 图2 切片一侧溃疡形成深达脂肪层,溃疡下方血管周围淋巴细胞、中性粒细胞、浆细胞、组织细胞浸润(HE,×40) 图3 左侧股内侧溃疡深度变浅,基底部见较多新生肉芽组织,表面清洁,无脓液 图4 左侧股内侧溃疡基本愈合,表面可见结痂,部分愈合后留有色素沉着斑片
2 讨论
坏疽性脓皮病最早由法国皮肤科医生Louis-Anne-Jean Brocq 描述,然而,其现代名称是由Louis A. Brunsting、William H. Goeckerman和Paul A. O’Leary在1930年的一项临床研究中创造的[1]。PG可发生于不同年龄,以40~60岁多见,少见于儿童。其患病率报道不一,美国一项研究从包含超过3100万成年患者的数据库中确定了1971例PG个体,报道PG的患病率为每百万成年人58例[2]。英国一项研究报道PG的发病率为每百万人年6例[3]。
PG常与一些系统性疾病相关,包括慢性炎症性肠病、类风湿关节炎、血清阴性关节炎、自身免疫性肝病等,还和急性粒细胞白血病、单克隆丙种球蛋白病等血液系统疾病相关。其发病机制尚不清楚,目前认为和遗传、中性粒细胞功能障碍、免疫功能失调等因素有关。PG被认为是一种嗜中性皮肤病,患者中性粒细胞的趋化性、吞噬作用、迁移作用及杀菌能力存在缺陷[4]。近年来也有研究认为淋巴细胞及炎症介质与PG的发生相关。PG溃疡潜行性边缘处扩增的寡克隆T细胞可以与同一患者血清扩增的寡克隆T细胞相匹配,表明T淋巴细胞有潜在的致病作用[5]。与正常皮肤相比,PG创面的IL-8、IL-17、TNF-α、趋化因子-1、2、3和16、基质金属蛋白酶(MMP)2和9、IL-1β及其受体均高表达,提示PG的发生也与炎症因子相关[6]。最新研究发现,一些药物如抗甲状腺药物(丙硫氧嘧啶)、异维A酸、生物制剂、酪氨酸激酶抑制剂、集落刺激因子等也可诱发PG,这类PG被称为药物相关性PG[7]。
PG治疗的目的在于减轻炎症反应,促进溃疡愈合,减少皮损复发。目前文献中PG的治疗方案多种多样,但尚无明确的治疗指南或共识。一般治疗包括控制潜在疾病、避免外伤、减轻疼痛、溃疡面护理、预防感染等。常见的局部治疗包括外用糖皮质激素、他克莫司软膏,皮损内注射糖皮质激素。此外,也有报道外用色甘酸钠、尼古丁、氨苯砜和5-氨基水杨酸取得良好疗效[8]。系统应用糖皮质激素被认为是进行性、损容性严重PG的一线治疗药物,起效通常较迅速,但应避免长期应用,且需定期监测相关副作用。环孢素(2.5~5 mg/kg·d)经常用于二线治疗且也有良好疗效,但其使用也受到副作用的限制。其他免疫抑制剂如环磷酰胺、甲氨蝶呤、霉酚酸酯、柳氮磺吡啶和硫唑嘌呤等也被报道用于PG且取得一定疗效[6]。此外,也有报道应用沙利度胺、氨苯砜、秋水仙碱、苯丁酸氮芥等药物治疗PG[6]。
虽然上述PG的治疗多样,但仍有部分患者无法取得满意疗效。近年来研究发现生物制剂可用于治疗难治性PG且具有良好安全性及耐受性,目前可用的有抗TNF-α拮抗剂、IL-1、IL-17、IL-12/23或IL-23拮抗剂等[9],为PG患者带来新的治疗思路,但这些治疗方案多为个案报道或小样本研究,只有英夫利西单抗进行了随机、双盲、安慰剂对照试验,但仅纳入30例患者[10],仍缺乏大规模的临床对照试验验证其疗效与安全性。
本文患者应用阿达木单抗后取得十分良好的疗效。目前国内尚无应用阿达木单抗治疗PG的报道,国外文献多为病例报道。Campanati等[11]报道了一例51岁的女性PG患者,同时合并Crohn病,系统应用糖皮质激素和硫唑嘌呤有效,但减药后皮损迅速复发,后给予阿达木单抗皮下注射(第0周、第1周分别160 mg、80 mg,此后每2周40 mg),第2次注射时PG及胃肠道症状均快速改善,12周时PG皮损完全愈合。Hinterberger等[12]报道一例42岁的顽固PG患者,既往应用糖皮质激素、硫唑嘌呤、环磷酰胺及吗替麦考酚酯等治疗效果均欠佳,后停用上述所有药物,应用阿达木单抗皮下注射治疗(第0周、第1周分别80 mg、40 mg,此后每2周40 mg),64周内皮损逐渐愈合,后仍维持治疗,但治疗间隔已拉长至4周。日本一项为期26周的3期临床试验评估了阿达木单抗治疗PG的疗效及安全性[13],共纳入22例患者,第0周皮下注射阿达木单抗160 mg,第2周80 mg,第4周开始每周40 mg。至第26周时,有54.5%(12例)的PG患者皮损完全消退。18例患者报告了不良事件,其中最常见的是感染(n=11),还有1例患者PG出现恶化。但是,此研究样本数小,缺乏双盲对照,且部分患者同时接受了糖皮质激素治疗,可能使试验结果发生偏倚。Ben等[14]回顾了1998-2018年TNF-α拮抗剂治疗PG的病例,其中,应用英夫利西单抗、阿达木单抗、依那西普治疗的分别有275例、43例、36例,缓解率和完全缓解率均为:阿达木单抗>英夫利昔单抗>依那西普,但差异无统计学意义,且由于病情严重程度、病人数量及给药方案等组间差异,无法指导TNF-α拮抗剂的选择。
本例患者合并高血压、糖尿病、双侧股骨头坏死等多种疾病,无法耐受糖皮质激素、免疫抑制剂等治疗,给予阿达木单抗治疗后获得良好疗效。然而,也有研究发现,应用阿达木单抗治疗化脓性汗腺炎[15]、血清阳性类风湿关节炎[16]的过程中可能诱导PG的发生,这一发现与上述结论相反,又被称为“自相矛盾反应”。因此,阿达木单抗治疗可作为治疗PG的新思路,但其应用仍需要更多双盲对照临床试验来验证其疗效及安全性。

