巴戟天调控LncRNA LIFR-AS1对乳腺癌细胞T-47D增殖、凋亡及迁移的影响
兴伟 刘远 徐志峰 任伊宁
(河北省中医院普外科,河北 石家庄 050000)
乳腺癌是临床常见的恶性肿瘤之一,我国乳腺癌发病率高达12.2%,早期乳腺癌治愈率高达86%以上,但尚缺乏早期诊断乳腺癌的有效标志物,放化疗等综合方法治疗可提高患者治疗效果但患者预后很差,目前乳腺癌发病机制尚未阐明,既往研究显示金丝桃苷、芹菜素等药物具有抗乳腺癌的作用,但关于其具体作用机制尚未阐明〔1~4〕。巴戟天属于茜草科多年生藤植物,具有补肾阳、祛风湿的功效,已有研究证明巴戟天具有抗肿瘤、抗氧化等药理作用〔5〕。但巴戟天对乳腺癌的治疗效果及其可能作用机制尚未阐明。长链非编码(Lnc)RNA白血病抑制因子受体反义RNA-1(LIFR-AS1)在乳腺癌中呈低表达并可调控细胞增殖及迁移〔6〕。但LIFR-AS1能否作为巴戟天抗乳腺癌的治疗靶点尚未可知。本研究探讨巴戟天是否通过调控LIFR-AS1而影响乳腺癌细胞T-47D增殖、凋亡及迁移。
1 材料与方法
1.1材料与试剂 巴戟天(20190203)购自亳州百川药业有限公司;乳腺癌细胞T-47D购自广州赛库生物技术有限公司;Lipofectamine2000(20190412)、凋亡检测试剂盒(20181223)购自北京索莱宝科技有限公司;Trizol试剂(20181203)购自北京全式金生物技术有限公司;反转录(20181103)与荧光定量聚合酶链反应(PCR)检测试剂(20181116)购自北京天根生化科技有限公司;si-NC、si-LIFR-AS1购自上海吉玛制药技术有限公司;兔抗人B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自武汉博士德生物工程有限公司。StepOnePlus实时荧光定量PCR仪购自美国ABI公司;FACS Calibur流式细胞仪购自美国贝克曼库尔特公司。
1.2实验分组 巴戟天水提取物〔7〕:称取100 g巴戟天药物,加水浸泡30 min后进行煎煮60 min,过滤水煎液后再次进行煎煮45 min,收集2次滤液并进行减压浓缩至体积160 ml,冷却后放入冰箱内孵育24 h,3 000 r/min转速离心后取上清,药物浓度为2 g/ml,加入培养液稀释至所需浓度100、200、400 μg/ml。T-47D细胞培养于含不同浓度(100、200、400 μg/ml)巴戟天水提取物的培养液内培养24 h,分别为巴戟天低、中、高剂量组。同时将正常培养的细胞作为对照组。将si-NC、si-LIFR-AS1分别转染至T-47D细胞后加入含400 μg/ml巴戟天的培养液培养24 h,分别为巴戟天高剂量+si-NC组、巴戟天高剂量+si-LIFR-AS1组。
1.3采用实时荧光定量(qRT)-PCR检测LIFR-AS1表达水平 采用Trizol法提取各组T-47D细胞总RNA后反转录合成cDNA,加入去RNA酶(DEPC)水稀释20倍后放入-20℃冰箱内保存。qRT-PCR体系与反应程序均按照荧光定量检测试剂盒说明书操作,并检测细胞中LIFR-AS1(内参GAPDH)相对表达量。
1.4平板克隆形成实验 各组T-47D细胞接种于6孔板(1×103个/孔)后放入培养箱内继续培养14 d,使用预冷磷酸盐缓冲液(PBS)洗涤后加入甲醇(500 μl),将其放入-20℃冰箱内固定20 min,弃甲醇后加入1%结晶紫染色液(400 μl),室温孵育15 min后使用蒸馏水洗涤,晾干后观察克隆形成数。
1.5细胞周期检测实验 各组T-47D细胞(1×105个/ml)接种于96孔板(100 μl/孔),3 000 r/min转速离心5 min后弃上清,加入预冷PBS重悬细胞(500 μl),将预冷乙醇(70%)加入细胞悬液后弃上清,加入RNaseA(50 μl),37℃水浴30 min后加入碘化丙啶(PI)染色液(450 μl),将其放入4℃冰箱内孵育30 min后应用FACS Calibur流式细胞仪及Flowjoe软件分析各组细胞周期所占比例。
1.6流式细胞术检测细胞凋亡率 T-47D细胞中加入预冷PBS洗涤后弃上清,向细胞沉淀中加入500 μl结合缓冲液重悬细胞,按照凋亡检测试剂盒操作并检测细胞凋亡率。
1.7划痕实验 T-47D细胞接种于6孔板(1×103个/孔),各组处理完成后在培养板底部的水平方向画线作为参照,培养48 h后再次画线并观察两个时间点划痕宽度,计算划痕愈合率〔(划痕宽度0 h-划痕宽度48 h)/划痕宽度0 h×100%〕。
1.8Western印迹检测Bax、Bcl-2蛋白表达 提取T-47D细胞总蛋白后检测蛋白浓度并取适量蛋白样品进行十二烷基硫酸钠-聚丙烯酰凝胶电泳(SDS-PAGE)反应,转膜、封闭后加入一抗稀释液(1∶1 000)与二抗稀释液(1∶5 000),应用自动凝胶成像系统分析各蛋白条带灰度值。
1.9统计学处理 采用SPSS21.0软件进行t检验、单因素方差分析。
2 结 果
2.1巴戟天对T-47D增殖及LIFR-AS1表达的影响 与对照组比较,巴戟天中、高剂量组LIFR-AS1表达水平明显升高,克隆形成数明显减少,G0-G1期细胞比例明显升高,S期细胞比例明显降低,且巴戟天中、高剂量组各指标比较差异均具有统计学意义(均P<0.05),而各组间G2-M期细胞比例比较差异无统计学意义(P>0.05),见表1。
2.2巴戟天对T-47D凋亡的影响 与对照组比较,巴戟天中、高剂量组凋亡率、Bax蛋白水平明显升高,Bcl-2蛋白水平明显降低,且巴戟天中、高剂量组各指标比较差异均具有统计学意义(均P<0.05),见表1、图1、图2。
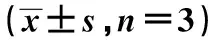
表1 巴戟天对T-47D细胞周期克隆形成、LIFR-AS1表达及细胞凋亡的影响

图1 巴戟天对各组T-47D凋亡的影响
1~4:对照组,巴戟天低剂量组,巴戟天中剂量组,巴戟天高剂量组图2 巴戟天对T-47D凋亡蛋白表达的影响
2.3巴戟天对T-47D迁移的影响 与对照组〔(67.16±1.39)%〕比较,巴戟天中剂量组〔(43.56±1.00)%〕、巴戟天高剂量组划痕愈合率〔(23.87±0.72)%〕明显降低,且巴戟天高剂量组明显低于巴戟天中剂量组(P<0.05)。
2.4干扰LIFR-AS1对巴戟天处理的T-47D增殖的影响 与巴戟天高剂量+si-NC组比较,巴戟天高剂量+si-LIFR-AS1组克隆形成数明显增多,G0-G1期细胞比例明显降低,S期细胞比例升高(P<0.05),两组G2-M期细胞比例比较差异无统计学意义(P>0.05),见表2。
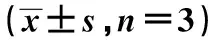
表2 干扰LIFR-AS1对巴戟天处理的T-47D细胞周期、克隆形成、细胞凋亡及迁移的影响
2.5干扰LIFR-AS1对巴戟天处理的T-47D凋亡的影响 与巴戟天高剂量+si-NC组比较,巴戟天高剂量+si-LIFR-AS1组凋亡率明显降低,Bax蛋白水平明显降低,Bcl-2蛋白水平明显升高(P<0.05),见表2、图3、图4。

图3 干扰LIFR-AS1对巴戟天处理的T-47D凋亡的影响
1~2,巴戟天高剂量+si-NC组,巴戟天高剂量+si-LIFR-AS1组图4 干扰LIFR-AS1对巴戟天处理的T-47D凋亡蛋白表达的影响
2.6干扰LIFR-AS1对巴戟天处理的T-47D迁移及LIFR-AS1表达的影响 与巴戟天高剂量+si-NC组比较,巴戟天高剂量+si-LIFR-AS1组划痕愈合率明显升高,LIFR-AS1表达明显降低(P<0.05),见表2。
3 讨 论
中草药具有抗感染、抗肿瘤等作用,其本身具有温和性且可有效缓解患者部分病症,但乳腺癌发病机制较为复杂,中草药抗乳腺癌的分子机制尚未阐明〔8~10〕。巴戟天具有提高免疫力、抗氧化的作用还可有效治疗骨质疏松,但其具体作用机制尚未可知〔11,12〕。本研究结果提示,巴戟天可通过诱导细胞周期阻滞而减弱乳腺癌细胞增殖能力,巴戟天可促进乳腺癌细胞凋亡,抑制乳腺癌细胞迁移。
LIFR-AS1表达下调与胃癌的不良生存相关〔13〕。LIFR-AS1通过miR-942-5p/锌指蛋白(ZNF)471轴抑制非小细胞肺癌的侵袭和转移〔14〕。本研究结果提示,干扰LIFR-AS1表达可明显逆转巴戟天对乳腺癌细胞增殖、凋亡、迁移的作用。
综上,巴戟天可诱导细胞周期阻滞而减弱乳腺癌细胞增殖能力及促进细胞凋亡,还可抑制细胞迁移,其作用机制与上调LIFR-AS1的表达有关。

