S100融合型蛋白及相关皮肤疾病
宋昊,王淳正,吴悠,郭颖
S100融合型蛋白(S100 fused-type proteins,SFTPs)是一组含钙离子结合域和重复序列的蛋白质[1],共包括7种蛋白:毛透明蛋白(trichohyalin,TCHH)、毛透明蛋白样蛋白1(trichohyalin-like 1,TCHHL1)、丝聚蛋白(filaggrin,FLG)、丝聚蛋白2(filaggrin2,FLG2)、Hornerin(HRNR)、Repetin(RPTN)和Cornulin(CRNN)[2]。SFTPs在表皮分化过程起重要作用,包括参与皮肤表皮的角蛋白中间丝(keratin intermediate filaments,KIFs)聚合、角质化包膜(cornified envelopes,CEs)形成、角质形成细胞和角化细胞骨架加固以及维持皮肤微环境稳态,SFTPs的功能缺损导致表皮屏障受损的皮肤病,如寻常性鱼鳞病、特应性皮炎、银屑病等[2]。
1 SFTPs结构及其编码基因
编码SFTPs的7个基因位于人染色体1q21表皮分化复合物(epidermal differentiation complex,EDC),呈簇状分布,依次为TCHHL1、TCHH、RPTN、HRNR、FLG、FLG2和CRNN(图1)[1-2]。SFTPs基因结构相似,均由3个外显子组成,其中 Exon1为50~73 bp非编码序列;Exon2长度为151~169 bp,起始密码子位于Exon2中部,其后为编码钙离子结合域序列;Exon3编码串联重复序列,不同基因长度差异较大。
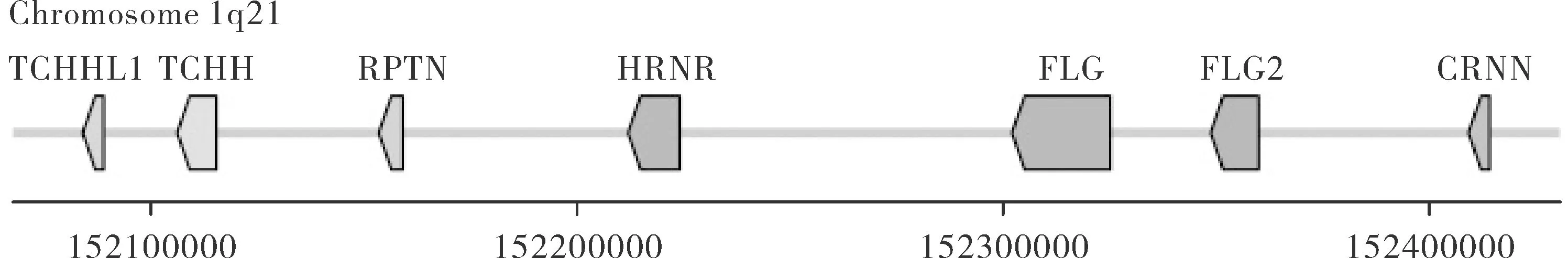
Note:TCHHL1 indicated Trichohyalin-like 1; TCHH indicated Trichohyalin; RPTN indicated Repetin; HRNR indicated Hornerin; FLG indicated Filaggrin; FLG2 indicated Filaggrin2; CRNN indicated Cornulin.图1 SFTPs基因分布示意图Fig.1 Schematic map of human SFTPs genes locus
7个SFTPs基因编码的蛋白分别为TCHHL1、TCHH、RPTN、HRNR、FLG、FLG2和CRNN,由500~4 500个氨基酸组成,分子量50~400 kDa。虽然各SFTPs蛋白大小差异较大,但它们N端都有2个高度同源的钙离子结合域,且结构相似,呈Helix E-loop-Helix F(EF hand domain)构象,钙离子结合位点位于环内(图2)。SFTPs重复序列长度和重复个数汇总于表1。
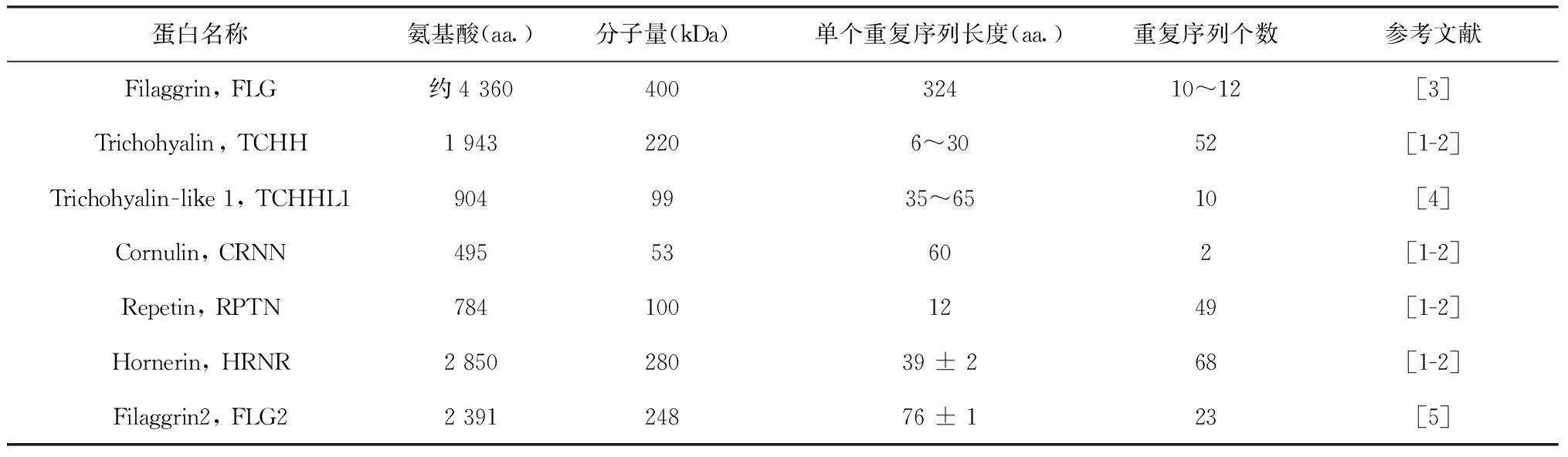
表1 SFTPs蛋白Tab.1 The members of SFTPs
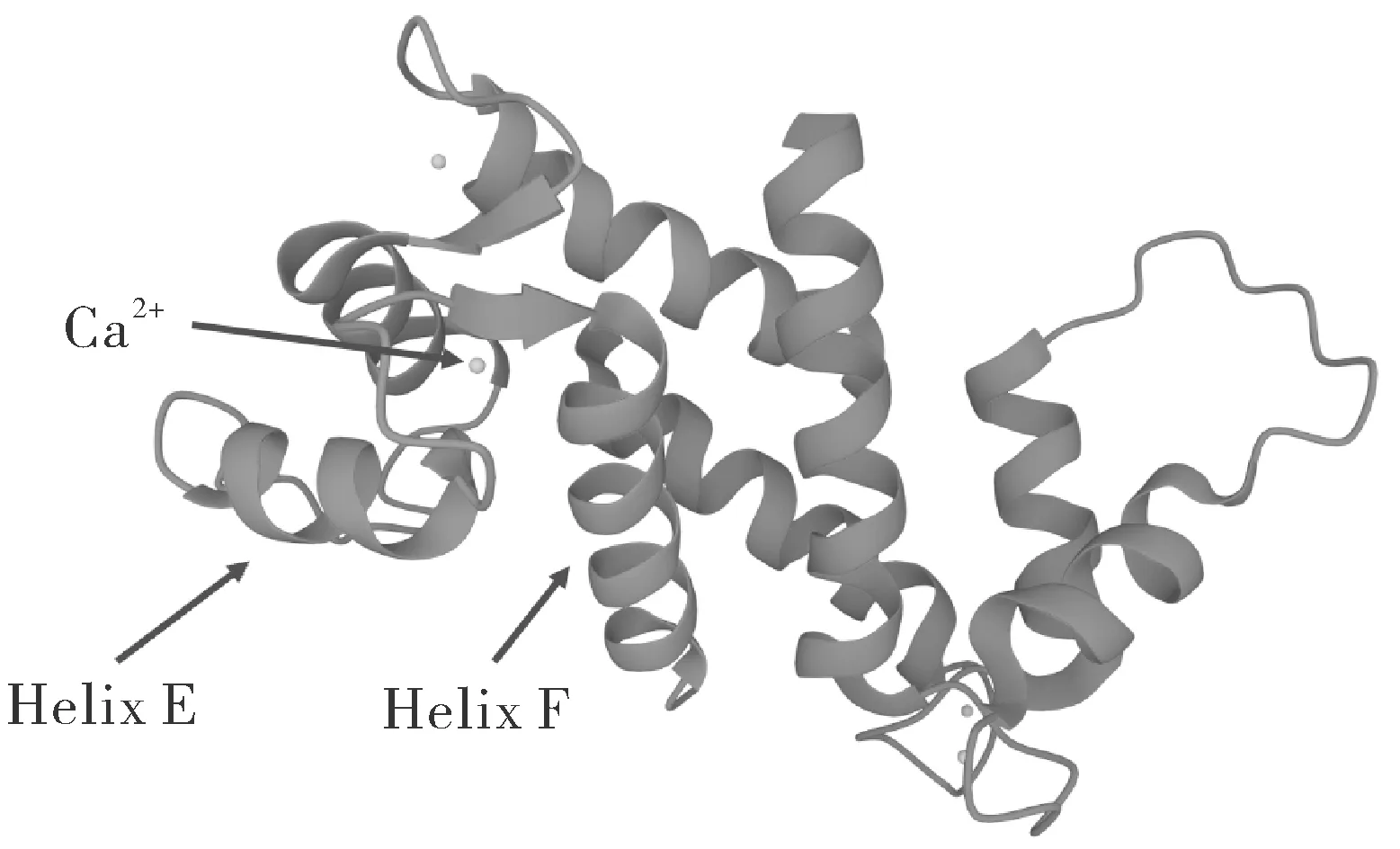
图2 FLG Helix E-loop-Helix F结构及钙结合位点(PDB ID:4PCW)Fig.2 Helix E-loop-Helix F structure and Calcium-binding site of FLG(PDB ID:4PCW)
2 SFTPs生理功能
2.1FLG FLG存在于表皮颗粒层和角质层,参与表皮分化,维持表皮紧密度和强度,参与天然保湿因子(natural moisturizing factors,NMFs)生成[3]。FLG单体通过电荷-电荷作用与角质形成细胞KIFs嵌合,促使KIFs呈束状聚合,使细胞成扁平样,促进角质层均一角蛋白基质形成[6]。同时,少量FLG单体参与CEs的形成,促进和维持CEs抗机械应力强度[6]。FLG还是肽基精氨酸脱亚氨酶(peptidyl arginine deiminases,PADs)的底物,经PADs水解,FLG从KIFs脱离,再由多种蛋白酶催化生成反式尿刊酸、吡咯烷酮-5-羧酸和游离组氨酸等NMFs[3]。NMFs存在于角化细胞间隙或附着于角质层表面,维持角质层水合及酸性微环境,降低微生物吸附,维持表皮屏障功能[3]。
FLG的N端有核定位信号序列(nuclear localization signal,NLS),该序列介导FLG N端向细胞核迁移,参与表皮分化后期细胞去核化,有报道[7]显示膜联蛋白Ⅱ也参与了该过程。FLG的C端参与酶对FLG前体蛋白的切割,当C端突变或缺失导致FLG单体生成下降[3]。
2.2TCHH和TCHHL1 TCHH是高疏水性蛋白,主要在表皮颗粒层以及毛囊内根鞘组织表达,参与CEs形成并维持表皮紧密度[1-2]。当TCHH被PADs水解,其产物水溶性增强,继而被转谷氨酰胺酶(transglutaminases,TGs)催化发生交联反应,与KIFs嵌合,在内根鞘及CEs中形成高度交联的刚性结构,巩固毛囊及表皮结构稳定性并提高表皮抗机械应力强度[1]。
TCHHL1存在于毛囊内根鞘结构和表皮基底层,主要参与表皮分化前期过程[4]。TCHHL1重复结构域中包含一个NLS序列和一个跨膜结构域,研究显示上述结构与核膜通透性改变及去核化有关[4]。此外,TCHHL1含量与角质形成细胞增殖呈正相关并具有抗凋亡作用,而中波紫外线辐射疗法可诱导其表达,提示TCHHL1与皮肤屏障修复相关[8-9]。
2.3HRNR HRNR主要存在于颗粒层浅表部的透明角质颗粒边缘以及角质层深部组织,HRNR与FLG间的分布差异提示HRNR生成可能晚于FLG[1- 2]。HRNR可被TG催化产生交联,参与CEs形成;HRNR还可被Calpain1蛋白酶水解产生NMFs,故HRNR也与NMFs的含量有关[10]。此外,HRNR的水解产物中的正电性多肽具有抗铜绿假单胞菌活性,参与维持皮肤微环境稳态[11]。
2.4RPTN RPTN在表皮颗粒层及角质层组织、毛囊内根鞘组织和舌丝状乳头中表达[1-2]。RPTN通过TGs催化与CEs其他组分相互交联,增强毛囊和表皮的稳定性[12]。此外,RPTN可能参与表皮屏障损伤应激和代偿修复作用过程[13]。
2.5CRNN CRNN在表皮颗粒层、角质层以及毛囊组织内表达,是表皮分化标志物之一[1-2]。CRNN参与细胞应激反应,通过钙结合域调节脱氧胆酸盐介导的钙离子释放过程,发挥抗凋亡作用[14]。CRNN也可被TGs催化产生交联,但因CRNN赖氨酸含量较低(2.4%),催化产物自身交联有限,多为与其他蛋白交联参与CEs形成并维持结构稳定性[1]。此外,有研究[15]显示CRNN可阻滞细胞从G1期向S期发展,从而抑制肿瘤增殖。
2.6FLG2 FLG2分布于表皮颗粒层的透明角质颗粒和角质层,其N端序列和A型重复结构域是CEs的交联组分之一[5]。N端序列可激活皮肤天冬氨酸蛋白酶,进而调节FLG的水解程度[16]。FLG2经PADs催化修饰的产物易被Calpain1蛋白酶水解,水解产物也作为NMFs维持皮肤表面微环境稳态。与FLG同源性较高的B型重复结构域参与并促进KIFs聚集呈束状,从而提高表皮的结构稳定性和紧密度[17]。研究[18]显示,FLG2的C端对多种假单胞菌内DNA聚合酶显示抑制活性,最终产生抑菌效果。有研究[19]显示,FLG2可维持角化细胞形态和胞间黏附,保持皮表酸性环境,还可促进FLG及HRNR水解。综上,FLG2在维持表皮结构稳定、增强表皮屏障保护功能以及防御微生物侵袭方面发挥重要作用。
3 SFTPs相关的皮肤疾病
SFTPs在表皮分化中发挥重要作用,它们参与表皮结构形成、促进皮肤水合并维持皮肤微环境稳态。SFTPs的蛋白异常表达或功能受损,易引发皮肤疾病(表2)。
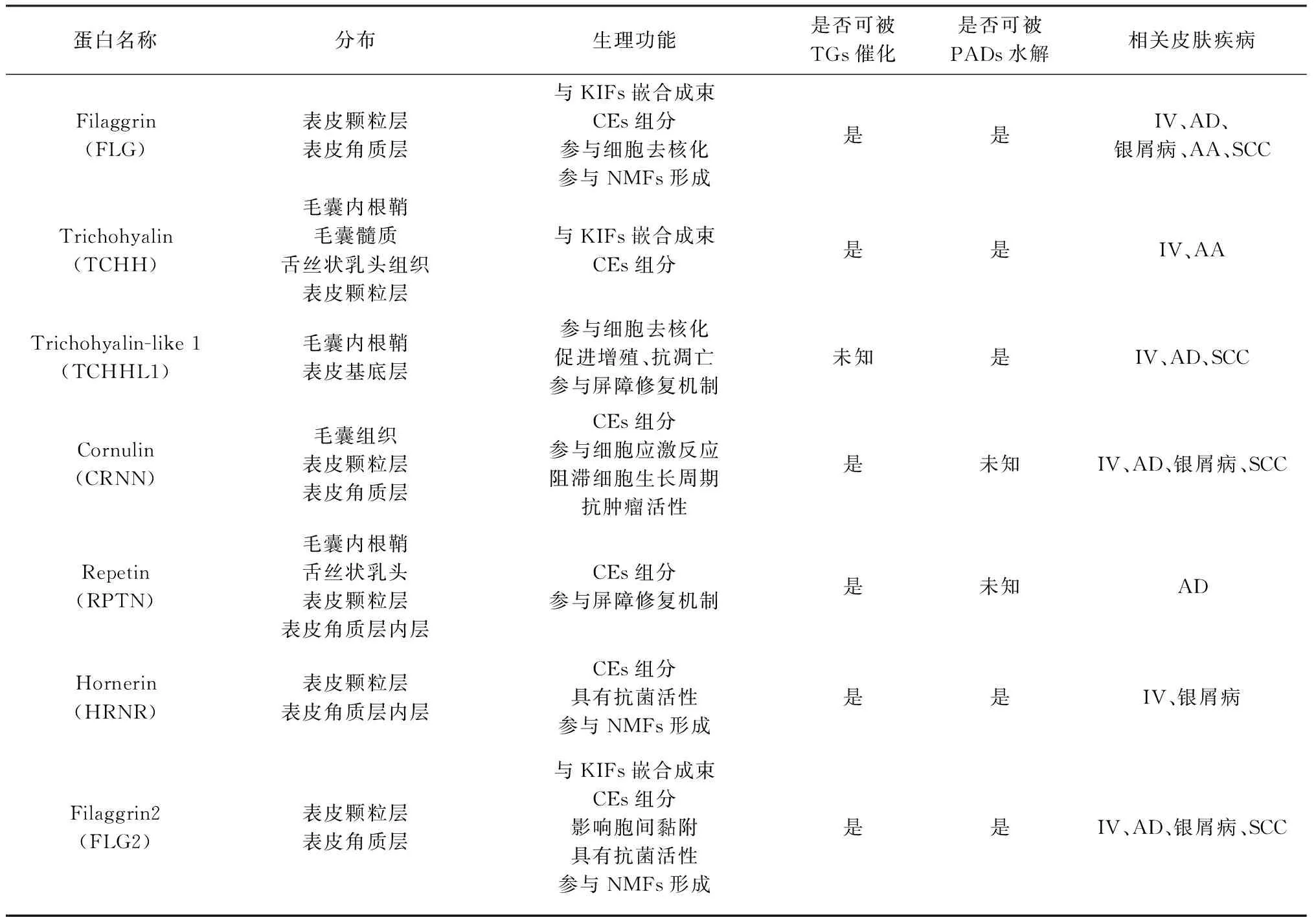
表2 SFTPs分布、生理功能及相关皮肤疾病Tab.2 Distribution, physiological function and related dermatosis of SFTPs
3.1寻常性鱼鳞病 寻常性鱼鳞病(ichthyosis vulgaris,IV)是一种常染色体显性遗传病,表现为伴有鳞屑的皮肤损伤、毛囊角质化丘疹、掌跖皲裂以及掌纹加深,IV患者的表皮颗粒层及角质层变薄,透明角质颗粒数量显著减少[20]。FLG具有半显性遗传特点,其失功能突变p.R501X和c.2282del4多在欧洲裔和亚洲裔IV患者中出现,是IV高度易感遗传因素[21]。FLG缺失导致角蛋白基质紊乱,表皮紧密度降低,易脱落鳞屑。此外,无义突变TCHH(p.E207X)、TCHHL1(p.Q294X)、FLG2(p.S2377X、p.S211X)以及CRNN、HRNR错义突变也与单独发病或合并特应性皮炎的IV发病相关[22]。
3.2特应性皮炎 特应性皮炎(atopic dermatitis,AD)是一种以复发性湿疹样病变和瘙痒为特征的过敏性皮肤病[23]。FLG是AD发病的重要遗传因素(OR=3.12~4.78),欧洲裔AD患者以p.R501X、c.2282del4为主,亚裔患者多为c.3321delA、p.S2554X[24]。而FLG2失功能突变(p.S2377X、p.A1979_Q2053del、p.H1249R)是非裔AD患者易感因素[25-26]。此外,CRNN和RPTN在AD表皮中呈现差异化表达,它们的核苷酸多态性位点(single nucleotide polymorphisms,SNPs)rs941934、rs28441202与AD严重程度、病程、血清IgE水平、嗜酸性粒细胞水平、伴行哮喘发病率显著相关[27]。最新研究[28]发现,FLG2和TCHHL1的SNPs或与欧洲及非洲裔AD患者的症状缓解相关。
3.3银屑病 银屑病(psoriasis)是一种好发于头部与四肢并以红斑、鳞屑为主要表现的慢性炎症皮肤病[29]。SFTPs在银屑病皮损组织中呈差异化表达,并参与异常角质化和炎症反应机制。例如,皮损区高表达的CRNN可通过激活PI3K/Akt和NF-κB信号通路促进角化细胞增殖以及炎症发生[30]。此外,患者表皮屏障破坏与FLG、FLG2和HRNR的表达受限相关,表达受限或与患者表皮中转录因子MafB和GATA3低表达以及IL-18、IL-1β、NLRP3炎症小体上调有关[31]。最新研究[32]发现,在银屑病和AD患者表皮中的IL-22可下调PADs水平,致使SFTPs水解减少,角质化包膜形成受限。
3.4斑秃 斑秃(alopecia areata,AA)是一种组织特异性的自身免疫性皮肤病[33]。FLG失功能突变(R501X、2282del4)可能加重合并AD的AA患者的症状[34]。AA患者毛囊中的TCHH具有自身抗原表位,可被细胞毒CD8+T细胞特异性识别,介导毛囊角质形成细胞凋亡[35]。
3.5鳞状细胞癌 鳞状细胞癌(squamous cell carcinoma,SCC)是一种常发于鳞状上皮的恶性肿瘤[36]。研究[8]发现,SCC皮肤TCHHL1高表达与鳞状细胞异常增殖和凋亡抑制有关;而CRNN在SCC中表达受限,研究[15]表明,CRNN的低表达可加重SCC侵袭浸润程度并降低患者生存率。此外,多组学数据分析[37]发现头颈部SCC组织FLG的表达水平与药物敏感性相关,这有望成为SCC患者预后的预测指标。
4 总结与展望
SFTPs是表皮分化过程中的重要蛋白,在表皮结构形成、维持表皮屏障功能、促进皮肤水合、防御微生物及过敏原侵袭等方面发挥着至关重要的作用。SFTPs的基因突变或蛋白表达异常与IV、AD、银屑病、AA、SCC发病机制相关。明确SFTPs的生理功能和它们与皮肤疾病的相关性将有助于深入理解皮肤病的发病机制并促进新药研发。

