傣药咪多领通过Wnt/β-catenin/c-myc信号通路对增生性瘢痕表皮干细胞干性的作用机制
赵文斌,叶建州,杨雪松,杨恩品,邹映东,罗光云,丛琳,王金容,谢兵,郭媛媛
增生性瘢痕(hypertrophic scar,HS)是伤口异常修复的结果,其表现为瘢痕持续增殖突出皮面,呈现潮红,质地坚硬,且高低不平和形状不规则[1]。主要原因为细胞外基质的过度沉积等[2]。目前,HS的治疗仍然是一个难题。表皮干细胞(epidermal stem cells,ESCs)是表皮组织中一种具有无限增殖和分化潜能的细胞,在皮肤稳态和伤口修复中起着重要作用[3-4]。研究发现,相比于正常皮肤,HS组织中具有更多的Integrin β1和p63阳性ESCs[5],提示ESCs在HS的发生发展中起到重要的作用。此外,研究表明,Wnt/β-catenin/c-myc通路参与皮肤的愈合过程[6],且对干细胞干性具有重要的调控作用[7-8]。提示Wnt/β-catenin/c-myc通路可能通过调控ESCs干性参与增生性瘢痕的发生发展。傣药咪多领(云南琵琶甲)是云南傣族民间常用的一种药用昆虫,笔者前期研究发现[9-12],该药在临床及动物实验中对HS均具有一定的治疗作用,但是具体机制尚需进一步明确。故本研究拟探讨傣药咪多领是否能够通过Wnt/β-catenin/c-myc通路影响ESCs干性,进而对HS具有治疗作用,为该药治疗HS提供基础的实验依据。
1 材料与方法
1.1主要试剂 新西兰大耳兔购买于昆明医科大学动物实验中心,傣药咪多领干燥粗粉购买于云南省中医医院制剂中心,青霉素、链霉素及DMEM细胞培养基购买于美国赛默飞旗下Gibco公司,Trizol、反转录试剂盒和实时定量PCR试剂盒购买于宝生物工程(大连)有限公司,BCA试剂盒及RIPA裂解液购买于海碧云天生物技术有限公司,CCK-8试剂盒购买于北京索莱宝科技有限公司,免疫印迹一抗及二抗购买于英国abcam公司,康瑞保(复方肝素钠尿囊素凝胶,10 g)购买于MerzPharma GmbH &Co.KGaA(德国),乙醇(货号:E118433)、石油醚(货号:P119716)购买于上海阿拉丁生化科技股份有限公司,苏木精伊红染色试剂盒(C0105S)购买于上海碧云天生物科技有限公司。
1.2傣药咪多领的提取制备 95%乙醇回流提取傣药咪多领干燥粗粉4次后,对乙醇提取物进行浓缩。取浓缩后的乙醇提取物进行硅胶柱层析,石油醚超声洗脱4次,30 min/次,蒸发干燥后,回收石油醚,用蒸馏水超声提取石油醚3次,30 min/次,然后对提取液进行浓缩,蒸发干燥后,即为傣药咪多领水提取物。
1.3动物模型构建、分组及观察指标 将新西兰大耳兔进行麻醉和兔耳消毒后,对兔耳的双侧耳腹做6个直径为1 cm的圆形创面,间隔2 cm;每个创面完整切除全层皮肤和软骨膜。压迫止血后,涂擦红霉素眼膏,暴露创面。上皮化后,将新西兰大耳兔随机分为NC组(对照组),Model组(HS模型组),PC组(15 mg/kg康瑞保涂抹组),LD组(0.667 g/kg傣药咪多领涂抹组),MD组(1.334 g/kg傣药咪多领涂抹组)和HD组(2.668 g/kg傣药咪多领涂抹组),每组5只新西兰大耳兔,按照分组进行涂抹外敷给药,3次/d,0.5 mL/次,持续4周,期间观察HS的颜色和质地变化,并计算瘢痕增生指数(hypertrophic indx,HI),HI=A/B,A=瘢痕凸起最高点至耳软骨表面的垂直高度;B=瘢痕周边正常皮肤皮缘至耳软骨表面的垂直高度,于建模后第56天进行取材。
1.4HE染色切片观察 取各组HS组织于固定液进行蛋白变性凝固,梯度浓度酒精进行脱水,随后进行石蜡固定包埋,于切片机上切成薄片,厚度为5 μm,水中烫平贴于载玻片上,45 ℃恒温箱中烘干后,进行苏木精-伊红染色,对染色后的切片进行脱水。将脱水后的切片滴上加拿大树胶,盖上盖玻片封固。待树胶略干后,于显微镜下观察并拍照。
1.5ESCs分离、分组及培养 将Model组中HS组织经dispase酶消化后,收集表皮组织,再经胰酶消化15 min,于200目筛网进行过滤,并收集细胞悬液。取细胞悬液1 000 r/min离心5 min,弃上清液,加入DMEM培养液重悬细胞,并接种至含Ⅳ型胶原的培养瓶中培养,采用胰酶消化传代,最终进行流式鉴定。鉴定后的ESCs分为control组(对照组),LD-cell(0.025 g/mL傣药咪多领处理组)、MD-cell(0.05 g/mL傣药咪多领处理组)和HD-cell组(0.1 g/mL傣药咪多领处理组)。
1.6Western blot检测 HS组织及ESCs中各蛋白的表达水平取各组HS组织和ESCs细胞进行RIPA裂解后,离心提取蛋白上清液进行BCA定量分析。随后进行SDS-PAGE凝胶电泳,电泳3 h后,转印至PVDF膜上,用TBS封闭1 h后,加入一抗,4 ℃孵育过夜,洗涤3次,加入相应二抗,再次洗涤3次,加入ECL化学发光底物,在凝胶成像系统中显影并拍照,用Image J进行条带灰度值分析。
1.7RT-qPCR检测 HS组织及ESCs中各mRNA的表达水平取各组HS组织及ESCs细胞,Trizol溶液提取总RNA,应用反转录试剂盒将总RNA反转录为cDNA,随后通过实时荧光定量PCR试剂盒进行mRNAs的定量分析,内参为GAPDH,引物序列见表1。qPCR反应体系:10 μL TB Green Premix Ex Taq Ⅱ,各0.8 μL PCR正反引物,0.4 μL ROX Reference Dye,2 μL DNA模板及6 μL H2O2。qPCR反应条件:95 ℃ 5 min,94 ℃变性30 s,60 ℃退火30 s,进行35个循环。实验结果采用2-ΔΔCt法进行计算。
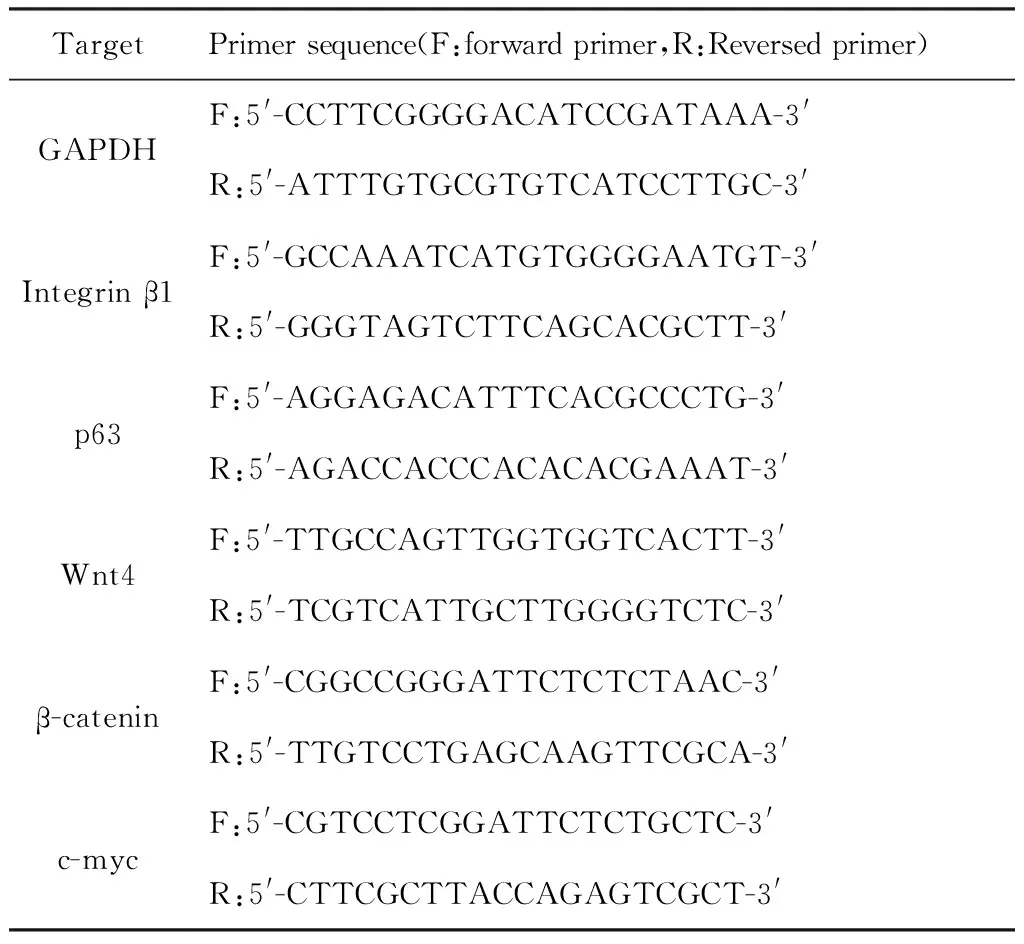
表1 引物序列Tab.1 Primer sequence
1.8免疫荧光对HS组织中的Wnt4、β-catenin和c-myc进行定量和定位 将各组HS组织石蜡切片进行脱水和脱蜡,然后抗原修复,用PBS洗涤3次,5 min/次,10% BSA封闭30 min。取出滴加荧光一抗,37 ℃孵育30 min,PBS洗涤3次,5 min/次;滴加荧光二抗,37 ℃孵育30 min,PBS漂洗3次,5 min/次。甘油缓冲液封片后,荧光显微镜于40×下进行观察和拍照,并用Image J进行荧光值分析。
1.9CCK-8检测ESCs细胞活力 取各组对数生长期ESCs细胞,接种于96孔板中,每孔5×103个ESCs细胞,37 ℃、5% CO2培养箱中培养24 h后,每孔加入10 μL CCK-8溶液,培养箱孵育2 h,然后酶标仪在450 nm处测定OD值,并利用各时间点的测定OD值绘制细胞增殖曲线。
1.10干细胞成球实验检测ESCs成球效率 取各组对数生长期ESCs细胞,PBS洗涤3次去除含血清的旧培养基。用无血清悬浮培养基重悬细胞,并接种于低黏附的6孔板中,每孔500个ESCs细胞,常规培养7 d。收集形成的细胞球,1 000 r/min离心5 min去除上清液,随后胰酶消化5 min,PBS洗涤2次,用无血清悬浮培养基重悬细胞,每孔500个ESCs细胞,常规培养7 d后观察ESCs成球情况。
1.11统计学分析 实验数据采用SPSS20.0统计学软件进行分析,相关图片的绘制采用Graphpad 8.0软件进行绘制。组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。所有实验均重复3次。
2 结果
2.1傣药咪多领对兔耳HS的影响 于建模后第56天对兔耳取材,并观察各组HS变化。结果表明,PC组、MD组及HD组中HS的HI指数均显著低于Model组(F=19.99,P<0.05,图1a),且PC组和HD组HI指数差异无统计学意义。此外,Model组HS呈现红色,且质地坚硬,而PC组、LD组、MD组和HD组HS颜色及质地与周围皮肤相近,见图1a。同时,对各组HS组织进行了HE染色发现,相比于NC组,Model组表皮下结缔组织增生,真皮层中存在大量成纤维细胞,排列无序,细胞间质有胶原纤维沉积,且微血管增生,管腔内有红细胞,结构与人HS组织切片相似。相比于Model组,PC组、LD组、MD组和HD组表皮下结缔组织增生和真皮层血管增生有不同程度的下降,各纤维密度也不同程度下降,此外表层排列较为规则,内层排列紊乱,见图1b。由以上结果可知,兔耳增生性瘢痕动物模型构建成功,且傣药咪多领对兔耳增生性瘢痕具有一定的治疗作用。此外,HD组中傣药咪多领剂量与HS治疗药物-康瑞保治疗效果相近。
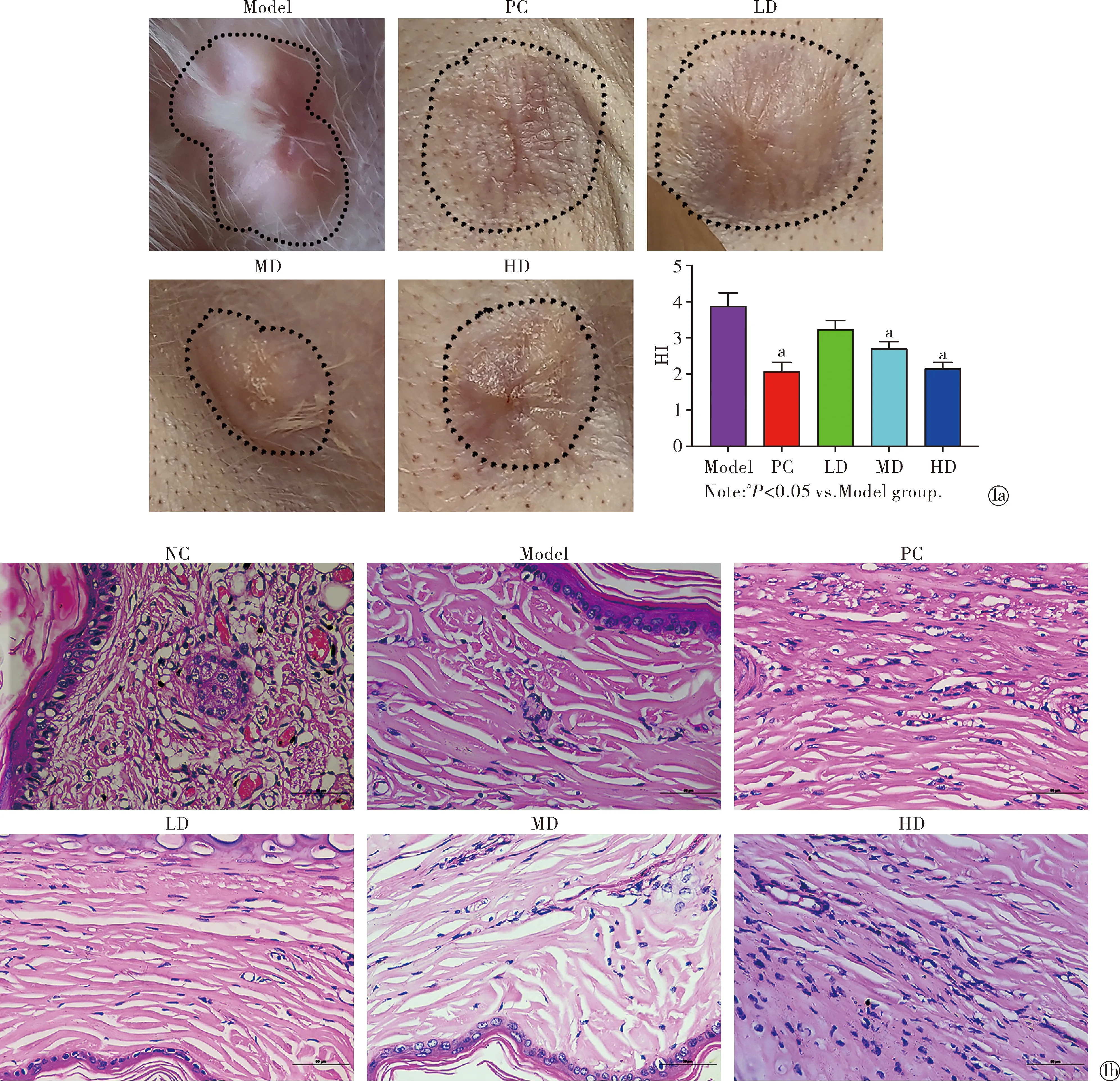
Characteristics of HS of rabbit ears in each group; HE staining of HS of rabbit ears in each group (×400)图1 傣药咪多领对兔耳HS的影响Fig.1 Effect of Blapsrynchopetera fairmaireon HS of rabbit ears
2.2傣药咪多领对HS中ESCs标志物和Wnt/β-catenin/c-myc信号通路的影响 Western blot结果显示(图2a),相比于NC组,Model组中ESCs标志物Integrin β1(t=60.76,P<0.05)、p63(t=52.44,P<0.05)、Wnt4(t=47.80,P<0.05)、β-catenin(t=79.75,P<0.05)、c-myc(t=55.71,P<0.05)蛋白均异常高表达(P<0.05),且PC组、LD组、MD组和HD组中Integrin β1(F=1098.00,P<0.05)、p63(F=1977.00,P<0.05)、Wnt(F=800.00,P<0.05)、β-catenin(F=1139.00,P<0.05)、c-myc(F=1115.00,P<0.05)蛋白的表达水平显著低于Model组(P<0.05),而NC组、PC组和HD组间差异无统计学意义。RT-qPCR结果显示(图2b),Model组中Integrin β1 mRNA(t=35.72,P<0.05)和p63 mRNA(t=47.29,P<0.05)表达水平显著高于NC组,且PC组、LD组、MD组和HD组中Integrin β1 mRNA(F=798.60,P<0.05)和p63 mRNA(F=849.90,P<0.05)表达水平显著低于Model组。进一步通过免疫荧光检测发现(图2c),Model组中Wnt4(t=35.28,P<0.05)、β-catenin(t=46.56,P<0.05)、c-myc(t=35.58,P<0.05)平均荧光水平显著高于NC组,且PC组、LD组、MD组和HD组中Wnt4(F=376.50,P<0.05)、β-catenin(F=350.20,P<0.05)和c-myc(F=342.10,P<0.05)平均荧光水平显著低于Model组。由以上结果可知,兔耳HS中ESCs相关标志物异常高表达,且Wnt/β-catenin/c-myc信号通路被异常激活,此外,傣药咪多领和康瑞保均能恢复这些蛋白的表达水平,且HD组中傣药咪多领与康瑞保恢复效果差异无统计学意义(P>0.05)。
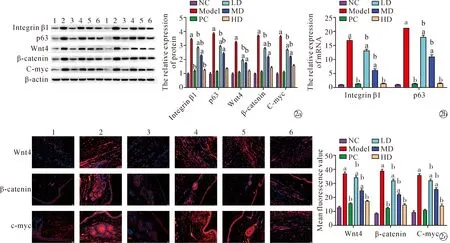
Note:aP<0.05 vs. NC group;bP<0.05 vs. Model group; 1 indicated NC group; 2 indicated Model group;3 indicated PC group; 4 indicated LD group; 5 indicated MD group; 6 indicated HD group.The expression levels of ESCs markers and Wnt/β-catenin/c-myc pathway-related proteins were detected by Western blot; The expression levels of ESCs markers mRNA were detected by RT-qPCR;Quantitative and localization analysis of Wnt/β-catenin/c-myc pathway-related proteins by immunofluorescence图2 傣药咪多领对HS中ESCs标志物和Wnt/β-catenin/c-myc信号通路的影响Fig.2 Effect of Blapsrynchopetera Fairmaire on the expression of markers of ESCs and Wnt/β-catenin/c-myc pathway in HS tissues of rabbit ears
2.3成功分离ESCs Model组兔耳HS中分离的ESCs,在普通光学显微镜下呈椭圆状,且具有较大的细胞核,胞质和包浆较少,整个细胞结构简单,符合干细胞的一般形态和结构,见图3a。此外,通过免疫荧光检测了ESCs标志物的表达水平和定位,结果显示,ESCs中均有Integrin β1和p63表达,且主要集中表达在细胞质中,符合ESCs中Integrin β1和p63的表达定位,见图3b。进一步通过流式细胞仪检测另外的ESCs标志物表达水平,结果显示,相比于control组、LD-cell组、MD-cell组和HD-cell组中CD29(F=137.50,P<0.05)、CD19F(F=59.61,P<0.05)和CK19(F=106.20,P<0.05)阳性细胞比率均下调,见图3c。由以上结果可知,成功分离了ESCs,且傣药咪多领可能会抑制兔耳HS中分离的ESCs干性。
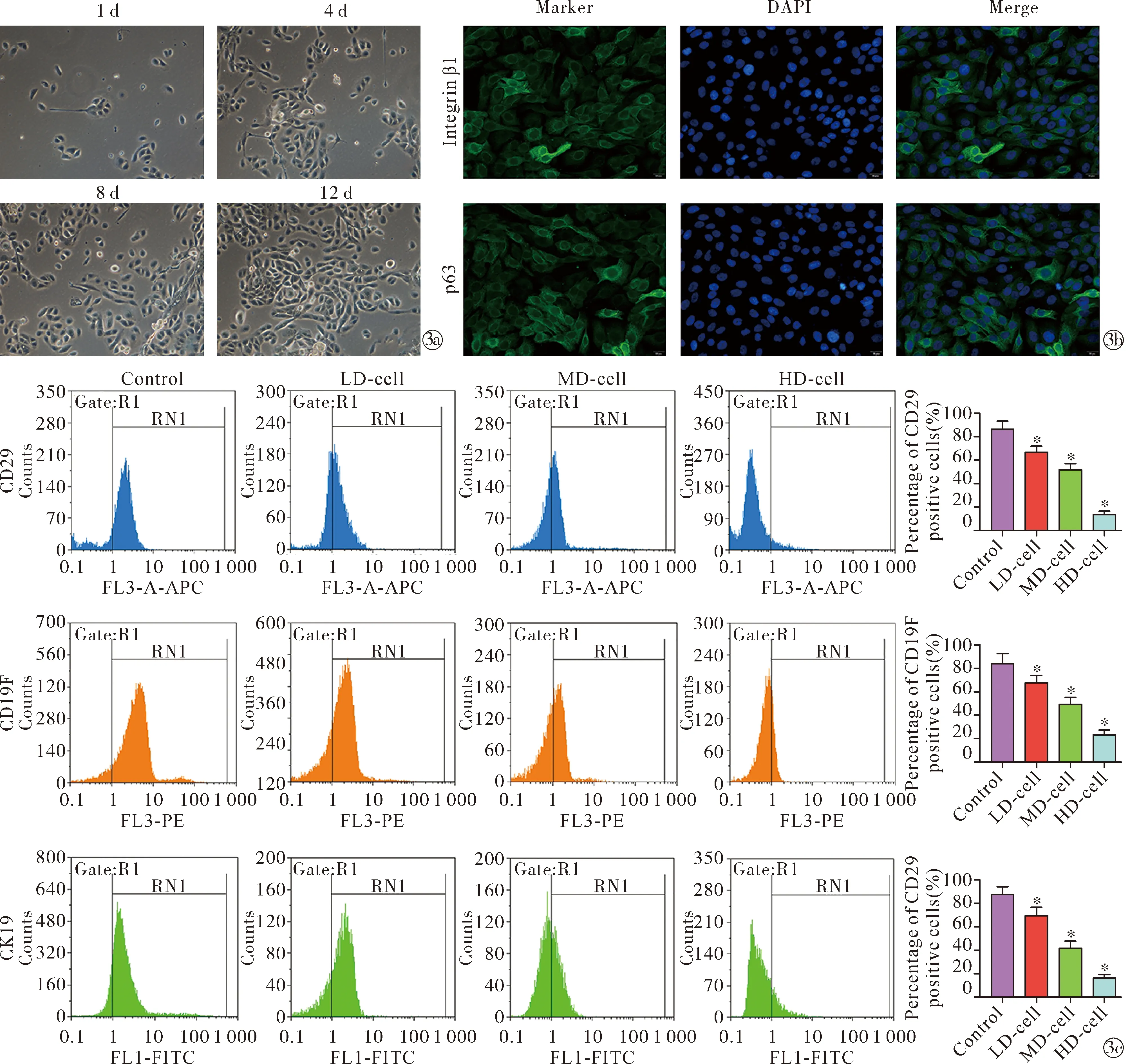
Note:*P<0.05 vs. control group.Morphology and structure of ESCs under ordinary light microscope; Quantitative and localization analysis of ESCs markers by immunofluorescence;The rate of each positive cells was detected by Flow cytometry图3 成功分离ESCsFig.3 Successfully separated ESCs
2.4傣药咪多领对ESCs干性的影响 Western blot(图4a)及RT-qPCR(图4b)结果显示,相比于control组,MD-cell组和HD-cell组中Integrin β1(蛋白:F=91.23,P<0.05;mRNA:F=246.90,P<0.05)和p63(蛋白:F=68.85,P<0.05;mRNA:F=162.10,P<0.05)蛋白和mRNA的表达水平显著下调。CCK-8结果显示,傣药咪多领对ESCs的抑制作用呈现剂量依赖性,且IC50=0.836 g/mL,见图4c。干细胞成球实验结果显示(图4d),LD-cell组、MD-cell组和HD-cell组ESCs成球数显著低于control组(F=85.10,P<0.05)。由以上结果可知,傣药咪多领能够抑制ESCs干性。
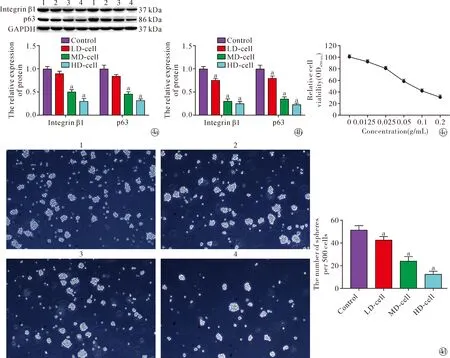
Note:aP<0.05 vs. control group; 1 indicated control group; 2 indicated LD-cell group; 3 indicated MD-cell group; 4 indicated HD-cell group.~ The expression levels of ESCs markers were detected by Western blot and RT-qPCR; The proliferation of ESCs were detected by CCK-8; Sphere efficiency of ESCs was detected by stem cell spheroidization test图4 傣药咪多领对ESCs干性的影响Fig.4 Effect of Blaps rynchopetera Fairmaire on stemness of ESCs
2.5傣药咪多领通过Wnt/β-catenin/c-myc信号通路对ESCs干性的影响 为了探讨傣药咪多领是否通过Wnt/β-catenin/c-myc信号通路影响ESCs干性,本观察将ESCs分为control组,BRF(0.836 g/mL傣药咪多领处理)组和LiC1(0.836 g/mL傣药咪多领和Wnt/β-catenin/c-myc通路激活剂LiC1处理)组,并通过Western blot、RT-qPCR、CCK-8及干细胞成球实验进行了验证。
Western blot和RT-qPCR结果显示,相比于control组,BRF组中Integrin β1(蛋白:t=13.29,P<0.05;mRNA:t=21.87,P<0.05)、p63(蛋白:t=16.78,P<0.05;mRNA:t=14.13,P<0.05)、Wnt(蛋白:t=7.69,P<0.05;mRNA:t=10.89,P<0.05)、β-catenin(蛋白:t=9.46,P<0.05;mRNA:t=11.90,P<0.05)、c-myc(蛋白:t=15.18,P<0.05;mRNA:t=12.39,P<0.05)蛋白及mRNA的表达水平显著下调(图5a~5b,P<0.05),且相比于BRF组,LiC1组中Integrin β1(蛋白:t=9.68,P<0.05;mRNA:t=13.25,P<0.05)、p63(蛋白:t=8.67,P<0.05;mRNA:t=11.11,P<0.05)、Wnt(蛋白:t=6.16,P<0.05;mRNA:t=9.75,P<0.05)、β-catenin(蛋白:t=7.87,P<0.05;mRNA:t=7.61,P<0.05)、c-myc(蛋白:t=6.73,P<0.05;mRNA:t=9.54,P<0.05)蛋白及mRNA的表达水平显著上调。CCK-8结果显示(图5c),BRF组和LiC1组中ESCs增殖活力显著低于control组(t=11.80,P<0.05),且相比于BRF组,LiC1组中ESCs增殖活力明显增加(t=3.00,P<0.05)。此外,干细胞成球实验结果显示(图5d),BRF组和LiC1组中ESCs成球数显著低于control组(t=13.27,P<0.05),且相比于BRF组,LiC1组中ESCs成球数明显增多(t=10.79,P<0.05)。由以上结果可知,傣药咪多领通过抑制Wnt/β-catenin/c-myc信号通路的激活,从而抑制ESCs干性。
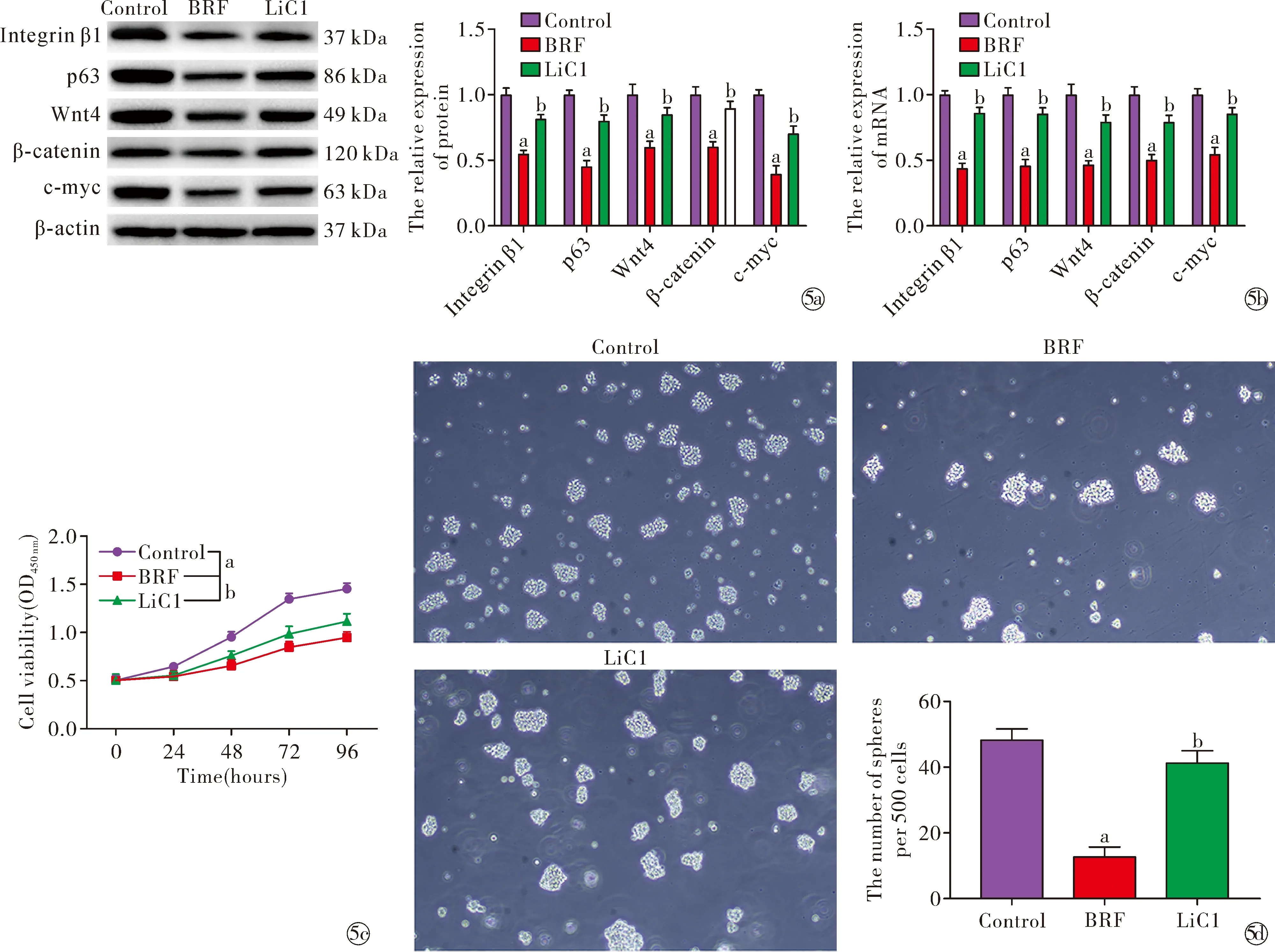
Note:aP<0.05 vs. control group; bP<0.05 vs. BRF group.~ The expression levels of ESCs markers and Wnt/β-catenin/c-myc pathway-related protein were detected by Western blot and RT-qPCR; The proliferation of ESCs were detected by CCK-8; Sphere efficiency of ESCs was detected by stem cell spheroidization test图5 傣药咪多领通过Wnt/β-catenin/c-myc信号通路对ESCs干性的影响Fig.5 Effect of the Blaps rynchopetera Fairmaire on the stemness of ESCs through the Wnt/β-catenin/c-myc pathway
3 讨论
HS是一种伤口愈合失常的常见病,其特征是过度纤维化以及皮肤成纤维细胞的胶原蛋白紊乱[13]。HS通常发生在深层次创伤或烧伤之后的伤口愈合过程中,严重者影响正常功能,从而给患者带来身体、心理和美学问题[14]。临床数据表明,HS在手术后及烧伤后具有极高的发病率,且在伤后2~18个月呈指数生长[15]。HS形成的主要危险因素包括性别、年龄、遗传易感性、免疫反应、损伤类型、伤口大小和深度、伤口的解剖部位和机械张力等[16]。但是,目前对HS发育的机制了解得不全面,因此没有特效的疗法。祖国医学博大精深,对瘢痕的治疗具有悠久的历史,一般认为瘢痕与先天禀赋和素体特异有关,多采用攻毒散结、活血化瘀和通络止疼之品进行治疗[17]。据《中华本草》和《西双版纳傣药志》记载,傣药咪多领是云南傣族长期使用的一种药用昆虫,具有消炎、抗菌、免疫调节和解毒等功效。本研究通过新西兰大耳兔构建HS动物模型,探讨傣药咪多领对HS的影响。研究发现,傣药咪多领可显著减少HS组织中成纤维细胞数目、胶原纤维密度和HI指数,且傣药咪多领作用后HS的颜色和质地基本恢复至正常皮肤水平,表明傣药咪多领对HS具有一定的治疗作用,此外,本研究还探讨了傣药咪多领对HS的作用机制。
ESCs是具有无限增殖潜能的细胞群,可以通过对称或不对称分裂实现自我更新,连续产生功能性细胞以维持表皮的稳态,分布在表皮和毛囊基底层的ESCs是皮肤发育、新陈代谢和损伤修复的重要细胞来源[18]。当皮肤受到创伤时,ESCs迁移和增殖水平显著上调,且分泌不同的细胞因子和生长因子参与表皮-间充质细胞相互作用[19]。研究[20]发现,HOXA9通过上调ESCs中VEGF表达水平促进ESCs干性,从而有助于HS的发展;ESCs在瘢痕形成期干性显著增强[21];此外,Plikus等[22]也发现,ESCs在创面愈合和瘢痕形成过程中增殖和分化能力显著上调。这些研究成果都提示,ESCs干性的增强与HS的发生发展密切相关。本研究发现,相比于正常皮肤,增生性瘢痕中ESCs标志物Integrin β1和p63的表达水平显著上调,且傣药咪多领能显著抑制Integrin β1和p63的表达水平及ESCs增殖和克隆形成数,从而对HS具有一定的治疗作用。研究发现,Wnt/β-catenin/c-myc信号通路在HS发生发展中起到重要的调控作用,且参与多种干细胞干性的调控。例如,Sato等[23-24]发现,Wnt/β-catenin/c-myc信号通路在HS中异常激活,并促进HS的发生发展,Sun等[6]也得到了同样的结论。有学者发现[25],作为Wnt/β-catenin通路的下游靶标,c-myc在HS中被异常激活,促进成纤维细胞的增殖和分化,胶原蛋白的合成和降解以及细胞因子的调节,最终导致瘢痕增生。另有研究[26]显示c-myc在皮肤瘢痕和皮肤瘢痕癌组织中高表达。本研究发现,Wnt/β-catenin/c-myc信号通路在体内HS组织中异常被激活,且在体外ESCs细胞中异常高表达,且LiC1处理ESCs后,ESCs干性增强,而傣药咪多领能逆转这一过程。
综上所述,本研究探讨了傣药咪多领通过Wnt/β-catenin/c-myc信号通路对增生性瘢痕表皮干细胞干性的影响,Wnt/β-catenin/c-myc信号通路相关蛋白和ESCs标志物在体内HS组织和体外ESCs中均异常高表达,且傣药咪多领能够抑制它们的表达水平,且对HS具有一定的治疗效果。此外,在体外利用LiC1激活ESCs中Wnt/β-catenin/c-myc信号通路后,ESCs的干性显著增强,而傣药咪多领能够抑制这一过程。因此,傣药咪多领能够通过抑制Wnt/β-catenin/c-myc信号通路激活抑制ESCs干性,从而影响HS的发展。

