猴头菇子实体寡糖的制备及抑制酪氨酸酶活性的研究
郭宇婷,鲍金秋,沙建军,霍光明*
(1. 南京晓庄学院 食品科学学院/南京市食用菌产业技术研究中心,江苏 南京 211171;2. 南京金时川生态农业科技有限公司,江苏 南京 211121)
猴头菇(Hericiumerinaceus)是我国传统食药用菌,营养丰富且具有安神、抗癌的作用,对身体虚弱、消化不良、失眠、十二指肠溃疡、慢性胃炎、消化道肿瘤等疾病有很好的治疗作用[1, 2].目前,猴头菇的研究主要集中在多糖方向[3-5],多糖具有较好的活性,但分子结构过大、水溶性较差、血脑屏障通过率较低,多糖活性成分的释放变得困难,不易被人体消化吸收.与多糖相比,寡糖具有类似多糖的活性,但分子量更小,易被人体吸收利用[6],但猴头菇寡糖在有效成分的提取、生理功能研究和结构鉴定等方面鲜见报道.
本研究采用热水浸提法从猴头菇子实体中提取寡糖,用蒽酮硫酸法测得寡糖含量,乙醇沉淀制得粗寡糖通过离子交换层析法进行分离纯化.通过离子交换色谱法、高效液相色谱法、傅里叶变换红外光谱方法,测定寡糖样品中单糖组分、分子量、红外图谱等结构信息,并评价寡糖样品对酪氨酸酶的抑制活性能力.
1 材料和方法
1.1 材料
猴头菇子实体来源于南京晓庄学院菌物研究所食用菌生产基地,选取品相优良、外观完整、个头适中的猴头菇子实体,剔除根部及霉烂部分,沥去多余水分,去皮称重.将猴头菇切片处理,放置于烘箱50 ℃下烘干至恒重,制成干猴头菇片,在高速粉碎机中粉碎成 60目的猴头菇粉末,以便溶剂能充分浸提其中寡糖物质.
1.2 实验方法
1.2.1 猴头菇寡糖提取、分离和纯化
猴头菇粉(273 g)与石油醚(m:v=1∶5)浸泡除脂,除脂猴头菇粉末加入蒸馏水(m:v=1∶20),80 ℃提取12 h,用30~50 μm定性滤纸过滤,滤液浓缩后与乙醇(最终浓度为 80%)混合沉淀,得到乙醇沉淀部分.沉淀部分重新溶解后用5KD超滤膜再生纤维素膜PLCC(美国 Millipore公司)分离,渗透液浓缩后经 DEAE Sephadex A-50柱分离纯化.
1.2.2 单糖组成测定
先取16种单糖标准品配成标准品溶液,采用离子色谱仪[7]测定单糖组成,分别精密称量10.00 mg(H8026和H8053)猴头菇样品置于安瓿瓶中,加入3M TFA 10 ml,120 ℃水解3 h.准确吸取酸水解溶液转移至管中氮气吹干,加入10 ml水涡旋混匀,吸取100 μL加入900 μL去离子水,12000 rpm下离心5 min.取上清液进行IC分析.
色谱柱:DionexCarbopacTMPA20(3*150);流动相:A:H2O; B:15 mM NaOH;C: 15 mM NaOH&100 mM NaOAC;流速:0.3 mL/min;进样量:5 μL;柱温:30 ℃;检测器:电化学检测器.
1.2.3 分子量测定
精密称取样品和标准品右旋糖酐分子量标准配套(Dextran Standards Kit,Sigma),样品配制成5 mg/ml溶液,12000 rpm 离心10 min,上清液用0.22 μm的微孔滤膜过滤,然后将样品转置于1.8 ml进样小瓶中.通过HPGPC[8]测定多糖分子量和纯度.
色谱柱:BRT105-104-102串联凝胶柱(8 × 300 mm);流动相:0.05 M NaCl溶液;流速:0.6 mL/min;柱温:40 ℃;进样量:20 μL;检测器:示差检测器RI-10A.
1.2.4 傅里叶红外图谱分析
精密称取样品2 mg和溴化钾 200 mg,压制成片,空白对照采用溴化钾粉末压片而成.分别置于傅里叶变换红外光谱仪[9]FT-IR650(天津港东科技发展股份有限公司)进行扫描记录,而后分析多糖的官能团.
1.2.5 猴头菇寡糖抑制酪氨酸酶活性的测定
参照文献抑制酪氨酸酶活性测定方法[10, 11],并稍做修改.实验分为四组,包含阴性对照组、空白组、空白对照组、实验组.底物为20 mmol/L的L-多巴,不同浓度(包含0.5 、1.0、3.0、5.0、7.0 mg/mL)的猴头菇寡糖H8026和H8053组分,各浓度(0.1、0.2、0.3、0.4、0.5 mg/mL)的VC样品溶液,将底物与酶的浓度保持恒定,改变抑制剂浓度,测定酶催化活力,得到酶抑制率.反应液总体积为200 uL,混匀;在加底物前,先将96孔板放置在酶标仪30 ℃下预热5 min,反应10 min,在波长475 nm下测定,平行实验3次.酪氨酸酶活性的抑制率计算如下:
抑制率=[(A-B)-(D-C)]/(A-B)×100%
(1)
其中,A(阴性对照):磷酸缓冲液+酪氨酸酶+底物;B(空白组):磷酸缓冲液+底物;C(空白对照组):磷酸缓冲液+不同浓度(多糖和VC)抑制剂样品+底物;D(实验组):磷酸缓冲液+不同浓度(多糖和VC)抑制剂样品+酪氨酸酶+底物.
2 结果与分析
2.1 猴头菇寡糖的制备
猴头菇寡糖经除脂、水提醇沉和膜过滤后,经DEAE Sephadex A-50柱分离纯化得到组分H8026和H8053(图1),质量分别为5.72 g和7.34 g.

图1 浓度为0.1 mol/L NaOH的80%乙醇沉寡糖洗脱峰图
2.2 单糖组成分析
采用离子色谱法分析寡糖中单糖组分(图2).标准母液溶液中16种单糖标准品(图2A)为(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、氨基半乳糖盐酸盐、盐酸氨基葡萄糖、N-乙酰-D氨基葡萄糖、古罗糖醛酸、甘露糖醛酸),其出峰时间依次为6.125、11.284、11.717、12.384、14.000、15.475、17.517、19.359、20.275、20.850、23.700、25.959、44.675、45.317、47.475、50.184.根据单糖标准品出峰时间鉴定H8026和H8053猴头菇寡糖的单糖组成.
对照图2A单糖混合对照标准品色谱图中的主要色谱峰的保留时间,则H8053中的单糖由阿拉伯糖、盐酸氨基葡萄糖、半乳糖、葡萄糖、N-乙酰-D氨基葡萄糖和木糖组成(图2B),其摩尔比例为0.177∶0.010∶0.078∶0.479∶0.019∶0.237(表1);而H8026由半乳糖、葡萄糖和木糖组成(图2C),摩尔比例为0.966∶0.020∶0.014(表1).

图2 混标16糖、H8053单糖及H8026单糖的离子色谱图

表1 H8026和H8053单糖组成、保留时间、摩尔比以及相应面积
2.3 分子量测定
本实验采用HPLC凝胶色谱法测定猴头菇寡糖的分子量测定及纯度.HPLC凝胶色谱法具有操作简便、快速、准确、灵敏度高的优点.lgMw-RT(重均分子量)校正曲线方程为:y=-0.1817x+11.798,R2=0.9958;根据标准品曲线,得出计算公式进而计算出样品的分子量(表2).结果表明,H8026猴头菇寡糖在46.897 min出峰,lgMw分别为3.3,重均分子量Mw为1892,峰面积比为82.329%;H8053猴头菇寡糖出峰时间在46.964 min,lgMw分别为3.3,重均分子量Mw为1839,峰面积比为77.647%.

表2 H8026、H8053猴头菇寡糖的分子量及峰面积
2.4 猴头菇寡糖红外图谱分析
H8053及H8026寡糖组分的红外图谱分析结果见图3.H8053在3315cm-1吸收峰是糖类的特征峰,归因于O-H的伸缩振动.1735cm-1、1695cm-1属于C=O伸缩振动,1625cm-1属于N-H变角振动,1403cm-1属于C-O伸缩振动,1047cm-1、1031cm-1处属于O-H变角振动[12].H8053在850cm-1处有吸收峰,由此判断该寡糖是β-吡喃糖.H8026在3423cm-1、3311cm-1是糖类O-H的伸缩振动吸收峰,1735cm-1、1695cm-1属于C=O伸缩振动,1623cm-1属于N-H变角振动,1407cm-1属于C-O伸缩振动,1047cm-1、1031cm-1属于O-H变角振动[12].
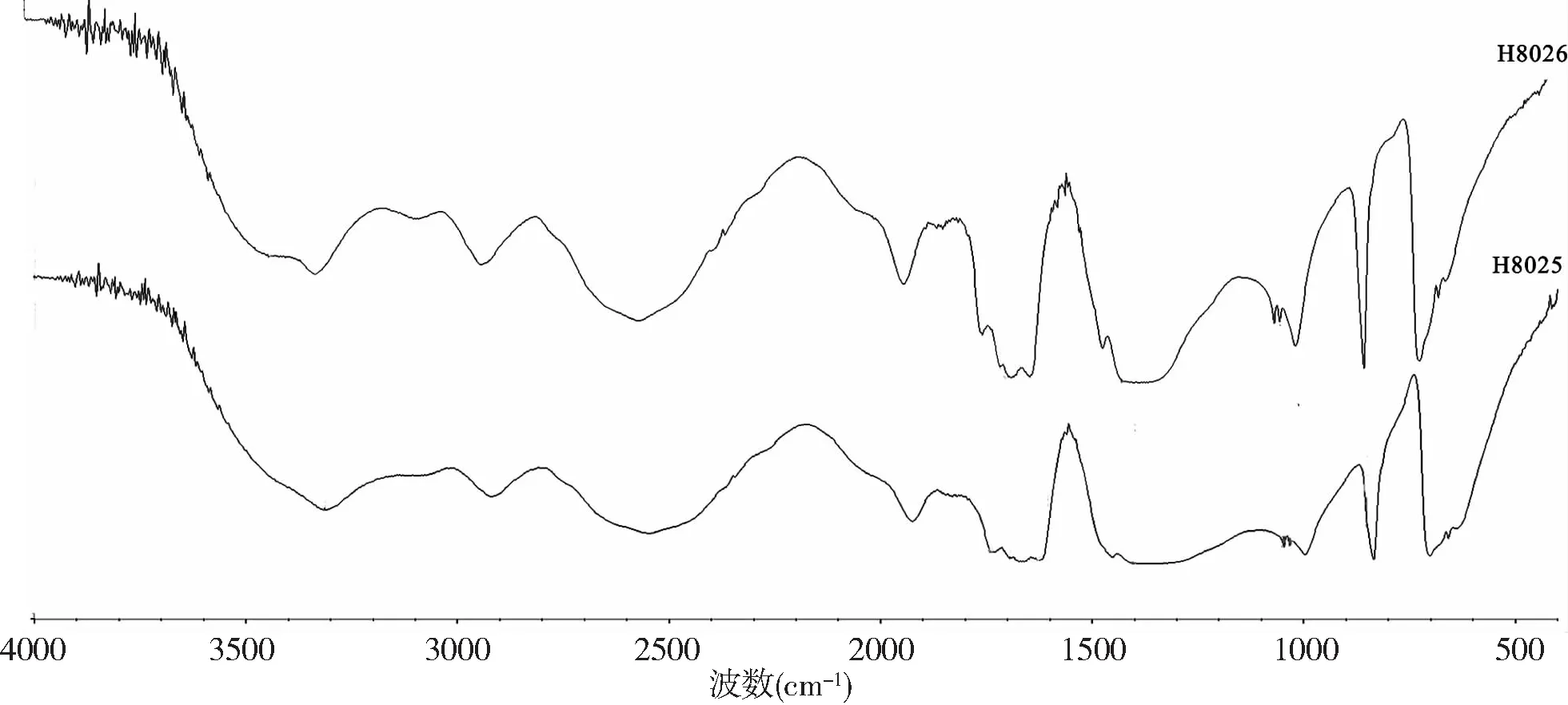
图3 H8053及H8026寡糖红外图谱分析
2.5 猴头菇寡糖对酪氨酸酶活性的抑制作用
探究猴头菇寡糖对酪氨酸活性的影响,结果如表3所示,猴头菇寡糖H8026、H8053对酪氨酸酶均表现出抑制活性.酪氨酸酶是黑色素合成的关键酶,以酪氨酸酶为靶标,猴头菇寡糖在抑制褐变等领域有望得到应用.

表3 猴头菇寡糖对酪氨酸酶活性的抑制作用
3 小结
在本文中,我们提取、分离了寡聚糖H8026和H8053并进行了表征,两种寡糖对酪氨酸酶活性均表现出一定的抑制作用.与多糖相比,寡糖更容易被提取、分离和鉴定,也更容易被人体吸收和利用.猴头菇子实体寡糖研究对猴头菇的开发利用和功能产品研发有重要意义.

