一种快速识别Fe3+的苯并噻唑类探针及其在生物成像和复合纳米纤维膜中的应用
曹多军,张志龙,蔡园园,赵志文,张小宇,张劲龙,李祥子*,程国友,孔亚琼*
(1. 巢湖学院 化学与材料工程学院,安徽 巢湖 238024;2. 合肥职业技术学院 生物工程学院,安徽 巢湖 238000;3. 皖南医学院 药学院,安徽 芜湖 241002)
近几十年来,环境污染和生理疾病严重威胁着人类的健康和发展.在大多数情况下,它们之间存在着密切的因果关系.在各种环境污染物中,重金属占有很大的比例.铁作为最重要的过渡金属,被广泛应用于不同的工业领域,极大地促进了人类文明的进步.然而,水或土壤中过量的铁会带来严重的环境问题.此外,铁作为人体不可或缺的微量元素之一,在生命体内催化各类生物化学反应起着至关重要的作用,而生物化学反应过程是生命赖以生存的基础[1].例如,Fe3+可以与血红蛋白形成配位化合物,进而将氧气运输到全身各部位[2].但铁离子的缺乏和过量可能导致贫血、细胞损伤和血色素沉着症等多种疾病[3].因此,探索一种能够有效且选择性地检测自然环境和生物系统中微量Fe3+的方法是非常有必要的.
与传统的阳离子检测方法相比,荧光探针技术具有简单、灵敏度高、瞬间响应、实时监测等特点,近年来在疾病诊断和环境监测领域受到广泛关注.到目前为止,科学家们已经设计了各种Fe3+荧光探针,如基于Schiff碱[4]、噁二唑衍生物[5]、罗丹明和香豆素衍生物[6]等.与此同时,具有大斯托克斯位移和高量子产率的苯并噻唑共轭结构已广泛应用于光电材料的制备[7].然而,基于苯并噻唑类Fe3+荧光探针由于pH稳定性差和响应时间长,报道较少.因此,开发高性能的苯并噻唑类探针是一项富有挑战性的任务.基于Fe3+的顺磁性[8],我们设计并合成了一种简单的苯并噻唑基Fe3+荧光探针(BZ),用NMR和HR-MS对BZ的结构进行了表征.该探针能快速与Fe3+结合并且猝灭探针BZ的荧光.实验结果表明,BZ不仅对Fe3+具有良好的选择性和高灵敏度,而且在较宽的pH条件下具有良好的稳定性.Job’s曲线和ESI-HRMS表明,BZ的荧光猝灭是由BZ与Fe3+形成2∶1络合物引起的.同时,探针BZ具有较低的细胞毒性,可以监测真实水样和活细胞中Fe3+.最后,由静电纺丝得到的BZ复合纳米纤维膜表现出优异的Fe3+响应,有望用于Fe3+的实时和实地检测.
1 实验部分
1.1 原料与仪器
所有化学试剂都是分析纯(AR),使用时没有进一步纯化.探针BZ用DMSO配成10 mM 母液,并在-18 ℃保存备用.各种金属离子溶液均用二次蒸馏水配制,浓度为100 mM,工作溶液用含25% DMSO的水溶液(pH=7.4)稀释.用适量的盐酸(1 M)或氢氧化钠溶液调节溶液的pH值.
T9CS紫外-可见分光光度计,F97XP荧光分光光度计,狭缝宽度为10 nm.布鲁克Avance核磁共振光谱仪(600 MHz),Thermo UPLC-Q Exactive Orbitrap HR-MS光谱仪,pH-3ct pH计,徕卡TCS SP8荧光成像显微镜,ThermoFisher Multiskan GO微板阅读器测定细胞活力.

图1 荧光探针BZ的合成
1.2 实验步骤
(1) 荧光探针BZ的合成[9]在100 mL圆底烧瓶中,加入聚磷酸(1 mL)并加热到70 ℃.再加入2-氨基苯硫酚(62.5 mg, 0.5 mmol),得到黏性溶液并搅拌10 min,然后加入3,4-二氨基苯甲酸(46 mg, 0.3 mmol).将上述混合物加热到100 ℃,搅拌一夜.冷却后,将溶液倒入冰浴中,用饱和的Na2CO3溶液中和.过滤得到棕色沉淀并在60 ℃真空干燥.粗产物用PE/EA经快速色谱洗脱得到棕色固体(50 mg, 产率68.8%).1H NMR(600 MHz, CDCl3, δ ppm): 7.97(d, J=6.0 Hz,1H), 7.83(d, J=6.0 Hz,1H), 7.51(s,1H), 7.43(m, 2H), 7.31(d, J=12.0 Hz,1H), 6.74(d, J=12.0 Hz,1H), 3.72(s, 2H), 3.45(s, 2H). ESI-HRMS(ESI) m/z calcd for[BZ+H]+, 242.0752, found 242.0767.
(2) 细胞培养及细胞毒性测试 HepG2细胞(购自ATCC, Rockville, MD, USA)在含10%胎牛血清(胎牛血清,Gibco BRL)、100 U/mL青霉素(Gibco BRL)和100 μg/mL链霉素的DMEM(Dulbecco’s改良Eagle’s培养基,Gibco BRL)培养基中培养.然后,细胞在加湿的培养箱中培养(5% CO2和95%空气,温度为37 ℃).采用细胞计数试剂盒8(CCK-8)法测定BZ对细胞活力的影响.取对数期的HepG2细胞,铺于96孔板(5000个/孔).12 h后,用不同浓度(0、20、50、80、100 μM)的BZ处理细胞并孵化24 h.然后,在每孔中加入CCK-8溶液,继续孵育,每隔一个小时取出96孔板震荡10 s,4 h后用酶标仪(ThermoFisher Multiskan GO)读取450 nm的吸光度.用A/A0× 100%(A0和A分别为对照组和实验组的吸光度)计算细胞存活率.
(3) 活体HepG2细胞成像 成像实验前,将HepG2细胞接种于35 mm玻璃底培养皿中,24 h后,小心去除培养液,在新鲜培养液中与BZ(5 μM)共孵育30 min,温度37 ℃.随后用冷的PBS洗涤细胞三次以除去游离的探针,在37 ℃下用不同浓度的Fe3+(10、30和60 μM)继续孵育30 min.对照组细胞在相同条件下仅与BZ孵育.使用冷的PBS再次洗涤细胞三次,利用激光共聚焦显微镜观察荧光发射通道的发光情况(λex=365 nm).
(4) 探针BZ复合荧光纳米纤维膜的制备及Fe3+检测 将聚甲基丙烯酸甲酯(PMMA, 3.0 g)和探针BZ(1.0 mg)的混合物溶解在7.0 g DMF中.然后在60 ℃搅拌过夜.随后,将清澈的混合溶液装入10 mL的注射器中,由可编程注射泵在高压电源(20 kV)下以恒定的1.0 mL/h的速率泵送.静电纺成的纳米纤维通过真空干燥到恒定重量收集.最后,用Fe3+和其他离子对用BZ复合的纳米纤维膜进行处理.通过共聚焦显微镜记录纳米纤维膜在绿色通道下的荧光成像(λex=365 nm).
2 结果与讨论
2.1 探针BZ对Fe3+的光谱响应
在DMSO/H2O(4∶1,v/v, pH=7.4)中评价了探针BZ对Fe3+的响应情况.如图2所示,纯探针BZ溶液在300~400 nm之间出现吸收带,对应S0→S1跃迁,其中,357 nm处的主吸收峰可归属于π-π*跃迁.在BZ溶液中加入Fe3+后,溶液颜色发生明显变化,吸收强度明显增强,且伴随着蓝移现象,归因于金属与BZ基态络合物的形成,而不是由Fe3+本身的光谱特性引起的[10].我们还测定了BZ对Fe3+的荧光光谱,在365 nm激发下,纯探针在498 nm处(ΦF=37.8%,荧光素为标准样)具有较强的荧光发射,而加入Fe3+后,荧光快速猝灭,颜色由蓝绿色变为无色,说明探针BZ对Fe3+较高的灵敏性.
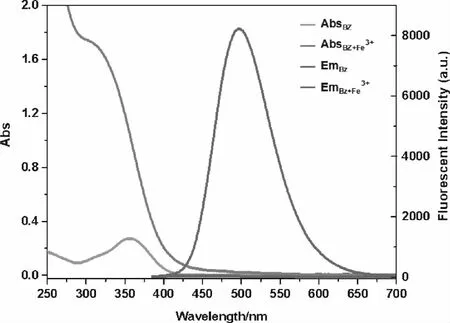
图2 探针BZ(10 μM)加入Fe3+(1 mM)前后的吸收和发射光谱(DMSO/H2O(4∶1,v/v, pH=7.4))
为了进一步验证探针BZ对Fe3+的响应效果,在室温下,进行了荧光滴定实验.如图3a所示,随着Fe3+的逐渐加入,BZ(10 μM)在498 nm处的荧光强度逐渐降低,当加入50.0当量及以上的Fe3+时,荧光信号几乎消失(图3a内嵌图),达到平台期.同时,通过图3b所示的BZ荧光发射强度随Fe3+离子浓度的变化曲线可得到猝灭效率为99.6%.值得注意的是,Fe3+离子浓度在8.3~83 μM范围内具有良好的线性关系(R2=0.9989)(图3b内嵌图),根据IUPAC标准(LOD=3 σ /k)计算出的检测限(LOD)为1.06 × 10-8M,远远低于美国环境保护署(EPA)制定的饮用水推荐水质标准[10].
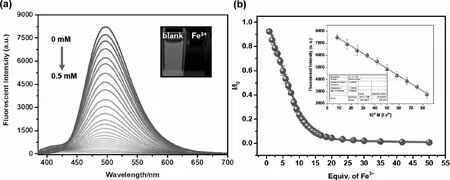
图3 探针BZ(10 μM)加入不同Fe3+浓度(0~0.5 mM)的荧光滴定光谱(a)(内嵌图为365 nm激发下溶液照片)和荧光强度随着Fe3+浓度变化曲线(b)(内嵌图为8.3~83 μM线性图)
2.2 探针BZ对Fe3+的选择性和抗干扰性
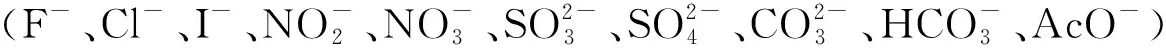

其中所有数据在DMSO/H2O(4∶1,v/v, pH=7.4)中收集.图4 探针BZ(10 μM)对Fe3+(0.5 mM)和其他金属离子或阴离子(1.0 mM)在498 nm处的荧光响应相应365 nm激发抗干扰性实验
2.3 探针BZ与Fe3+的结合模型
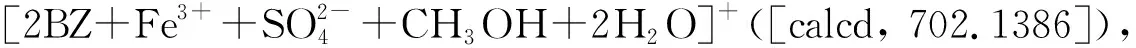
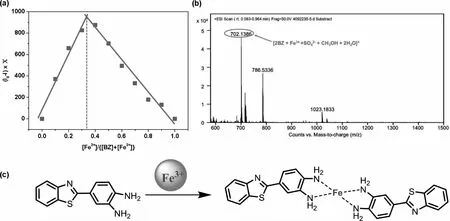
图5 Job’s plot曲线(a);探针BZ与Fe3+结合后的ESI-HRMS质谱(b);探针BZ与Fe3+结合模型图(c)
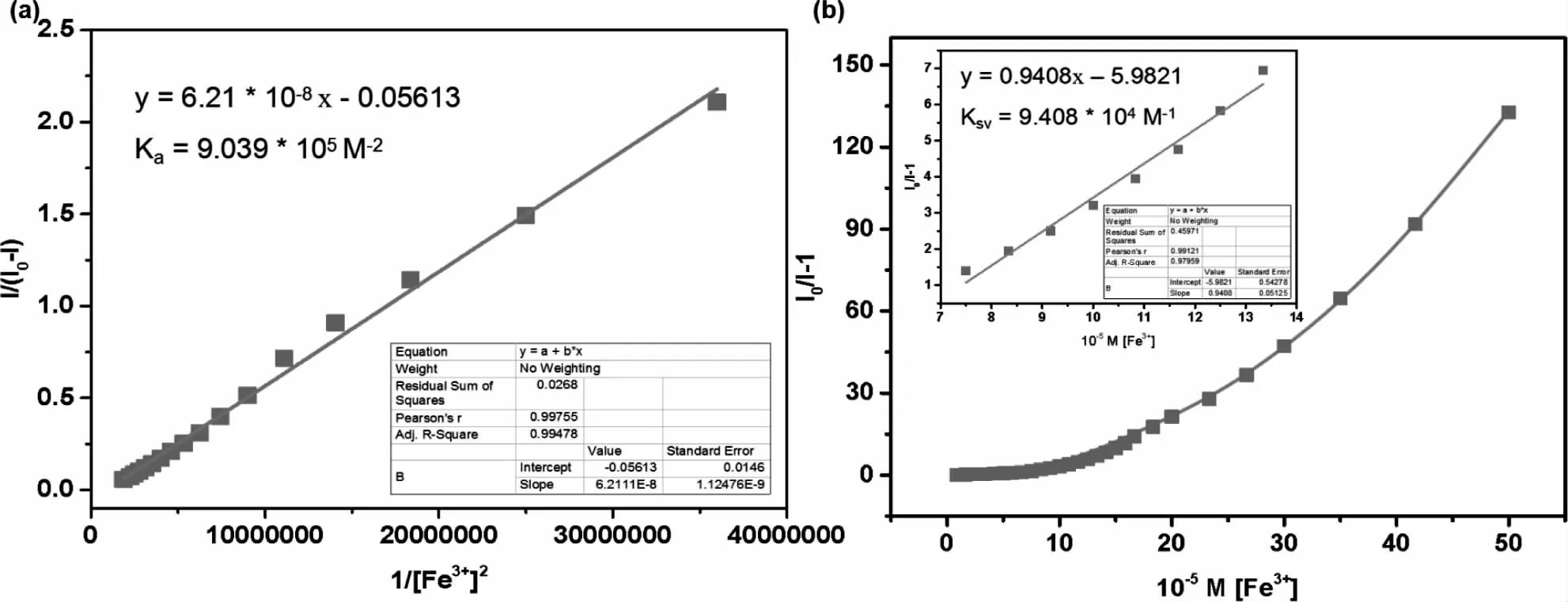
图6 BZ和Fe3+之间化学计量比为2∶1的Benesi-Hildebrand图(a);探针BZ对Fe3+的Stern-Volmer图(b)
2.4 探针BZ对Fe3+的检测pH值相关性
在实际应用中,pH值对荧光探针检测效果可能会产生不可忽视的影响.因此,在不同pH值的DMSO/H2O(4∶1, v/v)体系中,我们测试了探针BZ对Fe3+响应的荧光变化趋势,结果如图7所示.当pH值在3~10时,探针自身是相对稳定的,当加入Fe3+时,BZ发生了显著的荧光猝灭现象,这说明了探针BZ在近似生理条件和生态环境下可以较好的完成Fe3+离子检测.

图7 不同pH值下,BZ(10 μM)在498 nm处的荧光强度变化
2.5 实体水样中探针BZ对Fe3+的检测
为了进一步验证BZ的实际应用,我们选择自来水和巢湖水作为真实水样,分别加入固定浓度的Fe3+(0、0.1、0.2和0.5 mM).参考不同浓度Fe3+处理的校准曲线,获得记录的荧光强度,以确定实际水样中当前的铁离子数量.如表1所示,自来水和巢湖中Fe3+的回收率分别为100.5~104.4和95.6~103.8,且相对标准偏差(Relative Standard Deviation)均小于5%.由此可知,上述合理的数据使BZ具备了对周围环境中Fe3+的定量检测能力.

表1 实体水样中探针BZ对Fe3+的检测分析
2.6 活体细胞中探针BZ对Fe3+的检测
为了验证BZ是否能够检测生物系统中的Fe3+,首先通过建立了不同浓度(0、20、50、80和100 μM)的CCK-8法评估BZ对HepG2细胞活力的影响.如图8所示,浓度为100 μM的BZ处理24 h后,超过80%的HepG2细胞存活.实验结果激励我们进一步评估BZ在共聚焦激光扫描显微镜下检测活细胞中Fe3+的能力(图9).与预期的一样,在37 ℃下,BZ(5 μM)孵育的HepG2细胞在绿色通道中呈现强烈的胞内荧光,并保持良好的细胞形态,这表明探针BZ具有良好的细胞膜通透性.不同浓度Fe3+(10、30、60 μM)孵育30 min后,在相同条件下再用BZ(5 μM)染色30 min,荧光强度有不同程度减弱,甚至接近猝灭.上述结果表明,BZ具有应用于生物体系中检测Fe3+的潜力.
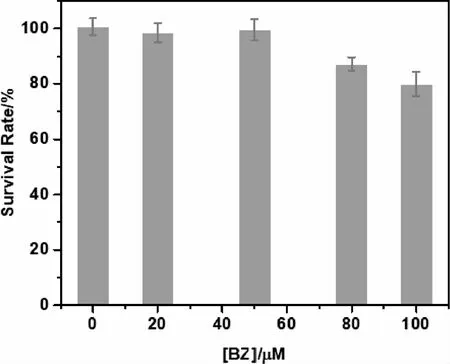
图8 用不同浓度的BZ(0、20、50、80和100 μM)处理24 h后HepG2活细胞百分比

图9 探针BZ(5 μM)及不同浓度(0、10、30和60 μM) Fe3+处理HepG2细胞的共聚焦显微镜图像
2.7 探针BZ复合纳米纤维膜的制备及其对Fe3+的检测
近年来,纳米复合材料、纳米金属-有机骨架、发光纳米颗粒、量子点或金属团簇等荧光纳米探针在探测金属离子方面的应用引起了人们的极大兴趣.然而,这些纳米探针大多需要在其溶液相中进行检测使用成本昂贵和加工过程复杂.相比之下,像薄膜材料这样的固态探针由于其易于操作、稳定性高,在实际应用中受到青睐.静电纺丝(ES)纳米纤维薄膜具有三维多孔结构和较大的表面积,有望应用于智能化、超灵敏的传感系统[11,12].因此,我们探索了用低含量BZ复合的静电纺聚甲基丙烯酸甲酯(PMMA)纳米纤维膜检测Fe3+.如图10a所示,复合纳米纤维膜浸泡在0.5 mM的Fe3+溶液中,在365 nm灯下肉眼观察到明显的荧光猝灭.同时,当薄膜浸渍在另外15个金属离子和10个阴离子溶液中时,荧光几乎没有变化.结果表明,BZ复合纳米纤维膜具有良好的检测性能.荧光共聚焦显微镜在绿色通道中记录了复合纳米纤维薄膜的微观结构.通过图10b可以看出,探针BZ和PMMA纳米纤维具有良好的相容性,并具有明亮的发射光.经Fe3+处理后,荧光发生猝灭但膜的形貌保持不变,没有出现严重的裂纹和降解现象,表明该荧光纳米纤维膜可作为一种潜在的便携式的Fe3+的可视化检测工具.
3 结论
综上所述,通过2-氨基苯硫酚与3,4-二氨基苯甲酸的简单缩合反应,制备了基于苯并噻唑的Fe3+荧光探针BZ.正如设想的那样,由于Fe3+的顺磁性,探针BZ以荧光猝灭模式下对Fe3+表现出良好的选择性和灵敏度.通过Job’s plot实验和HR-MS确定BZ的荧光猝灭是由于BZ与Fe3+形成2∶1化合物所致.重要的是,BZ不仅可以监测真实水样中的Fe3+,还实现了在HepG2活细胞中Fe3+的荧光成像.此外,通过静电纺丝将探针BZ加工成复合纳米纤维膜,荧光变化显著,可望作为测定Fe3+的有效工具.

