以糖尿病酮症酸中毒起病的1型糖尿病合并亚临床肢端肥大症一例
瞿朵朵 陆婧 李平 毕艳 朱大龙
患者,男,37岁,因“口干、多饮、多尿伴消瘦1月余”于2021年5月21日就诊于南京大学医学院附属鼓楼医院。患者1月余前无明显诱因出现口干、多饮、多尿伴消瘦,体重下降5 kg,3天前于我科门诊就诊,查糖化血红蛋白9.8%(4.2%~6.0%,括号内为正常参考值范围,以下相同),空腹血糖12.74 mmol/L(3.9~6.1 mmol/L),钾 3.43 mmol/L(3.50~5.50 mmol/L),餐后2 h血糖14.0 mmol/L(3.9~7.8 mmol/L),血酮体6.0 mmol/L(0~0.6 mmol/L),空腹C肽 677 pmol/L(370~1 470 pmol/L),餐后2 h C肽 539 pmol/L(为空腹C肽的5~6倍)。门诊予补液、胰岛素降糖治疗,2021年5月21日为进一步诊治收入我科。患者自发病以来,神志清楚、精神可,无头痛、情绪改变,饮食睡眠尚可,大便正常,小便量多。既往身体健康。个人史、婚育史无特殊。父亲有糖尿病病史,母亲有高血压病史,无垂体瘤家族史。体格检查:BMI 25.4 kg/m2。神清语利,自主体位,视力、视野正常。无皮肤粗糙、手足变大、头颅增大、口唇肥大、牙齿脱落。心肺腹部未见明显异常。双侧足背动脉搏动正常,双足痛、触、温觉正常。初步诊断:1.糖尿病酮症酸中毒(DKA);2.2型糖尿病。入院后辅助检查:血气分析:pH 7.27(7.35~7.45),实际碳酸氢根12.9 mmol/L(21.4~27.3 mmol/L),标准碳酸氢根15.2 mmol/L(21.3~24.8 mmol/L);血常规、肝肾功能、血脂检查结果均正常;电解质:钠134.4 mmol/L(135.0~145.0 mmol/L),钾3.29 mmol/L(3.50~5.50 mmol/L);尿常规:尿葡萄糖(+++),尿酮体(+++);胰岛自身抗体:胰岛细胞抗体弱阳性,抗谷氨酸脱羧酶抗体>2 000 U/ml(0~10 U/ml),抗酪氨酸磷酸酶抗体、抗胰岛素抗体均为阴性;肾上腺皮质轴及性腺轴均无异常;生长激素(GH)3.53 μg/L(0~3.00 μg/L);类胰岛素生长因子-1(IGF-1)579 ng/ml(109~284 ng/ml);甲状腺轴:促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)均正常,游离甲状腺素(FT4)33.8 pmol/L(12.0~22.0 pmol/L),甲状腺球蛋白抗体、抗甲状腺过氧化物酶抗体、促甲状腺素受体抗体(TRAB)均为阴性。双侧颈动脉彩色超声、眼底照相、肌电图、骨密度检查结果均正常;甲状腺彩色超声:甲状腺弥漫性病变伴轻度肿大,甲状腺多发囊实性肿块(TI-RADS 3级);腹部彩色超声检查结果未见明显异常。入院后予补液、胰岛素泵降糖、纠正电解质紊乱等对症支持治疗,患者血糖逐渐平稳,血酮体恢复正常,于5月28日行馒头餐糖耐量试验、同步胰岛素+C肽释放试验及同步GH抑制试验,结果示血糖明显升高,胰岛素分泌高峰延迟,GH不能被抑制,见表1。复查甲状腺轴:TSH正常,FT39.27 pmol/L(3.10~6.80 pmol/L),FT442.1 pmol/L,TRAB阴性。完善垂体MRI平扫+增强结果示鞍区可见团片状信号影,边界不清,约1.4 cm×1.0 cm×1.9 cm,强化不均(弱于周围垂体组织),鞍底下陷,鞍隔抬高;垂体柄左偏,视交叉受压上抬,增强后病灶中度不均匀强化,垂体大腺瘤可能性大。见图1。结合患者病史、体格检查及辅助检查结果,1型糖尿病(T1DM)诊断明确,患者GH抑制试验结果示GH不被抑制,甲状腺功能结果示FT3、FT4水平升高,TSH水平无下降,垂体MRI结果示垂体大腺瘤,最终诊断T1DM合并亚临床肢端肥大症、垂体大腺瘤、垂体性甲状腺功能亢进症?建议外科手术治疗,术后复查相关激素水平。后患者至外院行神经外科手术,术后病理检查结果:考虑神经内分泌肿瘤,待免疫组化进一步补充,见图2。免疫组化结果:肿瘤细胞Ki67(3%+),Syn(+),CgA(+),CD56(+),CD99(+),H3K27me3(+),SSTR2(+),结合病理结果,符合垂体腺瘤。术后20余天至我院门诊就诊,查GH及IGF-1均正常。胰岛功能:空腹血糖、餐后2 h血糖及空腹C肽均正常,餐后2 h C肽 915 pmol/L,HbA1c正常。甲状腺轴:TSH 0.052 mIU/L(0.270~4.200 mIU/L),FT32.93 pmol/L,FT49.91 pmol/L。肾上腺皮质轴及性腺轴未见明显异常。结合既往甲状腺功能异常,术后暂未予甲状腺激素替代治疗。术后患者无口干、多饮、多尿等不适。
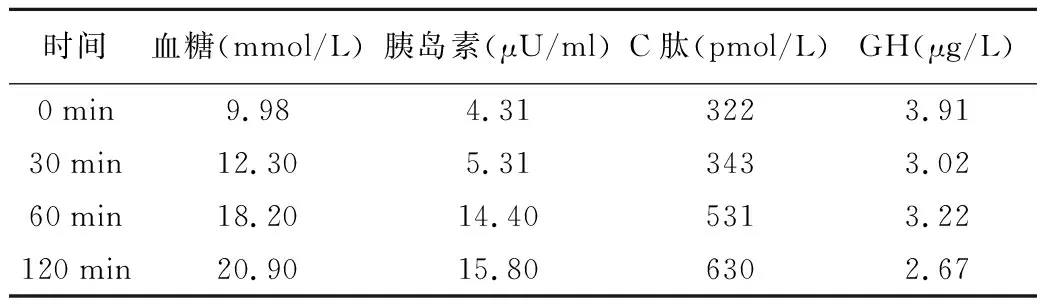
表1 2021年5月28日患者馒头餐糖耐量试验、同步胰岛素+C肽释放试验及GH抑制试验结果
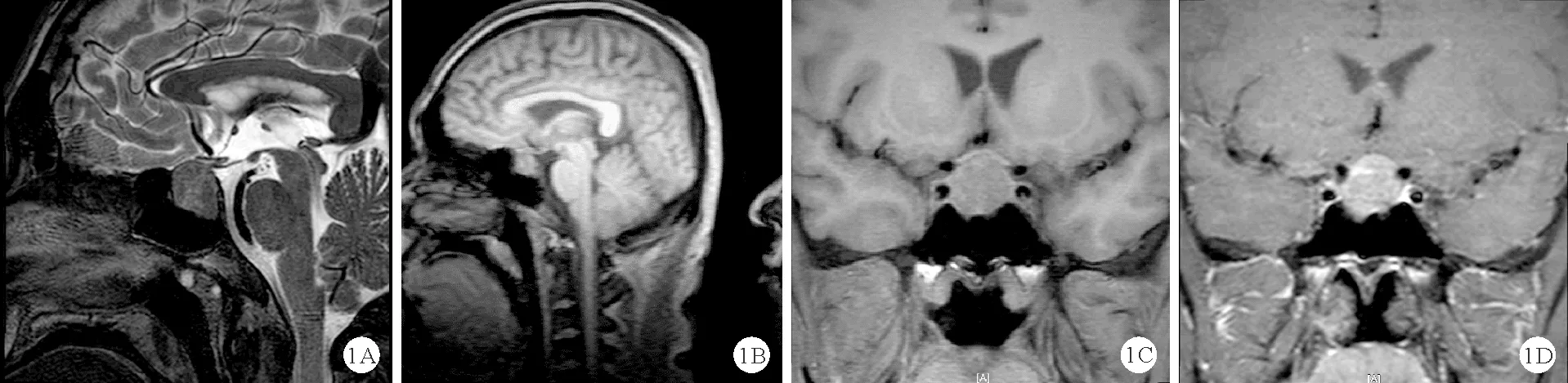
图1 2021年5月28日患者垂体MRI检查结果(A、B:矢状位;C、D:冠状位)
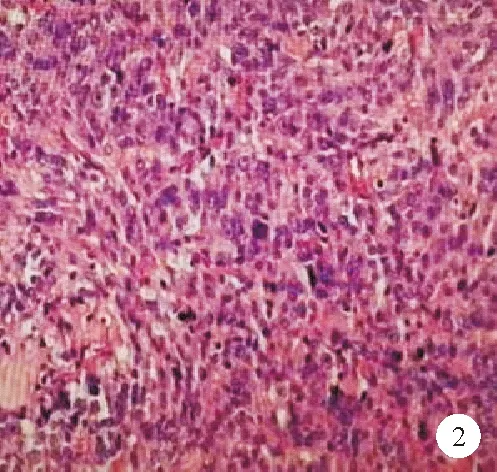
图2 患者垂体瘤术后垂体肿瘤组织病理检查结果[苏木素-伊红(HE)染色,×200]
讨 论
DKA是糖尿病患者最常见的急性并发症,临床表现多样,起病急、症状重,易被诱因所掩盖,特别是部分患者既往无糖尿病病史,易被误诊和漏诊。DKA的诱因主要有感染、胰岛素减量或中断、手术、创伤、妊娠、分娩等[1]。既往认为DKA多见于T1DM,而一项针对因DKA就诊于我国三级医院的多中心调查研究结果显示,643例DKA患者中,T1DM占47.9%,2型糖尿病占45.7%,其余6.4%为非典型糖尿病[2]。此外,甲状腺功能亢进症[3]、肢端肥大症[4]、类固醇糖尿病[5]等继发性糖尿病均可导致DKA。DKA起病时患者胰岛功能一般较差,为高糖毒性所致,故DKA纠正后需复查胰岛功能,有助于分型诊断。
肢端肥大症是由于GH持久过度分泌所引起的内分泌代谢疾病,长期过度分泌的GH可使软组织、骨和软骨过度增生,造成手足粗大和肢端肥大症特征性外貌改变,并可造成糖尿病、垂体瘤占位效应[6]。15%~38%的肢端肥大症患者由于GH分泌增加导致胰岛素抵抗,从而导致糖尿病[7]。但肢端肥大症合并T1DM非常罕见,且诊断较为困难。T1DM患者多出现GH/IGF-1轴紊乱,特别是伴有血糖控制不佳的T1DM患者可能出现血清GH明显升高,但一般不出现肢端肥大,因为血清IGF-1正常或偏低[7]。肝细胞GH受体的表达需要门静脉高水平的胰岛素,GH分泌异常的原因可能是T1DM患者门静脉胰岛素水平很低,进而导致肝细胞上GH受体表达不足,从而出现“肝GH抵抗”状态[7]。T1DM患者的血清GH水平还与年龄有关,随着年龄的增长而显著降低[8]。GH抑制试验可能无法将这些血糖控制不佳的T1DM患者的血清GH水平抑制到正常水平,因此需要进行其他检查才能诊断肢端肥大症。本例患者GH抑制试验结果示GH不能被抑制,血清IGF-1水平升高,垂体MRI提示垂体大腺瘤,均支持T1DM合并亚临床肢端肥大症的诊断。
既往研究结果显示,肢端肥大症患者糖代谢异常的风险较普通人群显著升高,其更高的血清GH水平易造成胰岛β细胞功能代偿性耗竭,进而导致血糖升高[9]。T1DM患者残存胰岛β细胞较少,胰岛功能较差,当合并肢端肥大症时,可能会加快胰岛功能衰竭,同时会出现胰岛素抵抗,导致患者血糖难以控制。因此,T1DM合并肢端肥大症患者除补充体内缺乏的胰岛素外,还需控制高GH。肢端肥大症涉及多个学科和领域,易延误诊断和治疗,从而造成患者的并发症和死亡率增加。其治疗需由多学科专家依据患者情况,权衡利弊制定个体化的治疗方案,治疗方法主要包括手术治疗、放射治疗和药物治疗。本例患者为垂体大腺瘤,垂体MRI示视交叉受压,手术切除肿瘤是首选方法,术后初始缓解率为40%~50%。手术成功后可立即降低血清GH水平,缓解肿瘤压迫,但仍需长期的随访。药物治疗和放射治疗为术后未能完全缓解的辅助治疗。
目前国内外关于T1DM合并肢端肥大症的报道较少,国外仅有两篇个案,国内尚未见报道。综上,T1DM合并肢端肥大症极为罕见,且诊断较为困难,血糖难以控制,对患者危害极大,需早发现、早诊断、早治疗。

