肠神经胶质细胞源性神经营养因子对肠T淋巴细胞的影响及其在葡聚糖硫酸钠诱导的小鼠结肠炎中的作用
罗桢弋 曾启山 罗旭娟 甘华田
炎症性肠病(IBD)是一种病因未明的慢性非特异性肠道炎症性疾病,其发病机制尚未阐明,治疗上缺乏特异有效药物[1-2]。大量研究结果已证实肠道神经系统与肠道免疫系统形成的肠道神经免疫网络在IBD发生发展中的作用。神经胶质细胞(EGCs)作为肠道神经系统的重要组成部分,近期研究发现,除具有营养支持神经元的作用外,还广泛参与IBD的发生发展过程[3];T淋巴细胞(简称T细胞)是肠道免疫系统中最重要的效应细胞之一,其在IBD发病机制中的重要免疫作用也已得到公认[4]。其中Foxp3+调节性T淋巴细胞(Foxp3+Treg)为主要的免疫抑制细胞,Foxp3+为其特异性标志物[5]。因此,研究EGCs与T细胞之间的关系对于揭示IBD的发病本质意义重大。本研究将探讨肠EGCs分泌的胶质细胞源性神经营养因子(GDNF)对T细胞的影响及其在葡聚糖硫酸钠(DSS)诱导的结肠炎中的作用。
材料与方法
1.材料:SPF级C57BL/6雄性小鼠购自成都达硕生物科技有限公司,CD4磁珠购自Miltenyi Biotec公司,EGCs及人脐静脉内皮细胞(HUVECs)均购自iCell bioscience公司,Transwell小室购自Corning公司,GDNF购自PeproTech公司,anti-GDNF、GFR-α1、RET、DAPI抗体均购自Abcam公司,anti-GAPDH、CD4抗体、Foxp3抗体均购自BD Pharmingen公司,DSS购自JK Scientific公司,苏木素-伊红(HE)染色试剂盒、488荧光素、肿瘤坏死因子(TNF)-α、IL-10 ELISA kit均购自北京中杉金桥生物技术有限公司。
2.方法:
(1)小鼠脾脏原代T细胞提取:取4只6~8周龄C57BL/6雄性小鼠,全麻后取小鼠脾脏制成单细胞悬液,按照磁珠分选说明书进行CD4+T细胞分选,用流式分析仪检测CD4+T细胞纯度,用于后续细胞实验。
(2)蛋白印迹法(Western Blot)及细胞免疫荧光检测:以甘油醛-3-磷酸脱氢酶(GAPDH,1∶5 000)作为内参,HUVECs为阳性对照,二抗稀释倍数为1∶10 000。提取(1)中小鼠脾脏原代T细胞蛋白,检测GFR-α1、RET的表达水平。取T细胞进行488荧光免疫染色标记,观察RET表达情况。
(3)细胞实验:将(1)中提取的小鼠脾脏原代T细胞及EGCs采用随机数字表法分为T细胞1组、T+EGCs组及T+EGC+anti-GDNF组。取5×105个T细胞,种于Transwell上室,下室种5×105个EGCs,参照说明书在下室加入20 μg/ml的anti-GDNF抗体。培养72 h后,取各组中T细胞,孵育CD4流式抗体及Foxp3+Treg特异性抗体Foxp3,采用流式分析仪分析Foxp3+Treg比例;收集各组细胞的上清液,根据ELISA试剂盒说明书检测各组细胞上清液中的IL-10水平。然后采用100 ng/ml的GDNF蛋白直接干预T细胞,剂量参考预实验结果及既往文献[6],再将其随机分为T细胞2组和T+GDNF组,检测Foxp3+Treg比例及IL-10水平。
(4)动物实验:将18只C57BL/6雄性小鼠采用随机数字表法分为对照组、DSS组、DSS+GDNF组,每组各6只。对照组连续7日饮用实验室提供的无菌饮用水,同时DSS组与DSS+GDNF组连续7日饮用2.5%DSS,之后DSS+GDNF组再连续7日腹腔注射GDNF 5 μg/kg[6]。从造模第1日开始记录3组小鼠体重、大便性状、 便血情况进行疾病活动指数(DAI)评分,取小鼠结肠组织进行HE染色,在电镜下观察肠道炎症反应(包括肠道组织上皮坏死、脱落,腺体变形,黏膜水肿等情况)[6]。采用流式分析仪检测小鼠肠系膜淋巴结中Foxp3+Treg比例,采用ELISA检测小鼠结肠组织中IL-10、TNF-α水平。

结 果
1.小鼠脾脏原代T细胞磁珠分选结果:经磁珠分选纯化后,小鼠脾脏原代CD4+T淋巴细胞纯度>95%,满足后续实验要求。
2.小鼠脾脏原代T细胞GDNF受体(GFR-α1/RET)表达情况:Western Blot结果提示小鼠脾脏原代T细胞存在GDNF受体(GFR-α1/RET)表达。见图1。免疫荧光染色结果显示RET受体在T细胞胞膜与胞浆中均有表达。见图2。
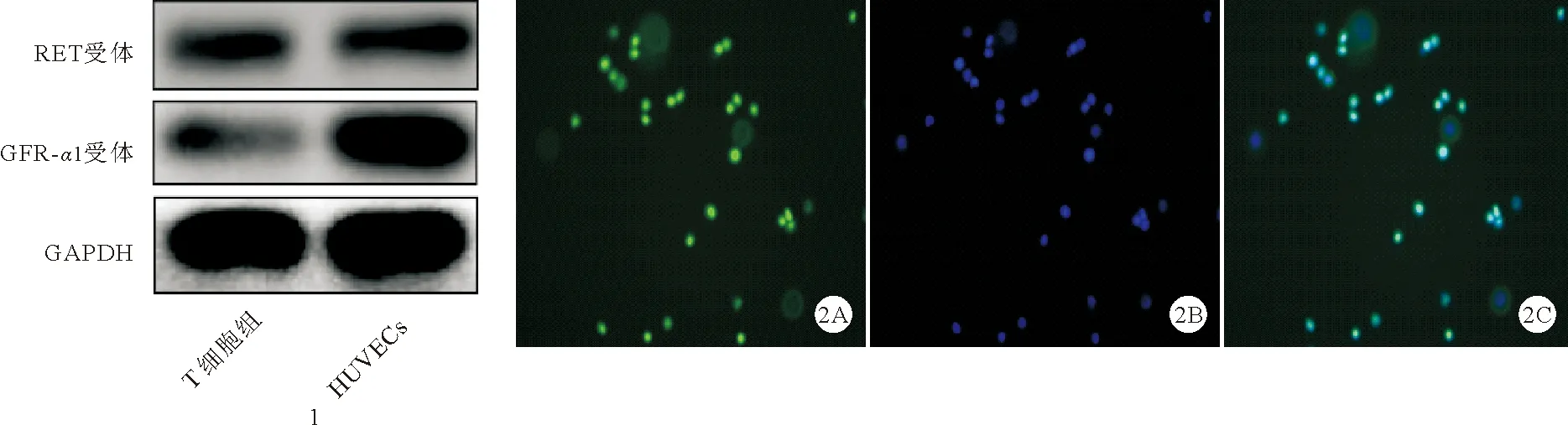
图1 Western Blot验证T细胞表达GDNF受体 图2 免疫荧光染色结果显示T细胞胞膜及胞浆均有RET受体表达(A:RET受体;B:细胞核DAPI;C:Merge,为两者重合;×20)
3.3组T细胞中Foxp3+Treg比例及IL-10水平比较:T+EGCs组中Foxp3+Treg比例及IL-10水平均显著高于T细胞1组和T+EGCs+anti-GDNF组(P<0.05)。见表1。

表1 3组T细胞中Foxp3+Treg比例及IL-10水平比较
4.T细胞2组与T+GDNF组Foxp3+Treg比例及IL-10水平比较:T+GDNF组中Foxp3+Treg比例及IL-10水平均明显高于T细胞2组[(16.28±3.58)%比(4.13±3.29)%,(129.12±23.65)pg/ml比(80.93±20.39)pg/ml,P<0.05)。
5.3组小鼠结肠组织HE染色结果:对照组小鼠的结肠上皮完整,腺体排列整齐,未见炎性细胞浸润;DSS组小鼠的结肠上皮坏死、脱落,腺体变形,黏膜下层明显水肿,黏膜层及黏膜下层可见炎性细胞浸润;DSS+GDNF组小鼠结肠上皮坏死、脱落好转,黏膜下层炎性细胞浸润减少。见图3。

图3 3组小鼠结肠组织HE染色结果(A:对照组;B:DSS组;C:DSS+GDNF组;×20)
6.3组小鼠DAI、组织学评分、IL-10、TNF-α水平及Foxp3+Treg比例比较:DSS组小鼠DAI、组织学评分及TNF-α水平均高于对照组,IL-10水平低于对照组(P<0.05)。DSS+GDNF组小鼠DAI、组织学评分及TNF-α水平均低于DSS组,IL-10水平及Foxp3+Treg比例均高于DSS组(P<0.05)。DSS+GDNF组小鼠IL-10、TNF-α水平及Foxp3+Treg比例均高于对照组(P<0.05)。见表2。

表2 3组小鼠DAI及组织学评分、IL-10及TNF-α水平、Foxp3+Treg比例比较
讨 论
目前,大量探讨T细胞在IBD发生发展中作用的研究大多是孤立地研究T细胞的作用,而忽略肠道神经系统对T细胞的影响。本研究将肠道神经系统中重要成员EGCs与T细胞联系起来,探讨EGCs对T细胞的影响及其在IBD发生发展中的作用,结果发现,EGCs及其分泌的GDNF可诱导T细胞向Foxp3+Treg分化并增加IL-10分泌,缓解DSS导致的结肠炎炎症。众所周知,Foxp3+Treg是由CD4+T细胞分化而来的具有免疫抑制功能的淋巴细胞,分为自然调节性T细胞(nTreg)和诱导性调节性T细胞(iTreg)。Foxp3是目前公认的Foxp3+Treg的特异性标志,后者主要通过分泌免疫抑制性细胞因子[如转化生长因子(TGF)-β和IL-10]以介导免疫调节和免疫耐受[7]。Foxp3+Treg的免疫抑制功能在IBD发生发展中的作用也受到了广泛关注,Zhou等[8]发现使用肠双歧杆菌可诱导Foxp3+Treg的产生,从而减轻IBD小鼠模型的肠上皮损伤。这些研究结果均表明,Foxp3+Treg具有负性免疫调节作用,可上调Foxp3+Treg数量和比例从而起到抑制免疫反应、减轻炎症的作用。本研究结果发现,GDNF可诱导T细胞分化为Foxp3+Treg,提高Foxp3+Treg比例,增加IL-10分泌,进而缓解DSS诱导的结肠炎小鼠的肠道炎症,推测这一抗炎作用的产生与Foxp3+Treg使IL-10水平升高有关。IL-10可抑制黏附分子及促炎症因子的释放,抑制巨噬细胞的免疫功能,在人体的免疫介导中发挥重要作用。Schreiber等[9]研究发现,给予克罗恩病患者8 μg/kg IL-10,可明显缓解其肠道炎症,还能缓解IBD患者肠道炎症并改善其预后。
GDNF主要作用于T细胞,但前提条件是T细胞上存在GDNF受体。本研究发现T细胞存在GDNF受体(GFR-α1/RET)。GDNF受体是由GFR-α1和RET两个受体亚基构成的复合物,其中GFR-α1为膜受体,在细胞膜上表达,RET为跨膜受体,在细胞膜与细胞浆中均有表达[10]。
本研究的另一个重要发现是EGCs对T细胞的影响通过其分泌的神经营养因子GDNF来实现。GDNF是EGCs分泌的重要的神经营养因子,近年来研究发现,GDNF除具有营养肠神经元的作用外,还参与调节肠道免疫反应[11]。鉴于小鼠脾脏原代T细胞,提纯后细胞纯度及活性均高于肠道淋巴细胞,更符合细胞实验要求,故本研究采用脾脏T细胞进行细胞实验,采用肠道淋巴T细胞进行动物实验。同时本研究发现EGCs与T细胞共同培养时,EGCs可诱导T细胞向Foxp3+Treg分化,显著提高其在T细胞中的比例。当用anti-GDNF阻断GDNF的作用后,EGCs促进T细胞向Foxp3+Treg分化的作用明显减弱,提示GDNF可能是EGCs诱导T细胞向Foxp3+Treg分化的关键因子。GDNF在EGCs促进T细胞向Foxp3+Treg分化中起到重要作用,证实GDNF是EGCs诱导T细胞分化为Foxp3+Treg的关键中间神经递质。
本研究还发现GDNF可抑制小鼠肠道TNF-α分泌。TNF-α是一种主要由巨噬细胞及单核细胞所分泌的促炎性细胞因子,通过促进血小板活化因子释放生成氧自由基、诱导合成一氧化氮(NO)造成肠黏膜屏障的损伤、诱导肠黏膜小血管形成微血栓、破坏肠道微循环等加重肠道损伤和炎症,目前以TNF-α为靶点治疗IBD的药物(如类克)已进入临床并取得良好疗效[12]。本研究结果也发现,使用GDNF后,小鼠肠道TNF-α表达明显降低,DSS小鼠结肠炎症明显缓解,我们认为这可能与GDNF诱导产生Foxp3+Treg,进而分泌大量IL-10,又进一步通过抑制相关mRNA的表达从而抑制巨噬细胞分泌TNF-α有关。
GDNF作为EGCs分泌的重要神经营养因子,可通过诱导T细胞向Foxp3+Treg分化来间接调节肠道免疫反应以减轻肠道炎症。GDNF可能是肠道EGCs与T细胞交叉对话的中介因子,有临床开发的价值。

