阿尔茨海默病患者血清miR-98-5p和miR-142-5p水平变化及其意义
何霞,卫仙洪,李佳,李玲,王建
1 雅安市人民医院检验科,四川雅安 625000;2 雅安市人民医院神经内科
阿尔茨海默病(AD)是一种以进行性认知功能障碍和行为损害为特征的神经退行性疾病,是导致老年人失能的重要原因[1]。大多数学者认为,脑内大量β 淀粉样蛋白(Aβ)沉积使小胶质细胞活化从而引起慢性神经炎症,可能是AD发病的重要病理生理机制[2]。因此,抑制神经炎症有可能成为防治AD的一个新途径。微小RNA(miRNA)是一类非编码RNA 分子,在生物体中可参与转录后的基因表达调控。近年研究表明,miRNA 在AD 的发生、发展中发挥重要作用[3]。miR-98-5p、miR-142-5p 是新近发现的miRNA分子。有研究报道,miR-98-5p在缺血性脑卒中患者脑组织中异常富集,并与神经炎症密切相关[4];而miR-142-5p与多发性硬化症患者神经炎症密切相关[5]。有研究通过分析AD 患者血液中miRNA表达谱发现,AD 患者血液中miR-98-5p、miR-142-5p水平显著升高[6-7]。本研究探讨了AD 患者血清miR-98-5p、miR-142-5p 水平变化及其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选择2020年1月—2022年1月雅安市人民医院收治的AD 患者103 例(观察组)。AD诊断依据《2018 中国痴呆与认知障碍诊治指南(二):阿尔茨海默病诊治指南》[8]。纳入标准:①符合AD 诊断标准;②初诊,入院前未接受任何AD 相关的治疗;③临床资料完整。排除标准:①近3个月内有急慢性感染者;②有攻击行为或自杀倾向者;③合并心、肝、肾等重要脏器严重功能不全者;④合并免疫系统或造血系统损害者;⑤合并颅脑损伤导致的认知功能障碍者;⑥合并严重躯体疾病或精神疾病者。其中,男63 例、女40 例,年龄53~87(66.54 ±5.87)岁,BMI 18.7~28.3(22.54 ± 1.98)kg/m2,文化程度:高中及以上49 例、初中及以下54 例。同期另选体检健康的志愿者50 例(对照组),男31 例、女19 例,年龄32~82(65.18 ± 5.52)岁,BMI 19.7~27.4(22.18 ± 1.55)kg/m2,文化程度:高中及以上24 例、初中及以下26 例。两组性别、年龄、BMI、文化程度具有可比性。本研究经雅安市人民医院伦理委员会批准(审批文号:AW2214),所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 血清miR-98-5p、miR-142-5p 检测 观察组入院次日,对照组体检当日,采集空腹外周静脉血3 mL,3 000 r/min离心15 min、离心半径10 cm,取上层血清,-80 ℃冰箱保存。采用TRIzol 法提取血清总RNA,经微量分光光度计鉴定,提取的总RNA 纯度和浓度合格。按逆转录试剂盒说明将总RNA 逆转录为cDNA。逆转录条件:42 ℃ 1 h,95 ℃ 5 min。以cDNA 为模板,按SYBR®Premix Ex TaqTM试剂盒说明进行PCR 扩增。所有引物序列由新贝(上海)生物科技有限公司设计合成。miR-98-5p 上游引物5'-TGAGGTAGTAGTTTGTGCTGTT-3'、下游引物5'-GCGAGCACAGAATTAATACGAC-3',miR-142-5p上游引物5'-AACCAAGACGCTCATGAAGAAG-3'、下游引物5'-CTGCGAGTAGGACATGCTGTAG-3',内参U6 上游引物5'-TGCACCACCAACTGCTTAGC-3'、下游引物5'-GGCATGGACTGTGGTCATGAG-3'。PCR反应体系共20 μL:SYBR®Premix Ex Taq 10 μL,上下游引物各0.8 μL,cDNA 模板2 μL、50×ROX Ref⁃erence Dye 0.4 μL,RNase Free H2O 6 μL;反应条件:95 ℃ 90 s,95 ℃ 30 s、63 ℃ 30 s、72 ℃ 15 s 共40 个循环。PCR扩增反应结束,绘制熔解曲线,收集循环阈值(CT)数。以U6 为内参,采用2-ΔΔCT法计算血清miR-98-5p、miR-142-5p水平。
1.3 血清Aβ1-40、Aβ1-42检测 观察组入院次日、对照组体检当日,采集空腹外周静脉血3 mL,3 000 r/min离心15 min、离心半径10 cm,取上层血清,-80 ℃冰箱保存。采用ELISA 法检测血清Aβ1-40、Aβ1-42。试剂盒购自优利科(上海)生命科学有限公司。所有操作严格按试剂盒说明进行。
1.4 认知功能评估 观察组入院次日,对照组体检当日,采用简易精神状态检查量表(MMSE)评分评估认知功能。MMSE 包括6 个维度30 个条目,总分0~30分。MMSE评分越高,认知功能越好。
1.5 统计学方法 采用SPSS28.0 统计软件。正态分布的计量资料以±s表示,结果比较采用独立样本t检验;偏态分布的计量资料以M(P25,P75)表示,结果比较采用U检验。计数资料比较采用χ2检验。相关性分析采用Pearson 或Spearman 相关分析法。诊断效能分析采用受试者工作特征(ROC)曲线,曲线下面积(AUC)比较采用Hanley & McNeil 检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清miR-98-5p、miR-142-5p水平比较 见表1。

表1 两组血清miR-98-5p、miR-142-5p水平比较
2.2 两组血清Aβ1-40、Aβ1-42 水平和MMSE 评分比较 见表2。

表2 两组血清Aβ1-40、Aβ1-42水平和MMSE评分比较
2.3 AD 患者血清miR-98-5p、miR-142-5p水平与血清β1-40、Aβ1-42水平和MMSE评分的关系 Pearson/Spearman 相关分析显示,AD 患者血清miR-98-5p 水平与血清Aβ1-40 水平呈正相关关系(r=0.594,P<0.05),与血清Aβ1-42 水平和MMSE 评分均呈负相关关系(r分别为-0.517、-0.618,P均<0.05);血清miR-142-5p 水平与血清Aβ1-40 水平呈正相关关系(r=0.562,P<0.05),与血清Aβ1-42 水平和MMSE 评分均呈负相关关系(r分别为-0.574、-0.624,P均<0.05)。
2.4 血清miR-98-5p、miR-142-5p水平对AD的诊断价值 ROC 曲线分析显示,血清miR-98-5p 水平诊断AD 的AUC为0.782(95%CI:0.709~0.845),其最佳截断值为1.36,此时其诊断AD 的灵敏度为61.17%、特异度为94.00%;血清miR-142-5p水平诊断AD 的AUC为0.791(95%CI:0.718~0.852),其最佳截断值为2.23,此时其诊断AD 的灵敏度为61.17%、特异度为92.00%;血清miR-98-5p、miR-142-5p 水平联合诊断AD 的AUC为0.887(95%CI:0.826~0.932),其诊断AD的灵敏度为77.67%、特异度为92.00%。血清miR-98-5p、miR-142-5p水平联合诊断AD的AUC大于血清miR-98-5p、miR-142-5p水平单独(Z分别为3.409、3.661,P均<0.05)。见图1。
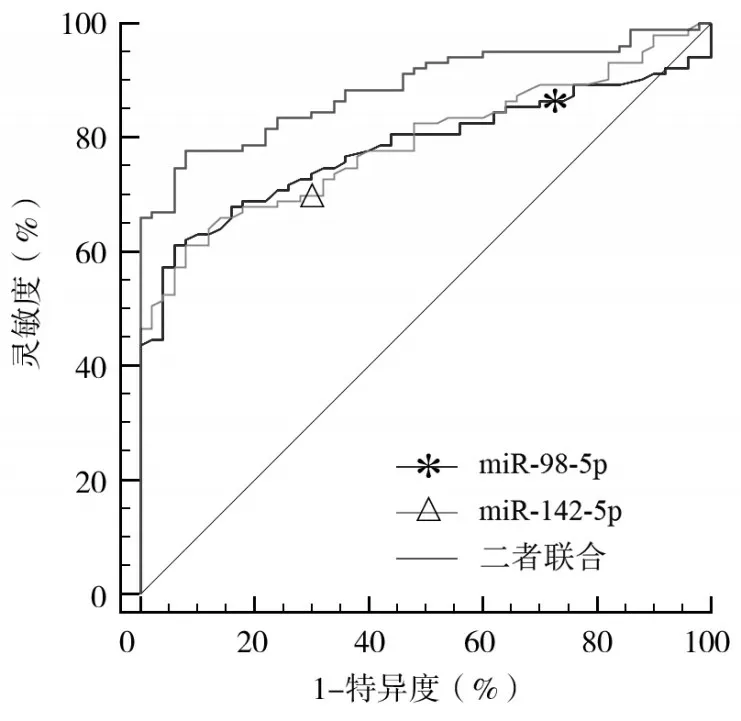
图1 血清miR-98-5p、miR-142-5p水平诊断AD的ROC曲线
3 讨论
AD是老年人最常见的一种痴呆类型。据调查,2020年我国60岁以上人群中痴呆患者约有1 507万例,其中AD 患者983 万例[9]。尽管近年来全球研发出了多种AD 治疗药物,但迄今为止仍无特效药物能够延缓AD 病情进展,故早发现、早干预至关重要。在临床上,AD的诊断较为复杂,包括病史采集、体格检查、神经心理评估、影像学检查等。但《2020中国阿尔茨海默病患者诊疗现状调研报告》指出,我国55.83% AD患者在出现症状7个月以上才得以确诊[10]。因此,亟需寻找新的早期诊断手段。
AD最主要的病理特征为Aβ沉积引起的神经炎症、突触丢失或功能障碍、氧化应激、神经原纤维缠结等。其中,Aβ 沉积引起的小胶质细胞、星形胶质细胞、神经元等炎症反应可能是AD 发病的重要病理生理机制[2]。Aβ是含有39~43个氨基酸的多肽。人体内Aβ 常见的亚型为Aβ1-40、Aβ1-42。有研究报道,血液中Aβ1-40 水平降低和Aβ1-42 水平升高能够反映AD 患者脑内Aβ 沉积情况[11]。本研究结果显示,观察组血清Aβ1-40 水平降低、血清Aβ1-42水平升高,符合AD患者Aβ沉积这一病理变化。
miRNA 是一类非编码RNA 分子,在生物体中可参与转录后的基因表达调控。近年研究表明,miRNA在AD 的发生、发展中发挥重要作用[3]。miR-98-5p、miR-142-5p 是新近发现的miRNA 分子。miR-98-5p基因定位于人染色体Xp11.22。ZHENG 等[12]研究报道,miR-98-5p 能够靶向调控Toll 样受体4/NF-κB信号通路参与内皮细胞炎症。巫兴阳等[13]研究报道,miR-98-5p与脓毒症全身炎症反应激活有关。结果表明,miR-98-5p 是一个与炎症反应密切相关的miRNA。ZHOU 等[4]研究报道,miR-98-5p 在缺血性脑卒中患者脑组织中异常富集,并与神经炎症密切相关。miR-142-5p基因定位于人17号染色体。既往研究报道,miR-142-5p是一个与肿瘤相关的miRNA。近年研究发现,miR-142-5p 还能参与炎症反应。XU等[14]研究报道,miR-142-5p 能够靶向细胞因子信号抑制剂1 激活NF-κB 信号通路,促进肝脏炎症反应。在帕金森病模型中,抑制miR-142-5p能够抑制NF-κB信号通路激活,进而抑制神经元炎症[15]。结果表明,miR-142-5p也是一个与炎症反应密切相关的miRNA,能够参与神经炎症反应。
本研究结果发现,观察组血清miR-98-5p、miR-142-5p 水平显著高于对照组,与以往研究[6-7]报道一致。进一步分析发现,AD患者血清miR-98-5p、miR-142-5p水平与血清Aβ1-40水平均呈正相关关系,与血清Aβ1-42水平均呈负相关关系。提示AD患者血清miR-98-5p、miR-142-5p 水平升高可能与脑内Aβ沉积有关,其机制可能与miR-98-5p 能够抑制分选连接蛋白6表达和miR-142-5p能够抑制非受体型蛋白酪氨酸磷酸酶1(PTPN1)有关。分选连接蛋白6可参与调控蛋白质运输,通过调节β 分泌酶的内吞作用,影响淀粉样蛋白前体蛋白的β加工,从而抑制Aβ 沉积[16]。有研究表明,下调miR-98-5p 能够通过上调分选连接蛋白6 抑制Aβ 沉积[17]。PTPN1 是一种蛋白酪氨酸磷酸酶蛋白,能够通过灭活糖原合成酶激酶3抑制Aβ沉积。有研究报道,下调miR-142-5p能够靶向上调PTPN1 抑制AD 大鼠脑内Aβ 沉积和神经炎症[18]。认知功能损害是AD 患者常见的临床表现。MMSE 是临床评估AD 患者认知功能的常用量表[1]。本研究结果发现,观察组MMSE 评分显著低于对照组,提示AD 患者存在明显的认知功能损害。进一步分析发现,AD患者血清miR-98-5p、miR-142-5p水平与MMSE 评分均呈负相关关系。提示血清miR-98-5p、miR-142-5p 水平升高与AD 患者认知功能降低有关,其原因与miR-98-5p、miR-142-5p 能够参与AD患者脑内Aβ沉积有关。
本研究ROC 曲线分析显示,血清miR-98-5p、miR-142-5p 水平单独和联合诊断AD 的AUC分别为0.782、0.791、0.887,血清miR-98-5p、miR-142-5p 水平联合诊断AD 的AUC高于血清miR-98-5p、miR-142-5p水平单独。提示miR-98-5p、miR-142-5p可作为诊断AD 的血清生物标志物,二者联合能够提高其诊断价值。
综上所述,AD 患者血清miR-98-5p、miR-142-5p水平显著升高,其水平升高与Aβ 沉积和认知功能降低密切相关;miR-98-5p、miR-142-5p 有可能成为诊断AD的血清生物标志物。

