Survivin对食管癌细胞Tak1、NF-κB表达调控以及细胞周期和凋亡的影响
沙巴海提·吾斯曼,杨银银,刘志琴,杨啸,李卉,刘玲
1 新疆医科大学基础医学院生物化学与分子生物学教研室,乌鲁木齐 830017;2 新疆地方病分子生物学重点实验室;3 新疆医科大学中心实验室
食管癌是全球第八大常见癌症、第六大癌症相关死亡原因[1]。近十余年来,尽管我国食管癌的发病率总体呈下降趋势,但仍高于全球平均水平,依旧是威胁我国居民健康的主要恶性肿瘤之一[2]。目前,食管癌的病因和发病机制尚不完全清楚。存活蛋白(Survivin)是凋亡抑制蛋白家族中相对分子质量最小的成员,由142个氨基酸组成,在胞质内通常以二聚体形式存在,具有抑制细胞凋亡和调节细胞周期双重功能[3]。转化生长因子β 激活激酶1(Tak1)是一种丝氨酸/苏氨酸激酶,属于丝裂原活化蛋白激酶激酶激酶家族,可通过激活丝裂原活化蛋白激酶(MAPK)、核因子κB(NF-κB)信号通路诱导炎症反应[4-5]。有研究报道,哈萨克族食管癌患者肿瘤组织Survivin 高表达,其高表达可促进肿瘤细胞增殖并抑制其凋亡[6],而Tak1 缺失会抑制MAPK、NF-κB 信号通路[7]。但Survivin 是否通过调控Tak1、NF-κB 表达,进而影响食管癌细胞周期和凋亡尚不清楚。2020年8月—2022年5月,本研究探讨了Survivin对食管癌细胞Tak1、NF-κB表达调控以及细胞周期和凋亡的影响。现报告如下。
1 材料与方法
1.1 材料 人食管癌细胞Eca109,购自中国科学院生物化学与细胞生物学研究所。Survivin 过表达载体及其空载体、Survivin siRNA 载体及其空载体由上海吉凯基因化学技术有限公司构建。Survivin 抑制剂YM155,购自美国Selleck 公司。全波长酶标仪,购自美国Thermo Fisher Scientific 公司;凝胶成像分析系统、凝胶电泳仪及其配套组件,购自美国Bio-Rad 公司;倒置显微镜,购自日本Nikon 公司;全自动流式细胞仪,购自美国BD公司。LipofectamineTM3000,购自美国Invitrogen 公司。细胞周期、细胞凋亡检测试剂盒,购自美国BD公司。Survivin一抗,购自美国Proteintech 公司;磷酸化Tak1(p-Tak1)、NF-κB p65、β-actin 一抗及山羊抗兔或鼠IgG 二抗,购自美国CST公司。
1.2 细胞培养 取冻存的Eca109细胞置于37 ℃水浴中快速解冻,然后接种于含10% FBS 的RPMI 1640培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。待贴壁细胞生长融合80%~90%时,胰蛋白酶消化,按1∶2传代。取传3代、对数生长期、生长状态良好的细胞进行后续实验。
1.3 细胞分组及干预 取传3代、对数生长期、生长状态良好的Eca109 细胞,接种于6 孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养,直至细胞贴壁。当贴壁细胞生长融合50%~60%时,随机分为空白对照组、Survivin-siRNA 组、Survivin-siRNA 空载体组、Survivin 过表达组、Survivin 过表达空载体组、YM155 组。按LipofectamineTM3000 说明,SurvivinsiRNA 组与Survivin-siRNA 空载体组分别转染Survivin siRNA 载体、Survivin siRNA 空载体,Survivin过表达组与Survivin 过表达空载体组分别转染Survivin 过表达载体、Survivin 过表达空载体。空白对照组不予转染,YM155 组加入Survivin 抑制剂YM155。
1.4 Survivin、p-Tak1、NF-κ B p65 表达检测Survivin-siRNA 组、Survivin-siRNA 空载体组、Survivin 过表达组、Survivin 过表达空载体组转染6 h,更换新鲜培养基继续培养24 h 收集细胞,YM155 组和空白对照组同期收集细胞,消化计数,制成细胞悬液并调整细胞密度至5×106个/mL。取各组细胞悬液5 mL,加入含PMSF 和磷酸酶抑制剂的RIPA 裂解液提取细胞总蛋白,经BCA 法蛋白定量合格。加入蛋白上样缓冲液混匀,95 ℃加热变性10 min。取变性蛋白,SDS-PAGE 分离。电泳结束,将蛋白电泳产物转印至PVDF 膜上,5% BSA 或脱脂奶粉封闭,然后分别加Survivin、p-Tak1、NF-κB p65、β-actin 一抗,4 ℃孵育过夜。次日,加入山羊抗兔或鼠IgG 二抗,室温孵育2 h。ECL 发光,暗室内显影、曝光,凝胶成像分析系统扫描,Image J 软件分析各蛋白电泳条带灰度值。以β-actin 为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。
1.5 细胞周期检测 收集各组细胞约1×106个,1 000 r/min离心10 min、离心半径21 cm,弃上清,留取沉淀。向沉淀中加入预冷75%乙醇,4 ℃固定4 h。然后加入RNase 200 μL,37 ℃水浴30 min。再加入PI 染液400 μL,室温避光染色30 min,上流式细胞仪检测。
1.6 细胞凋亡检测 收集各组细胞约1×106个,1 000 r/min 离心10 min、离心半径21 cm,弃上清,留取沉淀。向沉淀中加入1×Binding Buffer 300 μL 重悬,然后依次加入Annexin V-FITC 5 μL、PI染液5 μL,轻轻混匀,室温避光孵育15 min,上流式细胞仪检测。1.7 统计学方法 采用SPSS20.0 统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组Survivin、p-Tak1、NF-κB p65表达比较 见表1。
表1 各组Survivin、p-Tak1、NF-κB p65相对表达量比较(±s)
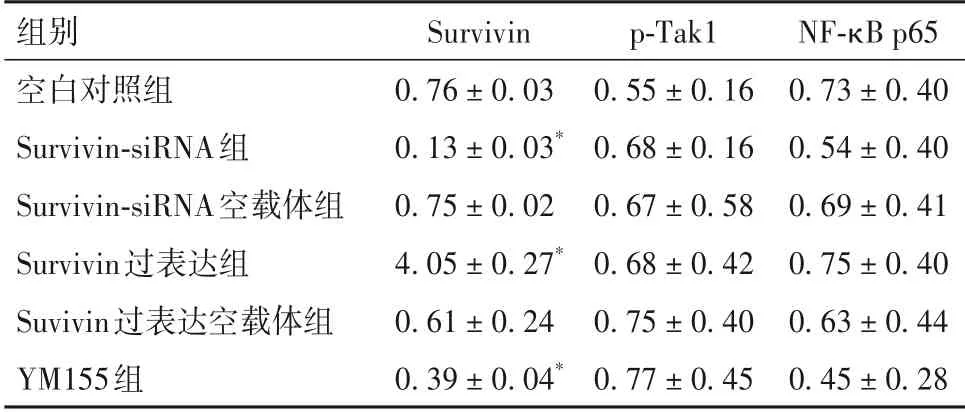
表1 各组Survivin、p-Tak1、NF-κB p65相对表达量比较(±s)
注:与空白对照组比较,*P<0.05。
组别空白对照组Survivin-siRNA组Survivin-siRNA空载体组Survivin过表达组Suvivin过表达空载体组YM155组NF-κB p65 0.73 ± 0.40 0.54 ± 0.40 0.69 ± 0.41 0.75 ± 0.40 0.63 ± 0.44 0.45 ± 0.28 Survivin 0.76 ± 0.03 0.13 ± 0.03*0.75 ± 0.02 4.05 ± 0.27*0.61 ± 0.24 0.39 ± 0.04*p-Tak1 0.55 ± 0.16 0.68 ± 0.16 0.67 ± 0.58 0.68 ± 0.42 0.75 ± 0.40 0.77 ± 0.45
2.2 各组细胞周期分布比较 见表2。
表2 各组细胞周期分布比较(%,±s)
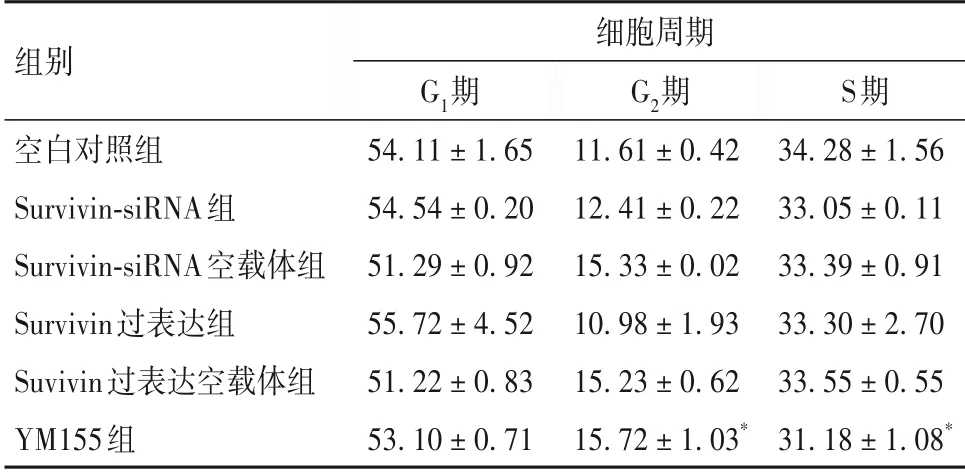
表2 各组细胞周期分布比较(%,±s)
注:与空白对照组比较,*P<0.05。
组别细胞周期S期34.28 ± 1.56 33.05 ± 0.11 33.39 ± 0.91 33.30 ± 2.70 33.55 ± 0.55 31.18 ± 1.08*G1期54.11 ± 1.65 54.54 ± 0.20 51.29 ± 0.92 55.72 ± 4.52 51.22 ± 0.83 53.10 ± 0.71 G2期空白对照组Survivin-siRNA组Survivin-siRNA空载体组Survivin过表达组Suvivin过表达空载体组YM155组11.61 ± 0.42 12.41 ± 0.22 15.33 ± 0.02 10.98 ± 1.93 15.23 ± 0.62 15.72 ± 1.03*
2.3 各组细胞凋亡率比较 见表3。
表3 各组细胞凋亡率比较(%,±s)
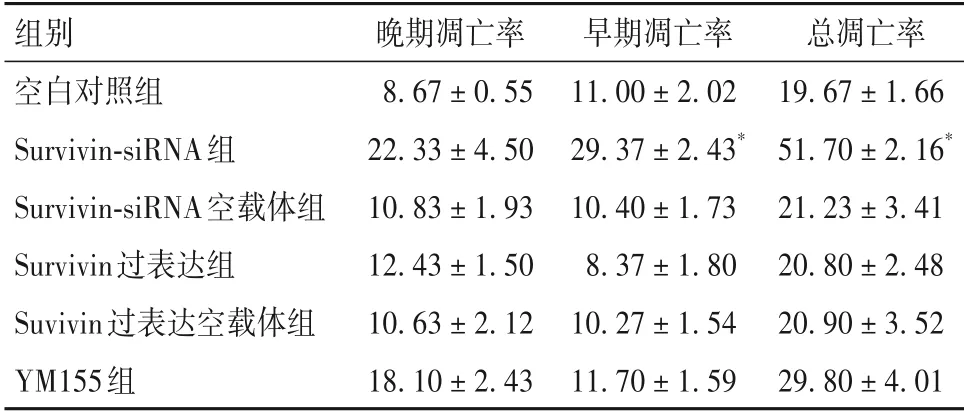
表3 各组细胞凋亡率比较(%,±s)
注:与空白对照组比较,*P<0.05。
组别空白对照组Survivin-siRNA组Survivin-siRNA空载体组Survivin过表达组Suvivin过表达空载体组YM155组总凋亡率19.67 ± 1.66 51.70 ± 2.16*21.23 ± 3.41 20.80 ± 2.48 20.90 ± 3.52 29.80 ± 4.01晚期凋亡率8.67 ± 0.55 22.33 ± 4.50 10.83 ± 1.93 12.43 ± 1.50 10.63 ± 2.12 18.10 ± 2.43早期凋亡率11.00 ± 2.02 29.37 ± 2.43*10.40 ± 1.73 8.37 ± 1.80 10.27 ± 1.54 11.70 ± 1.59
3 讨论
食管癌是世界范围内常见的恶性肿瘤之一,主要病理类型包括鳞癌、腺癌及其他少见类型。在我国90%以上食管癌为鳞癌。目前,食管癌的发病机制仍未完全阐明。近年研究主要集中于食管癌发病的分子机制以及早期预防[8-10]。本课题组前期筛选了食管癌细胞的差异表达基因,并进一步探究了表观遗传学中DNA 甲基化对基因表达调控的影响[11]。Survivin 即是本课题组筛选出来的哈萨克族食管癌患者肿瘤细胞中的高表达基因,但其是否通过调控Tak1、NF-κB表达,进而调控肿瘤细胞周期分布及凋亡尚不清楚。
在恶性肿瘤中凋亡调控系统的分子改变分为三类:第一类为核心抗凋亡基因的上调,第二类为核心促凋亡基因的下调,第三类为参与核心凋亡调控系统的上游信号通路紊乱[12]。Survivin 是凋亡抑制蛋白家族的成员之一,兼有第一、三类凋亡调控系统分子的特征[13]。Survivin在正常组织中几乎不表达,但在肿瘤组织中高表达,并且其高表达与肿瘤恶性程度密切相关。Survivin 有可能是恶性肿瘤早期诊断和预后评估的生物标志物[14]。Tak1 是一种丝氨酸/苏氨酸激酶,可被许多细胞因子、生长因子和微生物及其产物所激活[15]。有研究表明,在肿瘤中条件性敲除Tak1 基因,在某些情况下具有抑制肿瘤作用,Tak1 抑制剂能够抑制NF-κB、p38 MAPK、ERK、STAT3 激活,从而抑制骨髓瘤生长[16]。有研究还发现,敲除Tak1后,食管癌细胞增殖能力增强[17]。结果表明,Tak1 在不同肿瘤中所起的作用不同。NF-κB是一个高度保守的多功能转录因子家族,能够参与机体免疫、炎症反应、细胞分化等相关的基因转录。越来越多研究发现,NF-κB 还可参与肿瘤发生和DNA 修复过程。在许多恶性肿瘤中,NF-κB 以细胞类型特异的方式发挥作用,即激活肿瘤细胞内生存基因和肿瘤微环境中炎症促进基因的表达,可作为肿瘤治疗和预后评估的生物标志物[18]。在许多恶性肿瘤中已检测到NF-κB的异常激活,如结直肠癌、肝细胞癌。在乳腺癌中激活NF-κB 可抵抗细胞凋亡,并与化疗耐药有关,提示NF-κB 有可能是恶性肿瘤治疗的一个潜在靶点。有研究发现,TAB3 通过Tak1-TAB3-TRAF6 复合物的形成激活NF-κB 通路,从而调节Survivin 表达[19]。也有研究报道,靶向Cripto-1/Tak1/NF-κB/Survivin 信号通路可能是对抗恶性肿瘤细胞凋亡抵抗的有效途径[20]。这些研究无疑为探索食管癌的发病机制提供了新的方向。
本课题组前期研究发现,哈萨克族食管癌患者肿瘤组织Survivin 高表达,其高表达可促进肿瘤细胞增殖并抑制其凋亡[6]。但Survivin 是否通过调控Tak1、NF-κB表达,进而影响食管癌细胞周期和凋亡尚不清楚。为进一步探讨食管癌细胞Survivin、Tak1、NF-κB表达的关系,本研究通过过表达Survivin、沉默表达Survivin 以及加入Survivin 抑制剂来观察Eca109 细胞Survivin 表达变化,成功构建了Eca109细胞Survivin 高表达与低表达模型。在此基础上进一步观察了Tak1、NF-κB表达变化,结果发现Survivin表达变化并未引起Tak1、NF-κB 表达变化,提示Survivin可能不直接调控Tak1、NF-κB表达。但Survivin表达变化却能在Eca109 细胞周期分布和凋亡调控方面发挥一定作用。YM155 抑制Survivin 表达后,Eca109 细胞G2期细胞所占比例显著升高,S 期细胞所占比例显著降低,说明抑制Survivin 表达能够抑制食管癌细胞DNA 合成。siRNA 抑制Survivin 表达能够使Eca109 细胞早期凋亡率和总凋亡率显著升高,说明抑制Survivin 表达能够促进食管癌细胞凋亡。以上结果表明,Survivin可参与食管癌细胞周期分布和凋亡调控。
综上所述,Survivin表达能够参与食管癌细胞周期分布和凋亡调控,但其作用途径并非通过调控Tak1、NF-κB表达实现。

