血清MIF、G-CSF水平对早产儿支气管肺发育不良的诊断价值
王晶磊,姬建刚,张勇华,靳丽娜,毕艳旭
临汾市中心医院新生儿科,山西临汾 041000
随着新生儿重症监护技术和围产医学迅速发展,早产儿的存活率越来越高。但由于早产儿各器官或系统在宫内发育不成熟,出生后易发生各种并发症。支气管肺发育不良(BPD)是早产儿常见的并发症之一,可引起早产儿肺功能发育不全、反应性气道疾病、运动发育迟缓和喂养困难,随着时间推移可发展为哮喘、慢性阻塞性肺疾病甚至肺动脉高压[1]。BPD 的发病机制尚不完全清楚。目前普遍认为,宫内感染、机械通气等引起的炎症反应在BPD 发生、发展过程中发挥重要作用[2]。因此,炎症细胞因子有望成为预测早产儿BPD 的潜在生物标志物。巨噬细胞移动抑制因子(MIF)是一种多效性炎症细胞因子,在先天性免疫和适应性免疫中具有上游调节作用。有研究报道,MIF 能够引起肺血管炎症反应和肺动脉重塑[3]。粒细胞集落刺激因子(G-CSF)是一种促炎症细胞因子,可通过促进骨髓造血系统中性粒细胞发育导致气道中性粒细胞增多,诱发呼吸系统炎症反应[4]。鉴于MIF、G-CSF 与呼吸系统疾病密切相关,我们推测二者可能亦与早产儿BPD 存在一定关系。本研究探讨了血清MIF、G-CSF 水平对早产儿BPD的诊断价值。现报告如下。
1 资料与方法
1.1 临床资料 选择2019年1月—2021年10月临汾市中心医院收治的早产儿126 例。纳入标准:①胎龄<32 周和/或出生体质量≤1 500 g;②出生后转入新生儿重症监护室;③住院时间>28 d。排除标准:①合并21-三体综合征、18-三体综合征、13-三体综合征等染色体疾病患儿;②合并免疫系统疾病患儿;③合并甲状腺功能减退、1 型糖尿病等内分泌疾病患儿;④合并其他肺部疾病患儿;⑤中途转院或自动出院患儿。BPD 诊断标准:氧依赖(吸入氧浓度>21%)超过28 d 的新生儿[5]。根据是否发生BPD,将早产儿分为BPD 组35 例和非BPD 组91 例。本研究经临汾市中心医院伦理委员会批准(审批文号:2021-15-1 号),所有早产儿监护人知情同意并签署书面知情同意书。
1.2 血清MIF、G-CSF 检测 所有早产儿入组次日采集清晨空腹外周静脉血3 mL,注入干燥试管,待血液自然凝固后,取上层液,771×g离心15 min,留取上层血清,-80 ℃冰箱保存。采用ELISA 法检测血清MIF、G-CSF。所有操作严格按照仪器操作规程和试剂盒说明进行。
1.3 资料收集分析 收集早产儿胎龄、性别、出生体质量、分娩方式、胎儿宫内生长受限、新生儿窒息、呼吸窘迫、机械通气、氧疗时间、使用肺表面活性剂以及其母亲年龄、孕期吸烟、胎膜早破、宫内感染、妊娠合并症(高血压、糖尿病)等临床资料。比较BPD组与非BPD 组上述临床资料,将有统计学差异的指标纳入多因素Logistic回归模型,分析早产儿BPD的危险因素。
1.4 统计学方法 采用SPSS25.0 统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;两组间比较采用独立样本t检验。计数资料比较采用χ2检验。危险因素分析采用多因素Logistic 回归模型。诊断价值分析采用受试者工作特征(ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清MIF、G-CSF 水平比较 BPD 组与非BPD组血清MIF水平分别为(10.35 ± 2.64)、(4.65 ±1.27)ng/mL,血清G-CSF 水平分别为(80.15 ±20.16)、(46.05 ± 9.12)pg/mL。BPD 组血清MIF、G-CSF 水平均显著高于非BPD 组(t分别为16.325、13.080,P均<0.01)。
2.2 早产儿BPD 的危险因素分析 两组临床资料比较见表1。BPD 组与非BPD 组母亲年龄分别为(29.45 ± 3.26)、(30.11 ± 3.51)岁,孕期吸烟分别为10(28.57%)、9 例(9.89%),妊娠期合并高血压分别为7(20.00%)、16 例(17.58%),妊娠期合并糖尿病分别为11(31.43%)、25例(27.47%),胎膜早破分别为10(28.57%)、18 例(19.78%),宫内感染分别为6(17.14%)、12例(13.19%)。两组母亲孕期吸烟比例比较差异有统计学意义(χ2=6.889,P<0.05),而母亲年龄和妊娠期合并高血压、糖尿病以及胎膜早破、宫内感染比例比较差异均无统计学意义(t/χ2分别为0.964、0.099、0.194、1.130、0.323,P均>0.05)。
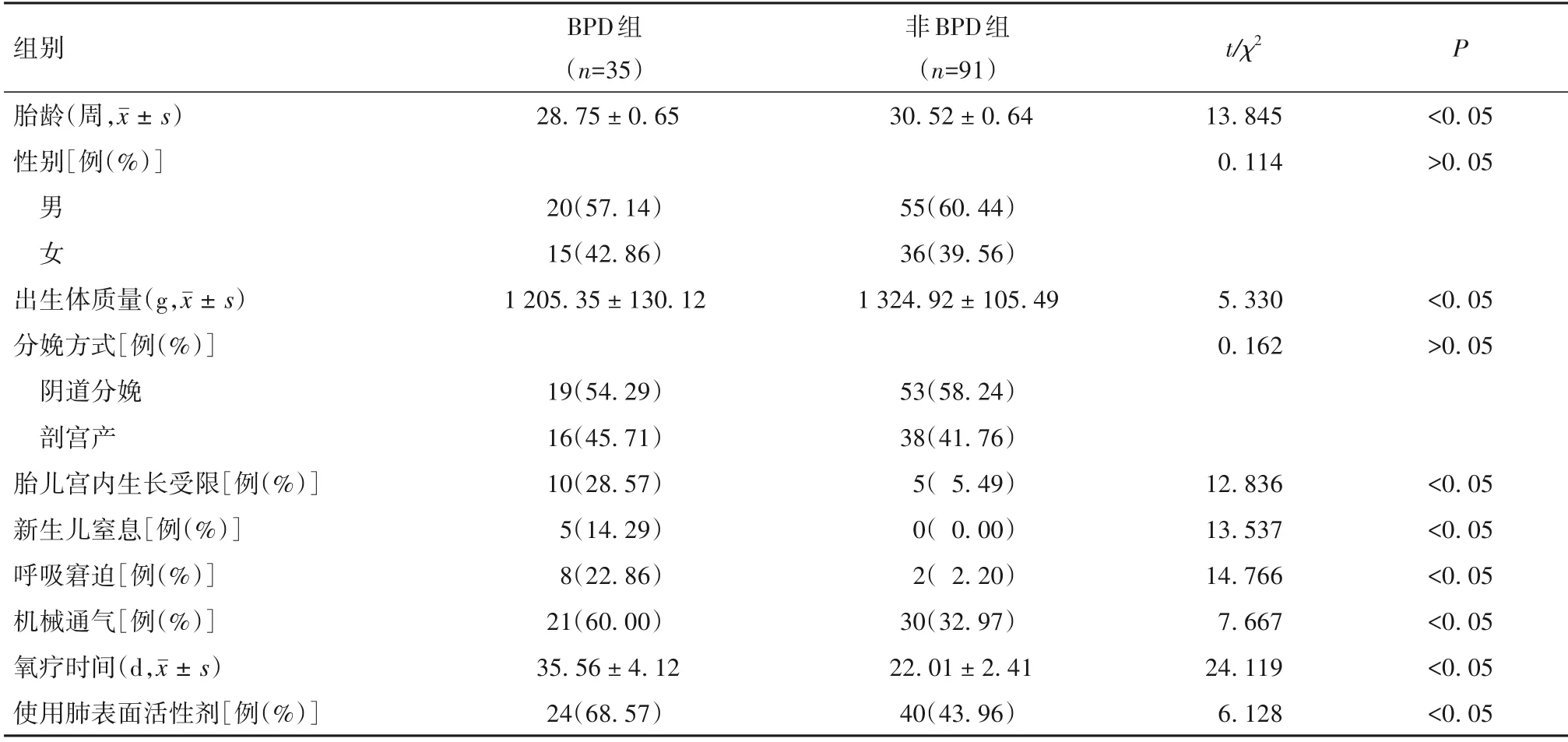
表1 两组临床资料比较
以早产儿是否发生BPD(否=0,是=1)为因变量,以胎龄、出生体质量、母亲孕期吸烟(否=0,是=1)、胎儿宫内生长受限(否=0,是=1)、新生儿窒息(否=0,是=1)、呼吸窘迫(否=0,是=1)、机械通气(否=0,是=1)、使用肺表面活性剂(否=0,是=1)、氧疗时间、MIF、G-CSF 为自变量,纳入多因素Logistic 回归模型。采用向后逐步法排除无关变量,结果发现,氧疗时间长及血清MIF、G-CSF 水平升高是早产儿BPD 的独立危险因素,而胎龄大则为其独立保护因素(P均<0.05),见表2。
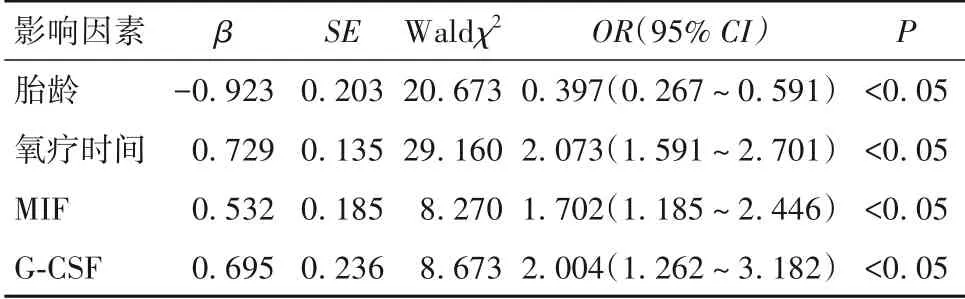
表2 早产儿BPD的多因素Logistic回归分析结果
2.3 血清MIF、G-CSF 水平对早产儿BPD 的诊断价值分析 ROC 曲线分析显示,血清MIF 水平诊断早产儿BPD 的曲线下面积(AUC)为0.743(95%CI:0.657~0.816),其最佳截断值为6.15 ng/mL,此时其诊断早产儿BPD 的灵敏度为71.43%、特异度为71.43%;血清G-CSF水平诊断早产儿BPD的AUC为0.684(95%CI:0.596~0.764),其最佳截断值为72.09 pg/mL,此时其诊断早产儿BPD 的灵敏度为74.29%、特异度为69.23%;血清MIF、G-CSF 水平联合诊断早产儿BPD的AUC为0.930(95%CI:0.870~0.968),其诊断早产儿BPD 的灵敏度为91.43%、特异度为90.11%。血清MIF、G-CSF 水平联合诊断早产儿BPD 的AUC显著高于血清MIF、G-CSF 水平单独(Z分别为5.335、4.174,P均<0.05)。
3 讨论
BPD 是早产儿中常见的一种慢性肺部疾病,是由多种因素导致下呼吸道发育障碍所引起的疾病,其影像学表现为肺泡化减少、囊性肺气肿、纤维化和气道损伤等。目前对BPD 尚缺乏早期诊断和有效治疗的手段,如果诊治不及时可导致严重的终身疾病[6]。早产和低出生体质量是导致新生儿BPD 的常见危险因素。据统计,妊娠22~24 周出生的早产儿BPD 患病率高达80%,而妊娠28 周以后出生的早产儿BPD 患病率降至20%,患BPD 的新生儿约95%为极低出生体质量[7]。此外,胎儿宫内生长受限、宫内感染、肺泡表面活性剂缺乏、机械通气、营养不足等也与新生儿BPD患病风险增加有关[7]。
目前普遍认为,宫内感染、机械通气等引起的炎症反应在BPD 的发生、发展中具有重要作用[2]。炎症细胞可募集T细胞、单核细胞、巨噬细胞等向肺损伤区域迁移并牢固粘附至活化的内皮细胞表面,进一步释放促炎症细胞因子启动炎症级联反应,引起肺或支气管损伤[8]。MIF 是一种上游促炎症因子,基因定位于人染色体22q11.2,其组成型表达并储存于T 细胞、B 细胞、单核细胞、巨噬细胞等细胞内池,在感染、促炎症细胞因子或抗原刺激下从细胞内池中释放出来,直接或间接促进TNF-α、INF-γ、IL-1β等促炎症细胞因子产生。MIF 还可通过自分泌作用促使T 细胞活化和增殖以及相关细胞因子释放,调节炎症反应和免疫反应。有研究报道,过敏性哮喘患者血清MIF 水平显著升高,且其水平与肺功能指数呈负相关关系[9]。HUSEBO 等[10]研究指出,慢性阻塞性肺疾病患者血清MIF 水平显著升高,且在急性加重期血清MIF 水平进一步升高。另外,在呼吸窘迫综合征早产儿脐血中也发现血清MIF水平明显升高[11]。结果提示,MIF 可能与呼吸系统疾病密切相关。本研究发现,BPD 组血清MIF 水平显著高于非BPD 组;多因素Logistic 回归分析显示,血清MIF水平升高是早产儿BPD 的独立危险因素。提示MIF可能与早产儿BPD 的发生、发展密切相关。究其原因,在肺发育过程中MIF 不仅能通过诱导肺部炎症反应引起肺损伤,还能通过影响肺血管生成和肺泡形成阻碍肺发育,最终导致早产儿BPD[12]。
G-CSF 是一种单体型糖蛋白,主要由巨噬细胞、T 细胞、肥大细胞、内皮细胞和成纤维细胞合成,可动员造血干细胞促使中性粒细胞系造血细胞发育和分化。目前,临床多采用重组人G-CSF刺激粒细胞、单核细胞、巨噬细胞成熟并向外周血释放,主要用于治疗肿瘤放疗或化疗后引起的白细胞减少症。正常肺上皮细胞可分泌少量G-CSF,在微生物感染、炎症和创伤刺激下G-CSF 合成增加,G-CSF 增多能够促使中性粒细胞产生、存活和趋化,导致破坏性炎症反应,从而引起上呼吸道疾病或肺部疾病[13]。有研究报道,急性肺损伤患者血清G-CSF水平显著升高,并且血清G-CSF水平升高是急性肺损伤患者死亡的独立危险因素之一[14]。有研究还发现,呼吸道合胞病毒感染哮喘患者痰液G-CSF 水平显著升高,且其与嗜酸性粒细胞计数呈正相关关系[13],表明G-CSF 可能促使嗜酸性粒细胞计数在气道中迁移和浸润,与气道炎症反应密切相关。本研究结果发现,BPD 组血清G-CSF 水平显著高于非BPD 组;多因素Logistic回归分析显示,血清G-CSF 水平升高是早产儿BPD的独立危险因素。提示G-CSF亦能参与早产儿BPD的发生、发展。究其原因,G-CSF 增多可导致未发育成熟的巨噬细胞在肺间质中积累,影响肺泡发育,从而导致早产儿BPD[15]。
本研究ROC 曲线分析显示,血清MIF、G-CSF 水平单独和联合诊断早产儿BPD 的AUC分别为0.743、0.684、0.930,血清MIF、G-CSF 水平联合诊断早产儿BPD 的AUC显著高于血清MIF、G-CSF 水平单独。结果提示,血清MIF、G-CSF 水平对早产儿BPD均有一定诊断价值,二者联合诊断价值更高。综上所述,血清MIF、G-CSF 水平与早产儿BPD密切相关;血清MIF、G-CSF 水平对早产儿BPD 均有一定诊断价值,二者联合诊断价值更高。

