补骨脂二氢黄酮甲醚对耐甲氧西林金葡菌葡萄黄素的抑制作用
丁 颖,朱先鹏,李江波,刘 爽,于清平,王 琳*
(1.吉林大学 动物医学学院/人兽共患病研究教育部重点实验室,吉林 长春 130062;2.吉林金梓源生物科技有限公司,吉林 四平 136400;3.吉林省辽源市西安区农林水利工程总站,吉林 辽源 136200;4.吉林省柳河县农业综合行政执法大队,吉林 通化135300;5.吉林省通化县农业综合行政执法大队,吉林 通化134100)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)属于革兰阳性菌,能够引发大范围的获得性感染[1-2]。近年来,由于抗生素的广泛使用及使用过程中存在的不规范操作,使得多药耐药菌株愈发增多。目前,死于耐甲氧西林金黄色葡萄球菌(methicillin-resistantS.aureus,MRSA)感染的患者人数已经超过死于艾滋病病毒感染的人数[3-4]。然而,目前治疗和控制MRSA的方案却非常有限[5],因此针对MRSA的新型治疗药物的开发就显得愈发迫切[6]。国际研究委员会研讨会上提及的特异性中和细菌毒力因子以提高先天免疫系统对致病菌清除的方法即抗毒力策略越来越引起大家的关注[7]。
病原菌的毒力因子通常与细菌的生长无关,而是经病原菌产生、分泌后帮助病原菌在各种条件下生存,因此针对不同的毒力因子找寻新的抑制剂成为研究热点。葡萄黄素(staphyloxanthin,STX)是S.aureus的一个重要毒力因子,从S.aureus感染者分离的菌种中90%均可产生STX。STX是S.aureus的一种膜结合类胡萝卜素,随着不同菌种毒力呈现不同程度的黄色,主要呈现为淡橙红色或金黄色,其生物结构已经被阐明[8]。研究表明,STX可以保护S.aureus免受氧化应激伤害。CLAUDITZ等[9]研究了STX与活性氧物质(ROS)的相互作用,证明STX可通过其共轭双键清除自由基。由于STX位于细胞膜上,它可能主要保护脂质,但也可能参与保护蛋白质和DNA。STX生物合成需要经过异戊二烯途径由焦磷酸法尼基合成酶(IspA)[10]合成法尼基二磷酸作为底物,底物被脱水鲨烯合成酶(CrtM)、脱水鲨烯脱氢酶(CrtN)、氧化酶(CrtP)、还原酶(AldH)、糖基转移酶(CrtQ)和脂肪酰转移酶(CrtO)等一系列酶催化修饰后最终生成[11]。通过对野生型和等位基因crtM突变体的比较分析表明,野生型对过氧化氢、超氧自由基、羟基自由基、单线态氧和中性粒细胞杀伤作用的抵抗力以及在宿主体内的适应性和生存能力都比突变菌更强[9]。另据报道,萘替芬能够通过竞争性抑制STX生成途径中脱水鲨烯脱氢酶(CrtN)的作用而抑制STX的产生,并可在小鼠模型中有效降低多种S.aureus的毒力,抑制MRSA的感染[12]。
目前,国内外针对STX抑制剂的研究主要集中在化学药物。中药小分子药物取材天然,作用平稳,毒副作用小。本研究是从实验室提取的中药醇提取物中筛选STX的有效抑制剂,发现补骨脂醇提取物抑制效果最好,对其主要成分的抑制活性的分析发现其中几种单体成分都可以有效抑制STX的产生,其中补骨脂二氢黄酮甲醚的色素抑制作用尤为明显,因此本试验对该单体的抑制活性和机制进行了进一步的探讨。补骨脂二氢黄酮甲醚属于异戊烯基黄酮类化合物,具有抗炎、平喘、抗氧化以及抗肿瘤等多种药理作用[13]。本试验结果证实了补骨脂二氢黄酮甲醚能够通过抑制STX生物合成中的关键基因的表达降低MRSA菌株的致病力,为开发治疗MRSA感染的药物提供了新的理论指导和先导化合物。
1 材料与方法
1.1 菌株与主要试剂S.aureus菌株USA300、Newman、ATCC 29213由吉林大学动物医学分子药理学实验室保存;中药提取物由本实验室制备并保存;TSB培养基购自青岛海博有限公司;中药材购自重庆市金乾农业开发有限公司;补骨脂二氢黄酮甲醚(Lot:drk-1842-950423,CAS NO:19879-30-2),纯度>98%,购自成都德锐可生物科技有限公司;甲醇(分析纯)购自北京化学试剂公司;甲醇(色谱纯)和乙腈(色谱纯)购自Dikma公司;二甲基亚砜(DMSO)购自美国Sigma公司;逆转录试剂盒购自近岸蛋白质科技有限公司;超高灵敏CCK-8检测试剂盒购自上海尚宝生物科技有限公司。
1.2 补骨脂的醇提称取20 g中药补骨脂成熟干燥种子粉碎后的粉末置于圆底烧瓶中,向烧瓶中加入120 mL 100%甲醇溶液并混匀。使用冷凝回流装置加热萃取,回流2 h,过滤并收集萃取液,重复2次。使用旋转蒸发仪浓缩至40 mL,转移至坩埚中搅拌加热蒸发水分,最后将黏稠样品置于恒温鼓风干燥箱中持续干燥最终获得补骨脂醇提取物浸膏。
1.3 STX抑制剂的筛选将耐药S.aureus与药物共培养后,通过观察色素生成多少来从中药醇提物中筛选有效抑制剂。USA300菌株过夜培养物按照1∶100比例接种于2 mL TSB培养基中,加入中药醇提物至终质量浓度为16 mg/L,设置仅接种USA300并加入等量DMSO组作为对照,培养36 h,12 000 r/min 离心1 min后,通过菌体沉淀颜色观察抑制效果。
1.4 STX抑制定量试验使用有机溶剂萃取法萃取STX后通过测定吸光度确定色素含量。过夜培养USA300菌株1∶100比例接种于4 mL TSB培养基中,加入不同质量浓度的待测药物补骨脂醇提取物(终质量浓度分别为0.25,1.00,4.00,16.00 mg/L)及补骨脂二氢黄酮甲醚(终质量浓度分别为0.25,0.50,1.00,2.00,4.00,8.00,16.00,32.00 mg/L),设置仅接种菌株并加入等量DMSO组为对照。恒温摇床37℃、180 r/min培养36 h,12 000 r/min 离心1 min 收集培养物弃上清,观察菌体沉淀颜色。使用0.01 mol/L PBS洗涤菌体2次,弃洗涤液,用1 mL甲醇分3次重悬菌体萃取色素。将3次萃取液混合,12 000 r/min 离心1 min使药渣等杂质沉淀,每管萃取液样品取200 μL于96孔板中,450 nm波长处测定吸光值并绘制曲线,并通过GraphPad Prism 8.0软件计算抑制剂的IC50。该试验重复3次。
1.5 补骨脂醇提取物及补骨脂二氢黄酮甲醚最小抑菌浓度(MIC)及生长曲线的测定
1.5.1最小抑菌浓度(MIC)的测定 MIC按照临床和实验室标准协会(CLSI)中所述的微量肉汤稀释法进行。在96孔培养板的每1行的2~11孔中加入100 μL干净的培养基,第1孔中加入质量浓度为1 024 mg/L的待测中药单体母液(DMSO<0.5%),将体积补至200 μL混匀,从第1孔吸取100 μL 液体加入到第2孔中混匀后,取100 μL液体加入到第3孔中,以此类推倍比稀释。以只加入肉汤培养基的孔作为阴性对照,以只加入DMSO的组为阳性对照。每种待测样品进行3次平行试验。将培养至对数生长期的金葡菌USA300菌液调节菌量至1×108CFU(D600 nm=0.1)加入到各个孔中,而后将96孔板放入37℃生化培养箱中培养24 h,以抑制细菌生长的最小浓度为该药物的最小抑菌浓度。
1.5.2生长曲线的测定 过夜培养的USA300菌株按1∶100的比例在TSB培养基中扩培,生长至D600 nm=0.3时分装于40 mL小锥形瓶中,加入不同质量浓度补骨脂醇提取物及补骨脂二氢黄酮甲醚,设置不加药物对照,恒温摇床37℃、180 r/min培养48 h,每个样品每隔1 h取1 mL菌液,使用紫外分光光度计测D600 nm值,记录数据并绘制曲线。
1.6 高效液相色谱(HPLC)检测利用HPLC检测补骨脂醇提取物中抑制色素有效成分的含量,使用色谱纯甲醇溶解补骨脂醇提取物(20 g/L)及单体补骨脂二氢黄酮甲醚(100 mg/L),用薄膜过滤器过滤后上样。色谱条件:色谱柱为C18-WR(4.6 mm×250 mm,5 μm,WondaSil公司),流动相组成:水(A泵)、乙腈(B泵)、甲醇(C泵)作为洗脱液进行梯度洗脱。程序设定:程序1时间设定0~10 min,乙腈(B泵)浓度变化10%→35%,甲醇(C泵)浓度变化80%→30%,洗脱液其他成分用水(A泵)调整补足;程序2时间设定10~30 min,乙腈(B泵)浓度变化35%→37.5%,甲醇(C泵)浓度变化30%→25%,洗脱液其他成分用水(A泵)调整补足;程序3时间设定30~40 min,乙腈(B泵)浓度变化37.5%→40%,甲醇(C泵)浓度变化25%→20%,洗脱液其他成分用水(A泵)调整补足。流速设置为1.0 mL/min;柱温为30℃;进样量为30 μL;检测波长设置为254 nm。
1.7 过氧化氢敏感性试验过夜培养USA300菌株1∶100接种于2 mL TSB培养基中,加入药物至质量浓度为0.5,2.0,8.0 mg/L,设置等量DMSO组作为溶剂对照,恒温摇床37℃、转速180 r/min培养24 h。取500 μL菌液离心,收集菌体,使用0.01 mol/L PBS缓冲液洗涤2次,加入500 μL PBS重悬混匀菌体。吸取少量菌液加至1 500 μL PBS缓冲液中调整D600 nm=0.1,取250 μL调整好菌液于2 mL 离心管中,加入30%H2O2溶液至终浓度为1.5%,封口膜密封,37℃恒温箱中孵育1 h。另取菌液250 μL加入等量无菌PBS作对照。孵育后菌液加入5 μL 20 000 U/mL无菌过氧化氢酶终止反应。取100 μL反应液至900 μL PBS中,取10 μL稀释液点至TSA平板上进行菌落计数。试验重复3次。
1.8 细菌酸碱刺激存活试验过夜培养USA300菌株1∶100扩培至50 mL TSB培养基中,生长至D600 nm为1.0时,扩培分装至加入补骨脂二氢黄酮甲醚(8 mg/L)或等量DMSO溶剂对照组的酸性TSB肉汤(pH5)、碱性TSB肉汤(pH9)及正常TSB(pH7)肉汤中,每8 h使用紫外分光光度计测定D600 nm值,通过绘制生长曲线测定细菌的生长情况。所有试验重复3次。
1.9 CCK-8细胞活性试验采用CCK-8法测定补骨脂二氢黄酮甲醚的细胞毒性。取对数生长期的A549细胞,以20 000细胞/孔接种200 μL于96孔板中,于5%CO2、恒温37℃细胞培养箱中培养12 h,光学显微镜下观察细胞贴壁后,更换含有10%胎牛血清的高糖DMEM培养基,并分别加入补骨脂二氢黄酮甲醚至终质量浓度1,2,4,8 mg/L于各孔中,设置溶剂DMSO及空白培养基作为对照,每个剂量设置3孔平行重复。恒温细胞培养箱37℃孵育6 h,每孔吸出100 μL上清培养液,在各孔加入10 μL CCK-8溶液,于37℃恒温箱孵育1 h,用酶标仪在450 nm波长处测定吸光度,与不加药仅加入培养基对照组数值比较,计算相对细胞活性。
1.10 细胞黏附试验在24孔板中每孔接种2×105个A549细胞,并加入1 mL含有10%胎牛血清的 DMEM高糖培养基,放入5%CO2、恒温37℃细胞培养箱中培养12 h,更换培养基混合USA300(MOI=20)感染细胞,并分别加入终质量浓度1,2,4,8 mg/L的补骨脂二氢黄酮甲醚,设置DMSO对照,恒温箱37℃孵育2 h。使用0.01 mol/L 无菌PBS缓冲液清洗细胞3次,加入1 mL无菌蒸馏水裂解细胞5 min,稀释涂板,37℃恒温箱中孵育12 h后记录平板上菌落数并进行统计分析。所有试验进行3次重复。
1.11 RT-PCR过夜培养USA300菌株按照1∶100接种于含4 mL TSB培养基的试管中,加入补骨脂二氢黄酮甲醚(8 mg/L),设置等量DMSO作对照,恒温摇床37℃,转速180 r/min培养过夜。过夜培养物12 000 r/min离心5 min收集菌体沉淀,加入Tris-HCL(pH8.0)200 μL重悬菌体,95℃金属浴加热20 min。待自然冷却后加入50 μL 1 g/L溶菌酶混匀,置于37℃水浴锅中5 h破坏细胞壁。加入1 mL TRIzol振荡混匀,冰浴5 min,加入200 μL预冷的氯仿涡旋15 s混匀,冰浴5 min,4℃、12 000 r/min离心15 min,管中液体分3层,小心吸取上层水相600 μL于无核酸酶1.5 mL EP管中,加入600 μL 预冷异丙醇振荡混匀,冰浴10 min,4℃、12 000 r/min 离心10 min弃去管中液体,此时RNA经离心已经吸附至管壁及管底,加入1 mL使用DEPC水配置的75%乙醇洗涤沉淀,4℃、7 500 r/min离心 5 min,小心弃净上清,室温晾干5 min,加入20 μL DEPC水溶解RNA沉淀。通过吸光度比率(D260 nm/D280 nm)定量,使用逆转录试剂盒将其反转录为cDNA。以cDNA为模板,根据NCBI上相关基因序列设计引物(表1)进行RT-PCR扩增,每个反应重复3次。引物均由生工生物(上海)股份有限公司合成。结果采用相对定量法(2-ΔΔCt)分析。
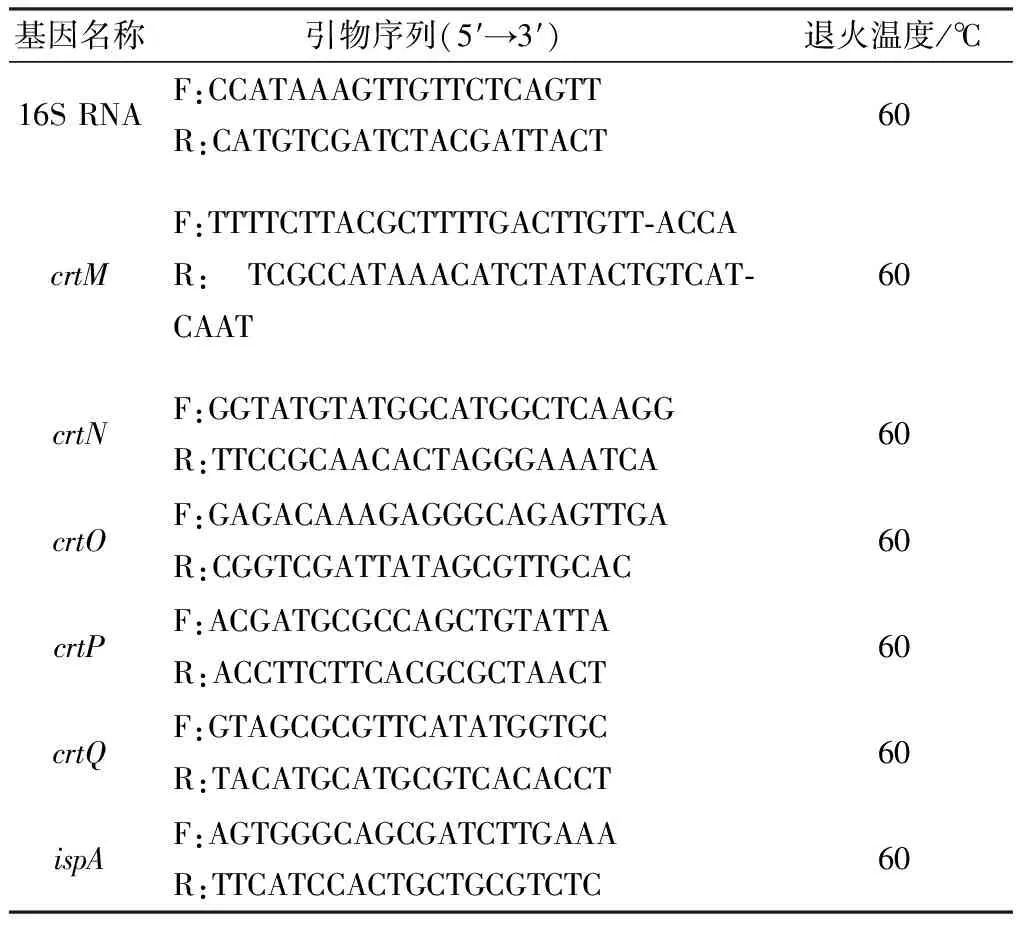
表1 引物信息
1.12 试验数据统计分析使用GraphPad Prism 8.0和SPSS 20.0软件对试验数据进行统计学分析。单因素方差分析用于STX抑制定量试验、过氧化氢敏感性试验、细菌酸碱刺激存活试验、细胞活性试验、细胞黏附试验、RT-PCR各组间的差异;以P<0.05为差异显著性判断标准。
2 结果
2.1 多重耐药S.aureusSTX抑制剂筛选为了使抑制剂的筛选更准确高效,首先考察了不同菌株STX生成量随培养时间的变化(图1A),选用色素产生明显的USA300菌株作为研究对象,并将筛选STX抑制剂与菌株共培养时间确定为36 h。通过对本实验室制备并保存的中药材提取物库进行筛选,在中药材醇提物中,发现16 mg/L的补骨脂醇提物的色素抑制效果最为明显(图1B)。
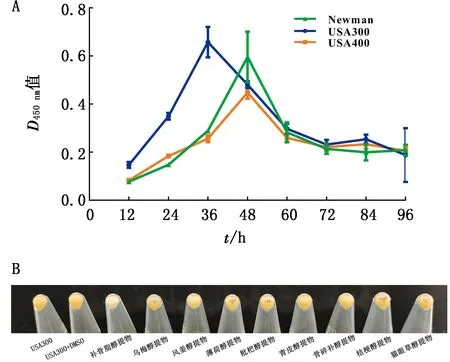
A.不同金葡菌生成STX量随时间变化;B.16 mg/L中药提取物抑制USA300菌株STX生成情况
2.2 补骨脂醇提物中多种成分抑制STX产生中药材提取物成分复杂,据文献报道补骨脂提取物中含有补骨脂素、补骨脂甲素、补骨脂乙素、补骨脂定、补骨脂二氢黄酮甲醚、补骨脂酚等主要成分[14-15]。本试验通过对补骨脂醇提物(图2A)及其主要成分对STX的抑制作用的分析,发现其中补骨脂二氢黄酮甲醚对STX的抑制活性最为明显(IC50=0.529 mg/L)(图2B)。随后,通过高效液相色谱法检测了补骨脂二氢黄酮甲醚在补骨脂醇提物中的含量,为1.83%(图2C,D)。如上所述,本试验选择补骨脂二氢黄酮甲醚作为后续研究的目标化合物。
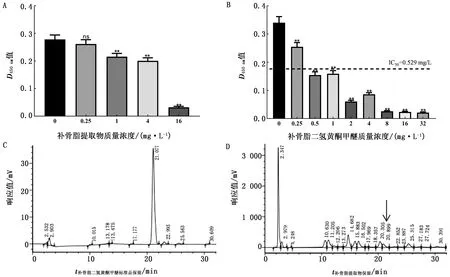
A.不同质量浓度补骨脂提取物对STX的抑制活性;B.不同质量浓度补骨脂二氢黄酮甲醚对STX的抑制活性;C.补骨脂二氢黄酮甲醚标准品高效液相色谱图(254 nm);D.补骨脂醇提取物高效液相色谱图(254 nm)。与不加药对比,ns示差异不显著(P>0.05),**示差异极显著(P<0.01)。下同
2.3 补骨脂二氢黄酮甲醚对USA300菌株生长的影响为了测定补骨脂醇提物及有效单体成分补骨脂二氢黄酮甲醚对USA300菌株生长的影响,本试验进行了MIC试验和生长曲线的测定。结果显示,补骨脂醇提物对USA300菌株24 h的MIC为32 mg/L,补骨脂二氢黄酮甲醚对USA300菌株24 h的MIC大于512 mg/L。如图3所示,补骨脂醇提物及补骨脂二氢黄酮甲醚对USA300菌株的生长未产生显著影响,虽然高质量浓度的补骨脂二氢黄酮甲醚在早期抑制菌株生长,但很快恢复至与正常菌株相同的生长速度。以上结果证明补骨脂二氢黄酮甲醚在有效抑制STX的质量浓度下不会对细菌生长产生影响。
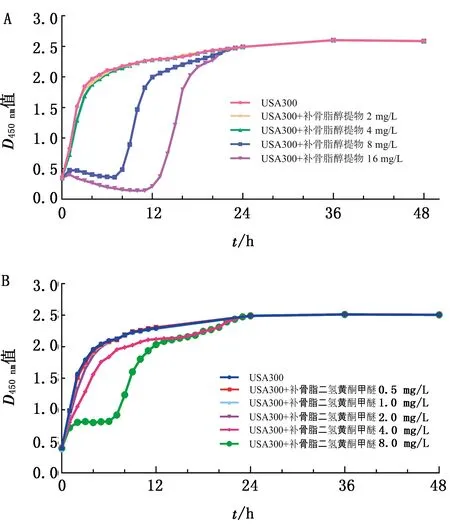
图3 不同浓度补骨脂醇提物(A)及补骨脂二氢黄酮甲醚(B)对金葡菌USA300生长的影响
2.4 补骨脂二氢黄酮甲醚对MRSA氧敏感性的影响葡萄黄素是一种抗氧化色素,为了进一步确证补骨脂二氢黄酮甲醚对葡萄黄素的抑制作用,本试验使用H2O2作为氧化剂对USA300菌株进行杀伤刺激。如图4A所示,氧敏感性试验结果显示,与未加补骨脂二氢黄酮甲醚对照组相比,药物组USA300菌株对氧化剂杀伤更敏感,且其敏感性呈现剂量依赖性变化,即随着补骨脂二氢黄酮甲醚剂量增加,USA300菌株对过氧化氢的敏感性增加,存活率降低。
2.5 补骨脂二氢黄酮甲醚对MRSA在酸碱胁迫刺激环境中的影响STX分布在S.aureus细胞膜上对病原菌产生保护作用,因此本试验进一步考察了STX除抗氧化性质外,在酸碱胁迫刺激环境中对USA300菌株存活的影响。由图4B可知,补骨脂二氢黄酮甲醚处理后的USA300菌株在酸性培养基(pH5.0)中对环境刺激的抵抗力下降(P<0.05),而碱性培养基(pH9.0)中与对照组(pH7.0)差异并不显著(P>0.05),表明补骨脂二氢黄酮甲醚能够恢复耐药S.aureus对酸刺激的敏感性。
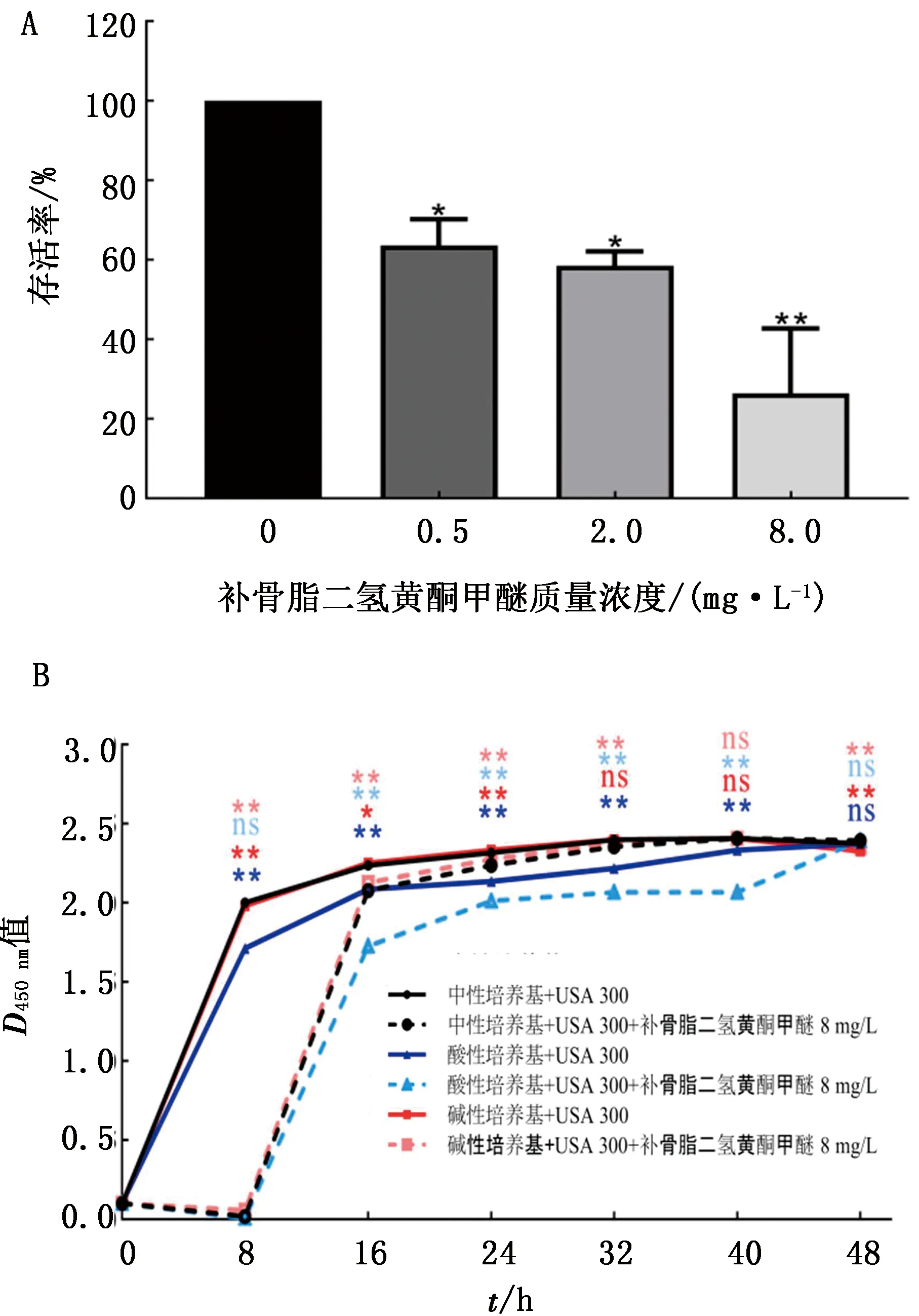
A.补骨脂二氢黄酮甲醚对USA300菌株氧敏感性影响,与对照组相比,*示差异显著(P<0.05),**示差异极显著(P<0.01);B.补骨脂二氢黄酮甲醚对USA300菌株酸碱环境抗逆性影响,与不加药组相比,**示差异极显著(P<0.01),ns示差异不显著(P<0.05)。下同
2.6 补骨脂二氢黄酮甲醚对USA300菌株感染A549细胞的影响为了检测补骨脂二氢黄酮作为抗菌药物的安全性,首先检测其对细胞生长是否影响,由图5A可知,补骨脂二氢黄酮甲醚在抑制STX的有效质量浓度范围内对A549细胞活性没有影响(P>0.05)。结果2.2证明补骨脂二氢黄酮甲醚质量浓度在8 mg/L时对STX生产的抑制率可达90%以上,且药物在8 mg/L时及以下并未对A549细胞活性造成影响。
细菌对宿主细胞的黏附是其侵入并感染细胞的前提,如图5B所示,随着补骨脂二氢黄酮甲醚质量浓度升高,细胞表面黏附菌量逐渐降低。质量浓度4 mg/L 补骨脂二氢黄酮甲醚即可显著降低USA300菌株对A549细胞的黏附能力,从而保护A549细胞不被细菌侵袭。
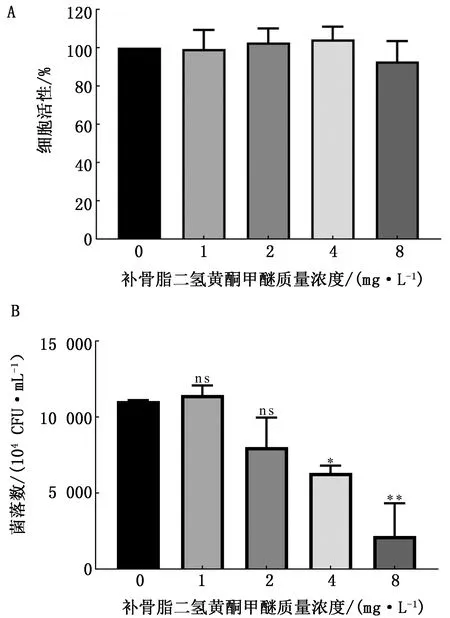
与对照组相比,无*或ns示差异不显著(P>0.05)
2.7 补骨脂二氢黄酮甲醚对STX生成途径相关基因的调控为了探究补骨脂二氢黄酮甲醚的作用机制,在转录水平上,本试验通过RT-PCR检测8 mg/L补骨脂二氢黄酮甲醚对MRSA STX生成相关基因表达的影响。与空白溶剂DMSO处理组相比,补骨脂二氢黄酮甲醚处理组葡萄黄素生成途径中重要基因crtM、crtN、crtP、crtQ、crtO及葡萄黄素上游异戊二烯合成途径相关基因ispA的表达水平均明显降低(P<0.01)(图6),表明补骨脂二氢黄酮甲醚可能是通过抑制STX生成通路相关基因的表达从而表现出对其活性的抑制作用,进而阻止耐药S.aureus对细胞的黏附。

图6 补骨脂二氢黄酮甲醚对葡萄黄素生成相关基因转录水平影响
3 讨论
随着多重耐药菌株的不断出现,病原菌耐药性成为全球不得不面对的一大挑战,抗生素研发速度远远落后于耐药菌株的频繁迭代[16]。近年来以毒力因子为靶标,在不对病原菌产生生存压力的同时,通过机体免疫系统的协助清除病原菌的抗毒力策略引发国际社会的广泛关注。本研究旨在从实验室现有的植物提取物中筛选出S.aureusSTX的有效抑制剂,并对其抑制机制进行初步的探讨。
STX是S.aureus标志性毒力因子之一,其产生受温度,光照,时间等影响,药物筛选过程中为了保证STX产生稳定且易于观察,选择色素产生明显的菌株USA300,并根据色素随时间变化的曲线将收集色素的时间确定在36 h。因为葡萄黄素产生后眼观可见,所以本试验通过观察菌体颜色的变化能够快速高效的筛选出STX的抑制剂。本试验对实验室提取的中药醇提物进行筛选,发现补骨脂醇提物具有显著的色素抑制作用,但中药提取物成分构成复杂,且存在难以准确定量及后续机制研究困难等问题,因此结合现有报道[14],通过对补骨脂醇提物分析,成功找到对STX有明显抑制效果的补骨脂二氢黄酮甲醚。该化合物在较低质量浓度下(IC50=0.529 mg/L)就有很显著的色素抑制活性,8 mg/L 的药物就能达到90%的抑制率,且在该质量浓度水平下不影响USA300菌株的生长,不易引发S.aureus产生耐药性。
STX分布在S.aureus表面保护S.aureus免受宿主免疫机制的影响。在体外通过检测USA300菌株应对胁迫刺激条件的存活情况考察补骨脂二氢黄酮甲醚是否能有效降低耐药S.aureus的防御力。氧化剂H2O2刺激及酸碱环境胁迫生长结果均表明药物处理使USA300菌株对不良刺激更敏感,有望通过抑制色素降低病原菌自身对刺激的抵抗能力,提高其对机体免疫杀伤的敏感性进而使病原体更易被机体免疫系统清除。为了进一步验证药物的开发潜力,本试验对其安全性和在细胞体内活性进行了考察,其中A549细胞活性试验表明补骨脂二氢黄酮甲醚在抑制STX的有效质量浓度内使用安全。细胞黏附试验证明补骨脂二氢黄酮甲醚能够显著降低USA300菌株黏附细胞的能力,有进一步体内研究的价值。
S.aureusSTX是由三萜类胡萝卜素经一系列酶的反应催化加工而成的C30链。通过RT-PCR在转录水平上对补骨脂二氢黄酮甲醚处理后样品的STX生成相关基因进行检测分析,STX上游途径产物合成酶基因ispA,STX合成途径中催化酶基因crtM、crtN、crtO、crtP、crtQ转录均受到抑制。推测这一结果产生的原因可能是由于补骨脂二氢黄酮甲醚作用于STX产生途径的上游调控机制,如sigB因子等而发挥作用的[17],这有待后续进一步研究。
病原菌引发感染是一个复杂的过程,需要多种毒力因子的协同作用[18]。抗毒力药物可选择性地遏制目标菌的毒素表达、毒素传递、细菌黏附和细菌的免疫逃避等,从而降低细菌的致病性。这种抗菌策略阻止了由于生存压力导致的细菌耐药性。本研究筛选出的S.aureusSTX抑制剂补骨脂二氢黄酮甲醚为新的抗生素的替代药物和辅助药物的开发提供可靠的理论基础和优秀的先导化合物。

