弓形虫泛素特异性蛋白酶TgUSP10的定位及其功能
陈璐璐,孙洪超,阳毅敏*,盛楷茵,姚晨倩,陈学秋,杨 怡,杜爱芳*
(1.浙江大学 动物科学学院 浙江省动物预防医学重点实验室/浙江大学动物预防医学研究所,浙江 杭州 310012;2.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021)
刚地弓形虫(Toxoplasmagondii)简称弓形虫,隶属于顶复门,可感染几乎所有的温血动物,猫科动物为其终末宿主[1]。弓形虫病是由弓形虫感染引起的全球性人畜共患病,在免疫功能正常的机体中,弓形虫病多不表现临床症状,但对于免疫力低下者和孕妇、孕畜而言,弓形虫感染能够引起严重疾病甚至死亡,威胁人类健康和畜牧业的发展[1-2]。磺胺嘧啶和乙胺嘧啶的联合用药是目前临床上应用最为广泛的弓形虫病治疗方法,但其毒副作用明显,因此,研发更为安全有效的弓形虫药物是当前研究的重点[3]。
泛素化修饰在弓形虫中大量、广泛存在,泛素相关信号通路中的关键因子有望成为弓形虫病防控的潜在药物靶标[4]。去泛素化酶(deubiquitinating enzymes,DUBs)通过移除底物蛋白上的单泛素分子或多聚泛素链,逆转泛素化过程,进而调控蛋白质周转、DNA损伤修复、细胞周期、线粒体自噬以及免疫应答等多个进程[5]。弓形虫基因组编码约40种DUBs,根据人类DUBs的分类[6],可以分为泛素特异性蛋白酶(ubiquitin-specific proteases,USPs)、泛素羧基末端水解酶(ubiquitin C-terminal hydrolases,UCHs)、卵巢肿瘤相关蛋白酶(ovarian tumour proteases,OTUs)、Machado-Joseph结构域蛋白酶(machado-Joseph domain-containing proteases,MJDs)、JAMM/MPN域相关金属肽酶(JAMM/MPN domain-associated metallopeptidases,JAM-Ms)和MINDY蛋白酶(motif interacting with ubiquitin-containing novel DUB family proteases,MINDYs)6大类[4]。目前仅有关于TgUCHL3和TgOTUD3A的报道[7-9],其余的DUBs在弓形虫中的定位和功能仍有待研究。USPs是已知数量最多且结构最为多样的一类DUBs亚家族,其中,人USP10在DNA损伤修复[10]、自噬调节[11-12]和核糖体循环[13]等过程中发挥关键作用。本试验利用BLASTp检索鉴定出弓形虫中人USP10的同源基因TgUSP10,并通过CRISPR/Cas9技术构建TgUSP10的内源性标记虫株,以检测其在弓形虫中的定位,同时对TgUSP10进行敲除,从而探究其在弓形虫体外增殖过程中的作用,为今后评价去泛素化酶作为潜在药物靶标的可能性提供科学依据。
1 材料与方法
1.1 虫株与细胞弓形虫RH△ku80△hxgprt虫株(以下简称RH△ku80)和人包皮成纤维细胞(human foreskin fibroblasts,HFF-1)由本实验室保存。
1.2 质粒与菌株pSAG1::CAS9-U6::sgBbsⅠ由本实验室在华中农业大学申邦教授惠赠的pSAG1::CAS9-U6::sgUPRT的基础上改造后保存;pSL10-6×HA-LoxP-HX-LoxP-T7质粒为中国农业大学龙少军教授惠赠;pBlue-DHFR质粒和E.coliTOP10感受态细胞由本实验室保存。
1.3 工具酶、抗体及药物T4多聚核苷酸激酶(BioLabs);BbsⅠ(Thermo);KOD ONE(Toyobo);鼠源TgIMC1多克隆抗体、鼠源弓形虫全虫蛋白多克隆抗体、兔源TgGAP45多克隆抗体为本实验室制备并保存;兔源HA-Tag单克隆抗体(CST);Alexa Fluor 488标记的山羊抗兔IgG、Alexa Fluor 594标记的山羊抗鼠IgG(Invitrogen);DAPI(碧云天);黄嘌呤、霉酚酸、乙胺嘧啶(Sigma)。
1.4TgUSP10同源蛋白的鉴定根据人USP10的氨基酸序列(NP_005144.2),利用NCBI的BLASTp检索功能,确定弓形虫中的同源蛋白TgUSP10(TGGT1_221610)。
1.5TgUSP10内源性标记虫株(TgUSP10-6HA)的构建
1.5.1内源性标记质粒的构建 利用EuPaGDT网站(http://grna.ctegd.uga.edu/)设计靶向TgUSP10基因3′UTR序列的sgRNA,合成带BbsⅠ酶切位点的引物sgUSP10-6HA-F和sgUSP10-6HA-R(表1)。将引物与T4多聚核苷酸激酶预混,经梯度降温合成双链,产物与酶切后的pSAG1::CAS9-U6::sgBbsⅠ质粒相连,构建内源性标记质粒。
1.5.2供体片段的扩增 以pSL10-6×HA-LoxP-HX-LoxP-T7质粒为模板,以6HA-HXGPRT-F和6HA-HXGPRT-R(表1)为引物,利用KOD ONE酶扩增供体片段。
1.5.3电转 收集1×107个新鲜逸出的RH△ku80速殖子,与7.5 μg内源性标记质粒、10 μg供体片段、50 μg谷胱甘肽和300 μg ATP预混,在1 600 V、25 μF、200 Ω条件下完成电击。
1.5.4药物筛选与鉴定 利用质量浓度均为25 mg/L 的霉酚酸和黄嘌呤药物筛选单克隆,以RH△ku80为对照,用引物PCR-F和PCR-R(表1)进行PCR鉴定,同时利用Western blot验证重组蛋白的表达。

表1 构建TgUSP10-6HA虫株的引物
1.6TgUSP10亚细胞定位与表达水平分析在24孔培养板中放入细胞爬片,待HFF-1细胞长至单层后,接入TgUSP10-6HA虫株,培养24 h。经4%多聚甲醛固定、0.25%Triton-100透化及1%BSA封闭后,以兔源HA-Tag单克隆抗体(1∶500)和鼠源TgIMC1多克隆抗体(1∶500)为一抗,Alexa Fluor 488标记的山羊抗兔IgG(1∶1 000)和Alexa Fluor 594标记的山羊抗鼠IgG(1∶1 000)为二抗,进行IFA试验,激光共聚焦显微镜下观察并记录结果。
1.7TgUSP10基因缺失株(△TgUSP10)的构建利用EuPaGDT网站(http://grna.ctegd.uga.edu/)设计靶向TgUSP10基因的sgRNA,合成sgUSP10-KO-F和sgUSP10-KO-R(表2),构建CRISPR/Cas9敲除质粒。以pBlue-DHFR质粒为模板,DHFR-F和DHFR-R(表2)为引物,扩增供体片段。将敲除质粒和供体片段电转至RH△ku80虫株,利用浓度为3 μmol/L的乙胺嘧啶药物筛选单克隆,并提取基因组进行PCR鉴定。具体步骤参照1.5。

表2 构建△TgUSP10虫株的引物
1.8 △TgUSP10虫株的表型分析
1.8.1噬斑试验 在长满HFF-1细胞的6孔板中每孔接入200个△TgUSP10或RH△ku80虫株,培养7 d。经PBS洗涤、甲醇固定及0.1%结晶紫染色后,利用扫描仪记录噬斑结果,并对不同虫株形成噬斑的数量和相对面积进行统计。
1.8.2黏附/入侵试验 在24孔培养板中放入细胞爬片,待HFF-1细胞长至单层后,每孔接入5×106个△TgUSP10或RH△ku80虫株。30 min后,4%多聚甲醛固定,1%BSA 封闭,以鼠源弓形虫全虫蛋白多克隆抗体(1∶2 000)为一抗,Alexa Fluor 594标记的山羊抗鼠IgG(1∶1 000)为二抗,标记细胞外的速殖子。经0.25%Triton-100透化及1% BSA封闭后,用兔源TgGAP45多克隆抗体(1∶500)和Alexa Fluor 488标记的山羊抗兔IgG(1∶1 000)标记全部速殖子,最后加入DAPI对细胞核进行染色。每个样品利用激光共聚焦显微镜随机拍摄10个视野,计算平均每个细胞黏附/入侵的速殖子数量以及入侵率。
1.8.3复制试验 在24孔培养板中放入细胞爬片,待HFF-1细胞长至单层后,每孔接入1×105个△TgUSP10或RH△ku80虫株,3 h后移除未入侵的速殖子。培养24 h后,经甲醇固定和1%BSA封闭后,以兔源TgGAP45多克隆抗体(1∶500)为一抗,Alexa Fluor 594标记的山羊抗兔IgG(1∶1 000)为二抗,进行IFA试验。每个样品利用激光共聚焦显微镜随机拍摄10个视野,计算速殖子数量为2,4,8,16个的纳虫泡数量占总数量的比例。
1.8.4逸出试验 如1.8.3操作向HFF-1细胞内接入△TgUSP10或RH△ku80虫株,培养36 h后,加入浓度为3 μmol/L的钙离子载体,作用3 min,后续染色同1.8.2。每个样品利用激光共聚焦显微镜随机拍摄10个视野,计算速殖子逸出的纳虫泡数量占总数量的比例。
1.9 统计学分析利用GraphPad Prism 7.0软件进行数据分析,使用t检验或Two-way ANOVA进行差异分析。
2 结果
2.1 成功构建TgUSP10-6HA虫株将内源性标记质粒与供体片段共转至RH△ku80构建TgUSP10-6HA虫株(图1A)。提取单克隆虫株基因组进行PCR扩增,条带大小为727 bp,符合预期(图1B);提取虫株总蛋白进行Western blot检测,反应条带位于96 kDa处,证实TgUSP10-6HA融合蛋白成功表达(图1C)。结果表明,TgUSP10-6HA虫株构建成功。

A.TgUSP10-6HA虫株构建及PCR鉴定引物设计示意图;B.TgUSP10-6HA虫株的PCR鉴定;C.TgUSP10-6HA重组蛋白的Western blot验证
2.2TgUSP10定位于虫体细胞质以兔源HA-tag单克隆抗体为一抗对TgUSP10-6HA虫株进行IFA试验,可见TgUSP10定位于速殖子的细胞质(图2)。在同一拍摄条件下,记录了TgUSP10在细胞周期不同阶段的表达水平变化,结果显示,与已知的TgUSP10 mRNA转录水平[14](图3)变化一致,TgUSP10在G1期、S期和分裂后期表达量较高,分裂前期和分裂中期表达量较低,呈现细胞周期性表达(图4)。

图2 TgUSP10在胞内虫体的定位分析

图3 TgUSP10在细胞周期不同阶段的mRNA转录水平

图4 TgUSP10在细胞周期不同阶段的表达水平
2.3 成功构建△TgUSP10虫株将敲除质粒与供体片段共转至RH△ku80构建△TgUSP10虫株(图5A)。对经药物筛选后的单克隆虫株进行PCR鉴定,PCR1、PCR2和PCR3的结果共同说明TgUSP10的全长CDS被DHFR药筛标记替代(图5B),△TgUSP10虫株构建成功。
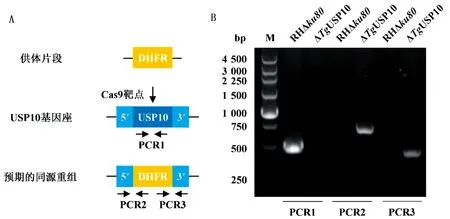
A.△TgUSP10虫株构建及PCR鉴定引物设计示意图;B.△TgUSP10虫株的PCR鉴定
2.4 △TgUSP10虫株体外生长变慢利用噬斑试验评估△TgUSP10虫株在细胞内的生长情况,结果显示△TgUSP10与RH△ku80虫株均能形成噬斑,两者在数量上无明显差异,但△TgUSP10的噬斑面积显著减小,表明弓形虫缺失TgUSP10后生长受到抑制(图6)。进一步对△TgUSP10进行黏附/入侵、复制和逸出试验,与对照虫株相比,△TgUSP10的复制能力减弱,而黏附/入侵和逸出宿主细胞的能力则无明显变化(图7)。

A.噬斑试验扫描结果;B.噬斑数量统计结果(采用t检验);C.噬斑相对面积统计结果(采用t检验),其中****表示P<0.000 1

A.黏附/入侵试验统计结果(采用t检验);B.复制试验统计结果(采用Two-way ANOVA),其中*表示P<0.05,****表示P<0.000 1;C.逸出试验统计结果(采用t检验)
3 讨论
USP10是一种重要的USP家族去泛素化酶,已知人USP10参与p53[10]、CFTR[15]、AMPKα[12]、SIRT6[16]和NEMO[17]等蛋白的去泛素化,在细胞代谢和人类疾病中发挥关键作用[18]。本研究确定了弓形虫中与人USP10同源的蛋白TgUSP10,利用CRISPR/Cas9系统介导的同源重组技术,将TgUSP10与6HA标签融合表达,确定TgUSP10主要定位于细胞质。进一步构建TgUSP10的基因缺失株,表型试验结果表明TgUSP10缺失后,弓形虫内二分裂过程减慢,生长受阻。
鉴定DUBs的亚细胞定位可以为探究其底物和功能提供线索和依据[19]。在正常条件下,人USP10定位于细胞质,参与细胞质中抑癌蛋白p53的去泛素化过程,调节p53稳态;然而在DNA损伤后,部分USP10在细胞核中积累,参与细胞核中p53蛋白的去泛素化[10]。本试验结果表明,TgUSP10主要定位于细胞质,可能参与弓形虫胞质蛋白的去泛素化过程,具体的靶标蛋白以及其是否存在与人USP10类似的易位现象仍有待研究。SILMON等[4]在胞内速殖子中鉴定出454个发生泛素化修饰的蛋白质,它们在虫体中广泛分布,其中,细胞质定位最为丰富,占32%,细胞骨架和内膜复合体蛋白占18%,胞质胞核分布的蛋白占8%,另有13种定位于顶质体或线粒体,这提示了DUBs在弓形虫中定位的多样性。
作为一种专性细胞内寄生原虫,弓形虫在细胞内进行复制的能力与其致病力密切相关[20]。研究表明,DUBs在弓形虫复制过程中发挥关键作用,虫体缺失TgOTUD3A后,其复制会偏离正常的内二分裂过程,而在母体内产生多个子代[9]。本试验结果表明,TgUSP10在弓形虫复制过程中发挥重要作用,缺失TgUSP10后,虫株的复制能力降低。在其他物种中,USP10的缺失也检测到了类似的表型:在人胚肾293细胞中敲除USP10基因后,细胞的复制速率降低[13];酵母缺失Ubp3(人USP10在酵母中的同源基因)后,复制寿命缩短,约为野生型的70%[21]。已知人USP10参与核糖体的回收,其与G3BP1形成的复合物可作用于单泛素化的核糖体蛋白RPS2、RPS3和RPS10,防止核糖体40S亚基的降解[13]。弓形虫中有33种核糖体蛋白质可发生泛素化,其中包括TgRPS2和TgRPS3[4],推测TgUSP10可能参与这些核糖体蛋白的去泛素化从而发挥调节作用,其缺失促进了核糖体蛋白的降解,进而限制了弓形虫的生长速度。
综上,本试验明确了TgUSP10的亚细胞定位及其在弓形虫体外增殖中发挥的重要作用,为后续进一步阐明其功能和作用机制奠定了基础。

