新城疫、禽流感和禽腺病毒病三联嵌合型病毒样颗粒的构建及鉴定
冯嘉轩,陈凯楠,李金斗,丁佳欣,陈铭桦,邵亚男,郭春红,邹映雪,丁 壮*
(1.吉林大学 动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062;2.长春中医药大学 临床医学院,吉林 长春 130117)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)强毒株引起的高度接触性和致死性传染病,分子流行病学调查结果显示NDV在我国主要流行的基因型为基因Ⅶ型[1-2];禽流感(avian influenza,AI)是由正黏病毒科、A型流感病毒属中不同亚型流感病毒(avian influenza virus,AIV)引起的禽类病毒病,其中H9N2亚型禽流感已高度适应禽类,分离率位于AIV各亚型之首[3];禽腺病毒病(avian adenovirus disease)是由禽腺病毒(fowl adenoviruses,FAdV)引起的危害我国家禽养殖业的主要动物疫病之一,其在我国主要流行株是Ⅰ群血清4型FAdV[4]。因此,预防和控制基因Ⅶ型ND、H9N2亚型AI和4型FAdV病对我国家禽养殖业的发展具有重要意义。但传统疫苗的安全性、免疫原性、疫苗毒株与流行毒株基因不匹配的问题极大地限制了传统疫苗的免疫保护效果及应用前景,常规疫苗的升级和换代已成为行业发展亟需。NDV HN蛋白、AIV的HA蛋白和FAdV Fiber2蛋白已被发掘成为亚单位疫苗研发的靶点[5-7],但亚单位疫苗无法刺激机体产生有效的细胞免疫应答,针对胞内寄生病毒的防控效力有限,因此提高HN、HA和Fiber2蛋白的免疫原性(尤其是诱导细胞免疫应答的能力)已成为ND、AI和FAdV病新型疫苗研发的核心突破点。
病毒样颗粒(virus-like particles,VLPs)是由病毒的1个或几个结构蛋白组装成的空心蛋白颗粒,不含有感染性遗传物质,表面可高密度的展现抗原蛋白,能刺激机体产生高效的体液免疫和细胞免疫应答,是新型疫苗研发的优选靶点。NDV病毒样颗粒(Newcastle disease virus like particles,ND VLPs)是以NDV的M蛋白为骨架、表面展示HN或F蛋白的有囊膜纳米颗粒。已有研究表明,ND VLPs易被树突状细胞(dendritic cells,DC)识别及加工,经TLR4/NF-κB信号通路诱导DC成熟及CCR7-CCL19/CCL21轴促进DC迁移[8],最终将抗原信息递呈给T细胞,弥补了亚单位疫苗免疫原性不足的缺点。此外,本团队已开发并完善了ND VLPs载体平台,成功将传染性法氏囊病毒VP2蛋白、绵羊痘病毒P32蛋白和布鲁菌BCSP31蛋白等展现在ND VLPs囊膜表面,所构建的嵌合病毒样颗粒疫苗可针对外源靶蛋白产生特异性的体液免疫应答并能诱导机体产生高效的细胞免疫应答[9-10]。因此,本试验拟基于ND VLPs载体平台,以NDV的HN蛋白、AIV的HA蛋白和FAdV Fiber2蛋白为靶点,研发一种安全、高效且可“一针多防”的“新流腺”病毒样颗粒疫苗候选株,以便科学防控ND、AI和FAdV病。
1 材料与方法
1.1 细胞与载体Sf9昆虫细胞、E.coliDH10Bac感受态细胞、穿梭质粒pFastBac1均由本室冻存;rBV-NDV M、rBV-NDV HN和rBV-HA由本实验室前期构建及冻存;Trans1-T1感受态细胞购自北京全式金生物技术股份有限公司。
1.2 主要试剂BamHⅠ、KpnⅠ限制性内切酶购自北京宝日医生物技术有限公司;X-treme GENEHP DNA Transfection Reagent购自瑞士罗氏公司;TransTaq®DNA聚合酶、T4DNA连接酶、羊抗兔IgG(H+L)-FITC抗体和pEASY®-Uni无缝克隆试剂盒购自北京全式金生物技术有限公司;羊抗兔IgG-HRP购自ImmunoWay公司;FBS胎牛血清购自依科赛生物公司;昆虫培养基Sf-900Ⅱ SFM购自Gibco公司;兔抗Fiber2蛋白多克隆抗体由本实验室制备并保存。
1.3 基因合成及优化为提高抗原蛋白的表达量,根据昆虫细胞密码子偏好性对禽4型腺病毒HB1510株的Fiber2基因(GenBank登录号:KU587519.1)基因进行密码子优化,并在基因起始密码子前引入促进mRNA翻译的Kozac序列,改造后的序列由上海生工生物工程股份有限公司合成。
1.4 引物设计及合成根据密码子优化后的序列、pFastBac1序列、NDV NA-1株(GenBank登录号:DQ659677.1)HN基因胞内域及跨膜域序列和柔性肽Linker(G4S)3序列设计引物,引物序列见表1。

表1 引物序列信息
1.5 重组穿梭质粒的构建以rBV-ND HN基因组为模板,利用引物cFiber2-1F和cFiber2-2R扩增HN基因胞内域、跨膜域及部分柔性肽序列,命名为cHN-GS;以密码子优化后的Fiber2基因为模板,利用引物cFiber2-3F和cFiber2-4R扩增含有剩余柔性肽序列的Fiber2基因,命名为cGS-Fiber2。采用BamHⅠ和KpnⅠ双酶切pFastBac1空载体并回收线性化载体,按照无缝克隆试剂盒操作说明书将目的片段与线性载体进行连接构建重组穿梭质粒rpFastBac1-cFiber2,转化至Trans1-T1感受态细胞中,涂板于含有100 mg/L Amp抗性筛选平板中,挑取单菌落利用cFiber2-1F和cFiber2-4R引物进行PCR鉴定,并提取质粒利用BamHⅠ和KpnⅠ双酶切进行鉴定。
1.6 重组杆粒的筛选将鉴定正确的重组穿梭质粒rpFastBac1-cFiber2转化至E.coliDH10Bac感受态细胞中构建重组杆粒rBmid-cFiber2,涂板于固体LB筛选平板(含100 mg/L X-gal、40 mg/L IPTG、20 mg/L Tet、30 mg/L GM和100 mg/L Kan)中进行蓝白斑筛选;37℃培养箱中培养16~24 h,挑取纯净白斑,利用M13通用引物和特异性引物(cFiber2-1F和cFiber2-4R)进行鉴定;将鉴定正确的菌落再次划线至固体LB筛选平板中,直至生长出的菌落全为白斑或PCR结果均为完全同源重组条带。
1.7 重组杆状病毒的拯救及鉴定
1.7.1重组杆状病毒的拯救 参照杆粒提取方法[11]提取重组杆粒rBmid-cFiber2,测定浓度后-80℃ 保存备用。将Sf9细胞铺板于6孔板中,待细胞生长至80%左右时开始进行转染,具体如下:将X-treme GENE HP DNA Transfection Reagent室温平衡15 min;在1.5 mL离心管中加入100 μL sf-900Ⅱ SFM培养基,加入2 μg的重组杆粒rBmid-cFiber2,重复混匀后加入6 μL转染试剂,混匀后室温静置20 min;将转染复合物小心滴加入至细胞孔中,置于27 ℃培养箱中培养96~120 h。收取第1代重组杆状病毒rBV-cFiber2培养上清,取500 μL 加入至80%细胞密度的10 cm平板中,96~120 h后收取第2代重组杆状病毒,按照2%的比例接种至昆虫细胞中继续盲传。
1.7.2重组杆状病毒的鉴定 参照基因组提取试剂盒说明书提取第3代重组杆状病毒基因组,利用M13通用引物和特异性引物进行PCR鉴定,并利用间接免疫荧光试验检测蛋白表达情况:将Sf9细胞铺板于含有细胞爬片的24孔板中,待细胞生长至80%~90%时,以MOI=1接种第3代重组杆状病毒rBV-cFiber2,48 h后弃掉培养上清,经4%多聚甲醛溶液固定、0.1% Triton X-100通透、1% BSA溶液封闭、孵育兔抗Fiber2多克隆抗体、孵育羊抗兔IgG(H+L)-FITC抗体和DAPI染核后,利用荧光显微镜检测结果。
1.8 “新流腺”三联嵌合型cVLPs的组装及鉴定将Sf9细胞进行悬浮培养,待细胞密度生长至3×106/mL时,将杆状病毒以MOI=5(rBV-M∶rBV-HN∶rBV-HA∶rBV-cFiber2=3∶1∶1∶1)共感染至悬浮培养的Sf9细胞中构建“新流腺”三联嵌合型病毒样颗粒(ND-AI-FAdV4 cVLPs),72 h后收集细胞上清,利用蔗糖密度梯度超速离心纯化ND-AI-FAdV4 cVLPs。利用Western blot分析ND-AI-FAdV4 cVLPs各组分蛋白表达情况,利用透射电镜分析ND-AI-FAdV4 cVLPs形态结构。
2 结果
2.1 目的基因的扩增扩增含有NDV HN胞内域及跨膜域和部分柔性肽序列的cHN-GS(178 bp)及含有剩余柔性肽序列和Fiber2基因的cGS-Fiber2(1 474 bp),并回收pFastBac1线性化载体(4 673 bp),电泳结果表明所扩增的基因与理论值相符(图1)。

A.cHN-GS扩增及鉴定;B.cGS-Fiber2扩增及鉴定;C.pFastBac1载体双酶切鉴定。M.DL2000 DNA Marker;A1,B1,C1.扩增产物
2.1 重组穿梭质粒构建及鉴定将cHN-GS、cGS-Fiber2和pFastBac1线性化载体进行连接构建重组穿梭质粒rpFastBac1-cFiber2,利用PCR鉴定并采用BamHⅠ和KpnⅠ双酶切鉴定。PCR结果显示扩增条带大小与理论值(1 641 bp)相符(图2A);双酶切结果显示目的片段(1 636 bp)和载体片段(4 673 bp)均与电泳条带相符(图2B)。
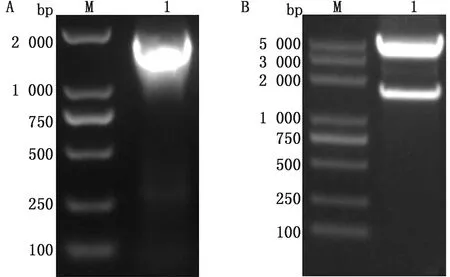
A.rpFastBac1-cFiber2 PCR扩增鉴定;B.rpFastBac1-cFiber2双酶切鉴定
2.2 重组杆粒筛选及鉴定将重组穿梭质粒rpFastBac1-cFiber2转化至E.coliDH10Bac感受态细胞中构建重组杆粒rBmid-cFiber2,利用M13通用引物和特异性引物进行鉴定。M13通用引物PCR结果显示扩增条带与理论值(约4 140 bp)相符;特异性引物PCR结果显示扩增条带与理论值(1 641 bp)相符(图3)。
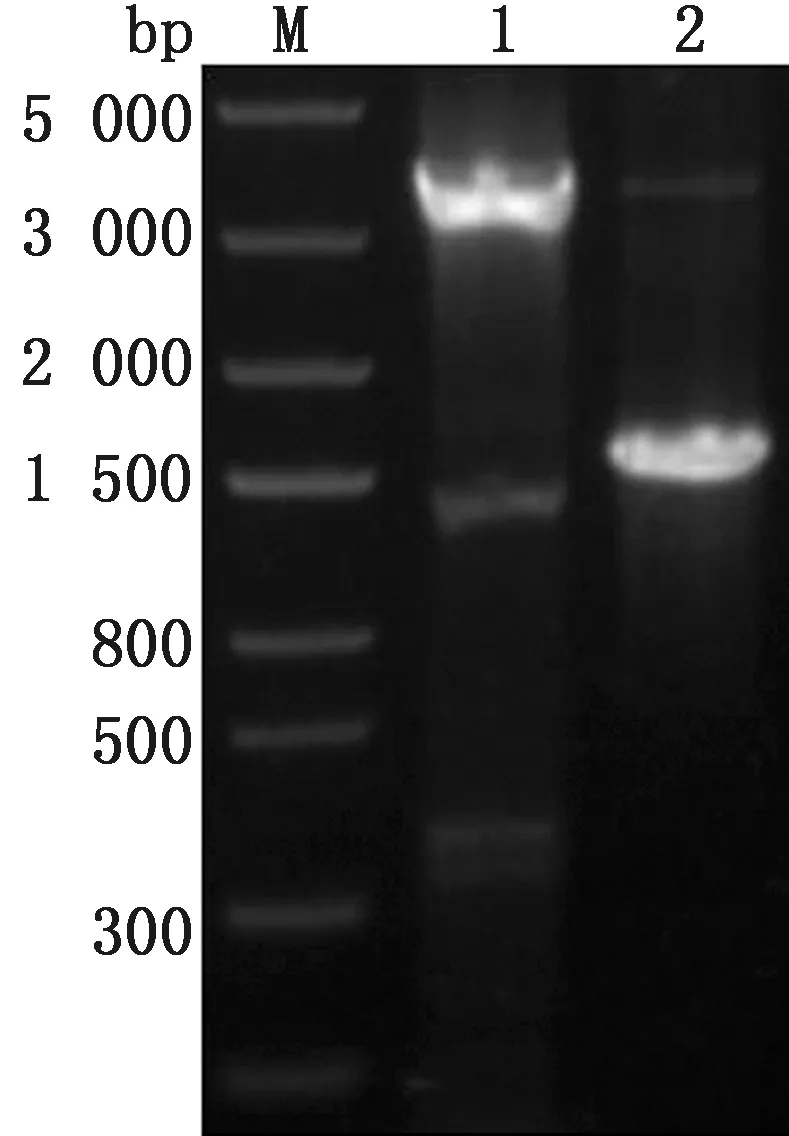
M.DL5000 DNA Marker;1.M13通用引物PCR扩增;2.特异性引物PCR扩增
2.3 重组杆状病毒的构建及鉴定
2.3.1细胞病变 将重组杆粒rBmid-cFiber2转染至Sf9昆虫细胞中进行重组杆状病毒(rBV-cFiber2)的拯救,盲传3代,期间观察细胞病变效应(CPE)。结果显示,相较于对照组,rBV-cFiber2感染组细胞出现明显皱缩、崩解、脱落等现象(图4)。
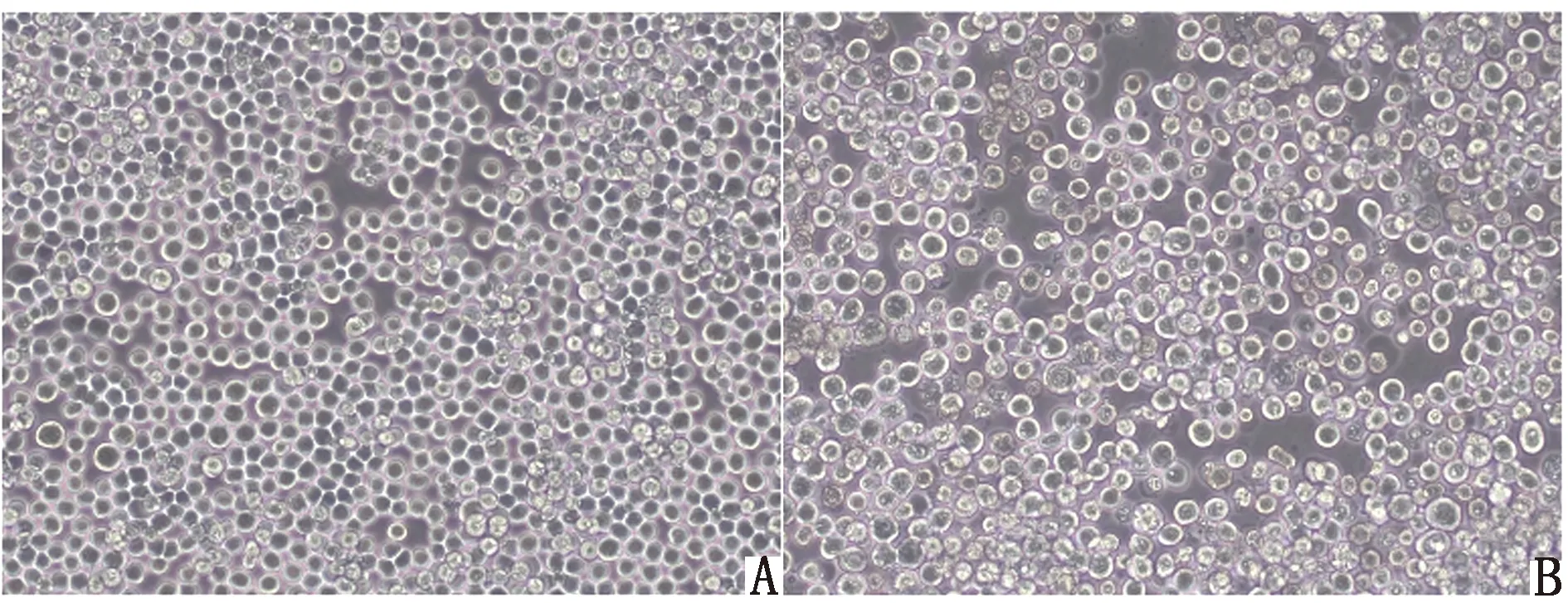
A.对照组Sf9昆虫细胞;B.rBV-cFiber2感染组Sf9昆虫细胞
2.3.2PCR鉴定 提取第3代重组杆状病毒基因组,利用M13通用引物和特异性引物进行鉴定。结果显示,M13通用引物PCR结果(约4 140 bp)和特异性引物PCR结果(1 641 bp)与理论值相符(图5)。

M.DL5000 Plus DNA Marker;1.M13通用引物PCR扩增产物;2.特异性引物PCR扩增产物
2.3.3间接免疫荧光鉴定 利用间接免疫荧光试验检测cFiber2蛋白在昆虫细胞中的表达情况,结果显示rBV-cFiber2感染组几乎所有细胞均能检测到绿色荧光信号,表明重组杆状病毒能够正确表达目的蛋白(图6)。
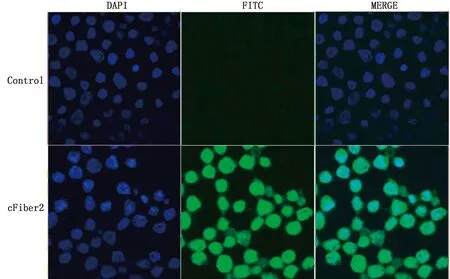
图6 间接免疫荧光鉴定
2.4 ND-AI-FAdV4 cVLPs的组装及鉴定
2.4.1ND-AI-FAdV4 cVLPs蛋白组分分析 利用免疫印迹试验分析ND-AI-FAdV4 cVLPs各组分蛋白表达情况,结果显示NDV基质蛋白M约为40 kDa,NDV HN蛋白约为70 kDa,AIV HA蛋白约为70 kDa,FAdV4 cFiber2蛋白约为60 kDa,表明ND-AI-FAdV4 cVLPs各组分蛋白均正确表达(图7)。
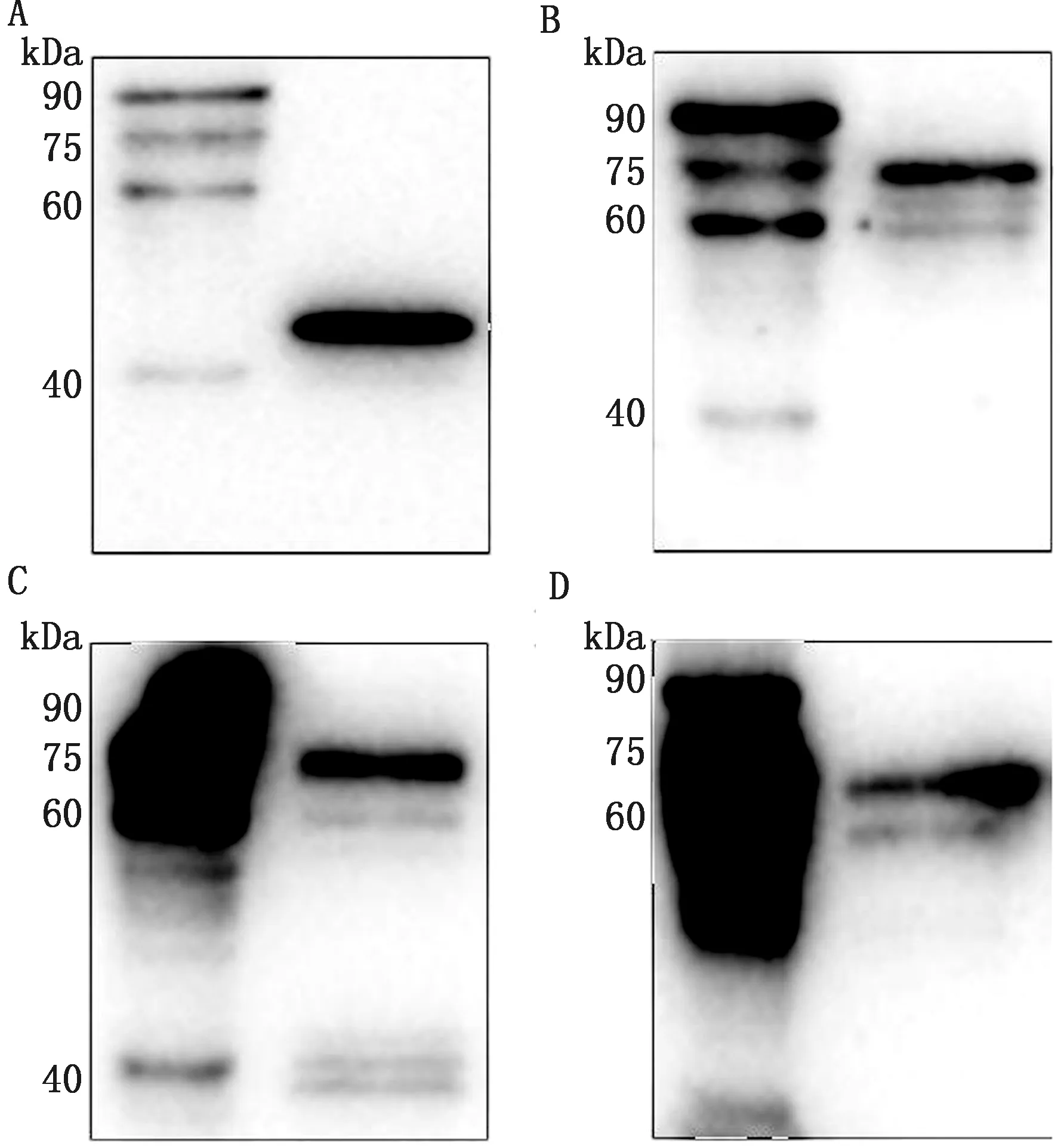
A.M蛋白免疫印迹分析;B.HN蛋白免疫印迹分析;C.HA蛋白免疫印迹分析;D.Fiber2蛋白免疫印迹分析
2.4.2ND-AI-FAdV4 cVLPs形态分析 利用透射电镜分析ND-AI-FAdV4 cVLPs形态,结果可见大小约为100 nm、外有囊膜和纤突、内无核酸的空心纳米颗粒(图8)。
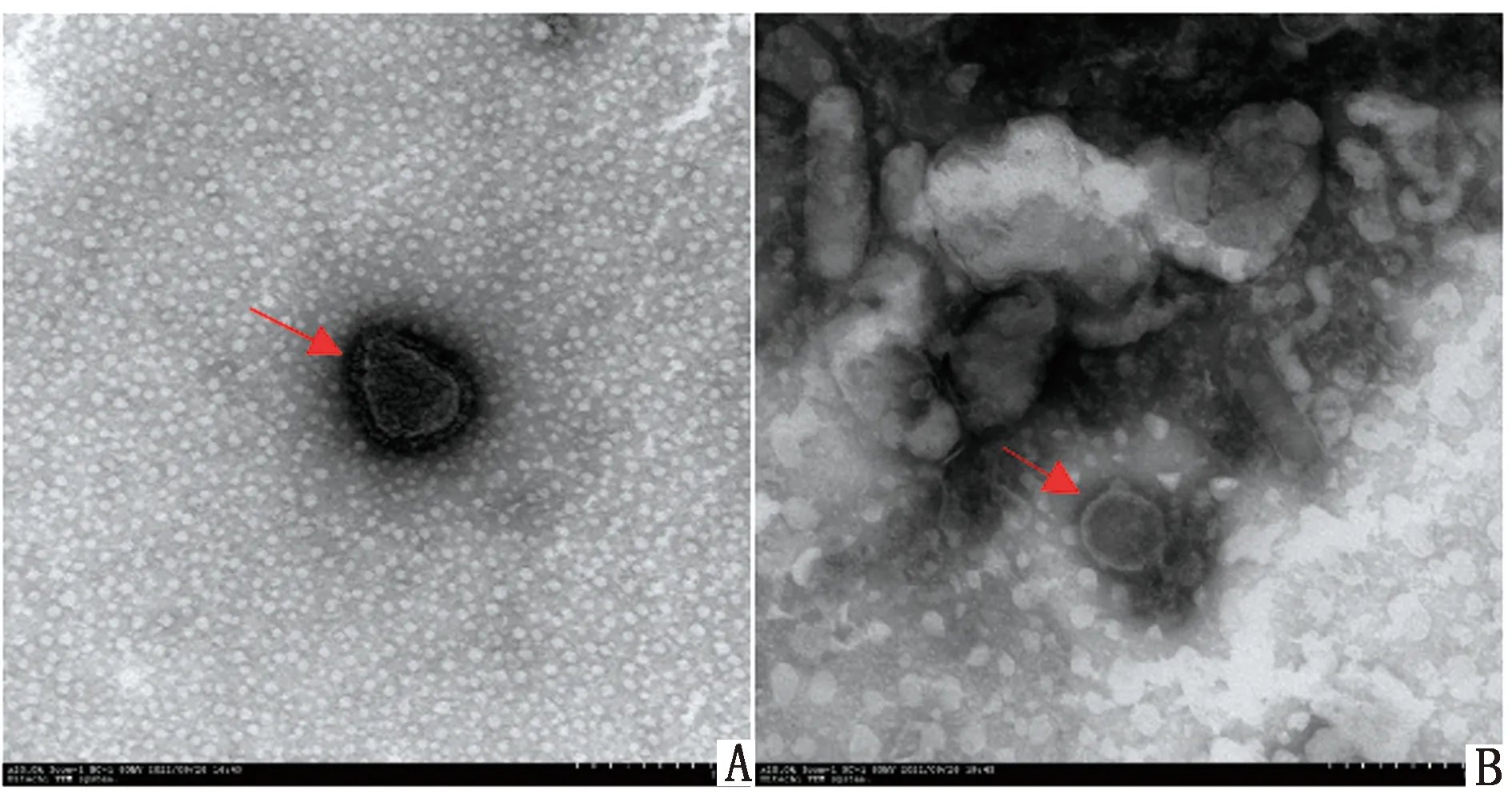
A.NDV活毒株电镜结构;B.ND-AI-FAdV4 cVLPs电镜结构
3 讨论
ND、AI和FAdV4病是威胁我国家禽养殖业最主要的动物疫病。ND在我国鸡群中主要流行的是基因Ⅶ型强毒株,其中Ⅶd和Ⅶe为优势流行亚型[1-2],目前使用疫苗毒株主要为基因Ⅱ型,各基因型之间存在抗原差异,疫苗毒株与流行毒株基因型的不匹配限制了疫苗的免疫保护效果。H9N2已是AI众多亚型中流行最广的基因型,并且已突破种间屏障,无需中间宿主也可感染人类[3],因此预防和控制H9N2亚型AIV无论是对于促进家禽养殖业的发展还是维护公共卫生安全均意义重大,但对于预防H9N2亚型AI主要是采用灭活疫苗,例如以AIV A/Chicken/Guangdong/SS/94株、A/Chicken/Shandong/6/96株和A/Chicken/Shanghai/F/98株研制的灭活疫苗。FAdV4的感染引起的肝炎-心包积液综合征(hydropericardium-hepatitis syndrome,HHS)自2015年7月以来在中国多地暴发,并迅速蔓延至全国各地,已占据流行主导地位,肉鸡的病亡率高达40%~90%,严重威胁我国家禽养殖业[12-13]。农业农村部在2021年6月批准的鸡ND、AI(H9亚型)、FAdV(Ⅰ群4型)三联灭活疫苗(La Sota株+YBF13株+YBAV-4株)才填补了我国FAdV疫苗的空白。然而,弱毒疫苗存在毒力返强或疫苗株扩散等生物安全风险和灭活疫苗存在免疫原性不足的缺点,与流行毒株基因型相匹配的新型疫苗的研发已成为农业高效、绿色生产关键技术的核心急需突破。病毒的结构蛋白例如NDV HN蛋白、AIV HA蛋白和FAdV4 Fiber2蛋白具有开发成为新型疫苗的潜力[5-7],但单一抗原成分无法刺激机体产生足够的免疫应答,因此提高亚单位蛋白的免疫原性(包括体液免疫和细胞免疫)决定了新型疫苗是否能够提供有效保护。确保蛋白质正确折叠和翻译后修饰(PTM)以及借助高效递送载体是诱导适当免疫反应的必要条件。昆虫杆状病毒表达系统能够保证在高表达量的前提下,对蛋白质进行正确修饰,使其天然活性与哺乳动物细胞表达的蛋白类似,是新型疫苗研发的理想表达系统。鉴于当前上市疫苗已不能满足多种类、多基因型的疫病防控需求,为推动ND、AI和FAdV4病的科学联合防控及进一步的种群净化,研发一种生态、高效(可诱导高效的体液及细胞免疫)且可“一针多防”的新型疫苗至关重要。
病毒样颗粒(VLPs)由于本身不含有感染性核酸,可重复高密度的展现表面抗原,是新型疫苗的研发热点。目前多种VLPs的疫苗已上市,包括针对人乳头瘤病毒(HPV)的疫苗(Cervarix®、Gardasil®和Gardasil9®)和针对乙型肝炎病毒(HBV)的疫苗Sci-B-VacTM等。2017年上市的猪圆环病毒样颗粒“圆柯欣”也是兽用VLPs疫苗领域的典型代表。此外,VLPs还可作为递送外源蛋白的理想载体,可借助自身特性将外源蛋白抗原信息传递至抗原递呈细胞而促进免疫应答反应。将严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)的刺突蛋白(S)展现在H5N1基质蛋白(M1)组装的VLPs表面而构建的嵌合病毒样颗粒(SM),与AL/CpG佐剂联合使用可刺激动物产生持续的高水平抗体和细胞免疫应答,并建立有效的保护屏障,能保护小鼠免受SARS-CoV-2小鼠适应株的攻击[14]。ND VLPs同样也是一种递送外源抗原信息的良好载体,如将呼吸道合胞体病毒(RSV)的G蛋白与NDV HN蛋白胞内域及跨膜域串联表达后,均能正确组装出展示异源抗原成分的ND VLPs[15]。本团队也开发并完善了ND VLPs作为疫苗递送载体平台,证实ND VLPs能够诱导机体产生比亚单位抗原组分更高的体液及细胞免疫应答,例如将布鲁菌BCSP31蛋白展现在与ND VLPs表面而组装的嵌合型VLPs(cVLPs-GPI-BCSP31),cVLPs-GPI-BCSP31可在体内、体外诱导树突状细胞(DCs)活化及迁移,提供比BCSP31亚单位疫苗更有效的免疫保护力[9]。
综上,鉴于当前家禽疫病流行情况及防控需求,本试验基于昆虫杆状病毒表达系统和ND VLPs载体平台,将AI H9N2株HA基因、FAdV4 Fiber2嵌合至ND VLPs载体表面进而成功构建“新流腺”三联嵌合型VLPs(ND-AI-FAdV4 cVLPs),为ND、AI和FAdV病的绿色、高效且可“一针多防”的VLPs疫苗的应用奠定了基础。

