地佐辛通过上调miR-204-3p减轻LPS诱导的心肌细胞H9C2损伤
鲁美静 文怀昌 汪 懿 王梦丽 张恺辰 陈永权
(安徽省芜湖市皖南医学院弋矶山医院麻醉科,芜湖 241000)
1 材料与方法
1.1材料 大鼠心肌细胞系H9C2(上海越研生物科技公司);胎牛血清(FBS,浙江天杭生物科技股份有限公司);RPMI1640培养基、细胞计数试剂盒-8(CCK-8)、LipofectamineTM2000试剂盒、Annexin VFITC/PI细胞凋亡试剂盒和二喹啉甲酸(BCA)蛋白检测试剂盒(北京索莱宝科技有限公司);Trizol试剂(美国Invitrogen公司);PCR引物、miR-204-3p抑制剂(anti-miR-204-3p组)及抑制剂阴性序列(antimiR-NC,上海生工生物工程有限公司);逆转录试剂盒和PCR试剂盒(深圳晶美生物工程有限公司);兔抗鼠细胞周期蛋白D1(CyclinD1)、p21、B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2相关蛋白(Bax)多克隆抗体(美国Santa Cruz公司);乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽还原酶(GSH-Px)试剂盒(南京建成生物工程研究所)。
1.2方法
1.2.1细胞培养和转染 复苏H9C2细胞,采用含10%FBS的RPMI1640培养基培养。取对数生长期H9C2细胞以1×105个/孔接种于6孔板,采用LipofectamineTM2000脂质体法分别转染anti-miR-204-3p、anti-miR-NC,6 h后更换培养基再培养24 h,收集细胞备用。
1.2.2细胞分组处理 未转染细胞分为对照组(Con组)、LPS组和不同剂量(4、8、16 µmol/L)地佐辛组,其中Con组细胞用常规培养基培养,LPS组细胞用含1µg/ml LPS的培养基培养,不同剂量地佐辛组细胞分别用含4、8、16 µmol/L地佐辛与含LPS的培养基共同培养[5]。转染anti-miR-NC、anti-miR-204-3p的细胞均用含16 µmol/L地佐辛和1 µg/ml LPS的培养基共同培养,分别记为16 µmol/L地佐辛+anti-miR-NC组 和16 µmol/L地 佐 辛+anti-miR-204-3p组。
1.2.3CCK-8检测细胞增殖 将细胞以5×103个/孔接种于96孔板,按1.2.2分组处理。培养24 h后,加入10µl CCK-8溶液孵育2 h,酶标仪检测450 nm处光密度(OD)值。
1.2.4流式细胞仪检测细胞凋亡情况 将细胞以
2.5×104个/孔接种于24孔板,按1.2.2分组处理。培养24 h后收集细胞,PBS清洗2次。参照AnnexinⅤ-FITC/PI试剂盒说明书,采用流式细胞仪检测细胞凋亡。
1.2.5Western blot检测CyclinD1、p21、Bcl-2和Bax蛋白表达 将细胞以2.5×104个/孔接种于24孔板,按1.2.2分组处理。培养24 h后收集细胞,PBS清洗2次,加入RIPA试剂提取细胞总蛋白,BCA法进行蛋白定量,行SDS-PAGE电泳,转至PVDF膜,5%脱脂奶粉溶液封闭1 h,分别置于CyclinD1(1∶500)、p21(1∶500)、Bcl-2(1∶1 000)和Bax(1∶1 000)一抗孵育液中4℃孵育过夜,置于山羊抗兔二抗(1∶2 000)孵育液中7℃孵育1 h,加入显影液避光显影,曝光拍照。
左达边笑边摇头,“没时间了,离开这是非之地,你转告张仲平,如果有来世,我会和他成为最好的朋友,现在,在我跳楼之前,你,快滚!”
1.2.6试剂盒检测LDH、MDA、SOD和GSH-Px水平 将 细胞以2.5×104个/孔接 种 于24孔 板,按
1.2.2分组处理。培养24 h后收集细胞上清和细胞,将上清3 500 r/min离心10 min,保留上清,按照LDH试剂盒说明书检测上清中LDH水平。细胞中加入细胞裂解液充分裂解,3 500 r/min离心10 min,保留上清,参照MDA、SOD和GSH-Px试剂盒说明书检测其水平。
1.2.7RT-qPCR检测miR-204-3p表达 将细胞以
2.5×104个/孔接种于24孔板,按1.2.2分组处理。培养24 h后收集细胞,Trizol试剂提取细胞总RNA,逆转录为cDNA,进行PCR扩增。扩增条件:95℃5 min,95℃10 s,60℃30 s,72℃30 s,共35个循环。引物序列为miR-204-3p F:5'-GTTTGCTGGGAAGGCAAAG-3',R:5'-TGTTTTGCTGGGAAGGCAAA-3';内参U6 F:5'-GTCCAAGGCGCTAGAGCGCAGCT-3',R:5'-CGAATGCTAAGGCTCTCGAC-3'。2-ΔΔCt法计算miR-204-3p相对表达。
1.3统计学分析 采用SPSS22.0软件分析数据,计量资料以xˉ±s表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1地佐辛对LPS诱导的H9C2细胞增殖和凋亡的影响 与Con组比较,LPS组H9C2细胞OD值及CyclinD1、Bcl-2蛋白表达降低(P<0.05),细胞凋亡率及p21、Bax蛋白表达升高(P<0.05)。与LPS组比较,不同剂量地佐辛组H9C2细胞OD值及CyclinD1、Bcl-2蛋白表达升高(P<0.05),细胞凋亡率及p21、Bax蛋白表达降低(P<0.05),且呈剂量依赖性(P<0.05,图1、表1)。
表1 地佐辛对LPS诱导的H9C2细胞增殖和凋亡的影响(±s,n=3)Tab.1 Effect of dezocine on proliferation and apoptosis of H9C2 cells induced by LPS(±s,n=3)
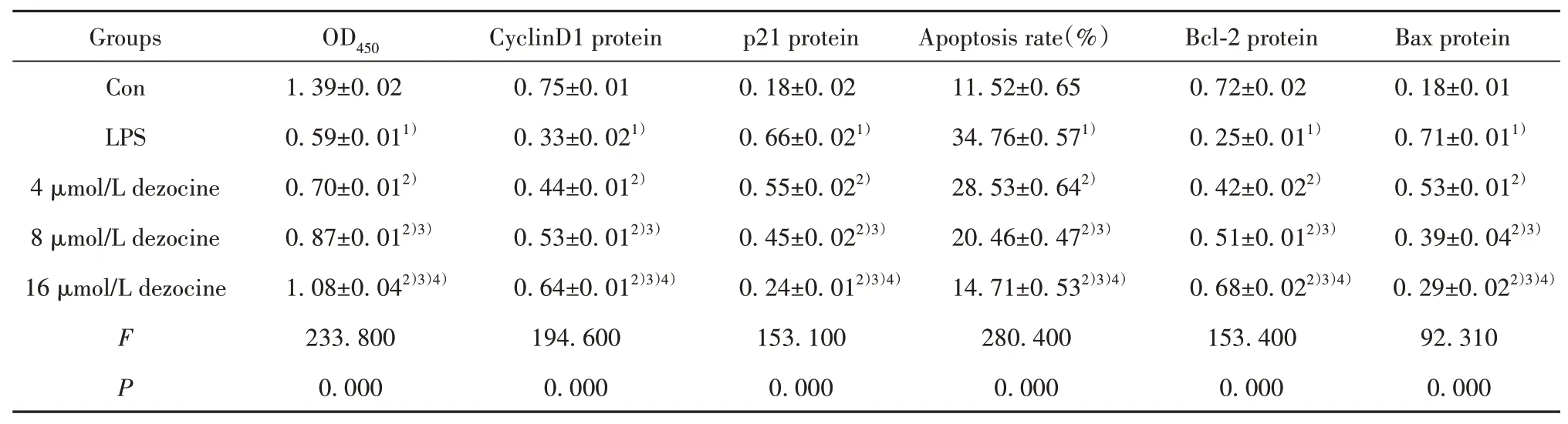
表1 地佐辛对LPS诱导的H9C2细胞增殖和凋亡的影响(±s,n=3)Tab.1 Effect of dezocine on proliferation and apoptosis of H9C2 cells induced by LPS(±s,n=3)
Note:Compared with Con group,1)P<0.05;compared with LPS group,2)P<0.05;compared with 4 µmol/L dezocine group,3)P<0.05;compared with 8µmol/L dezocine group,4)P<0.05.
?
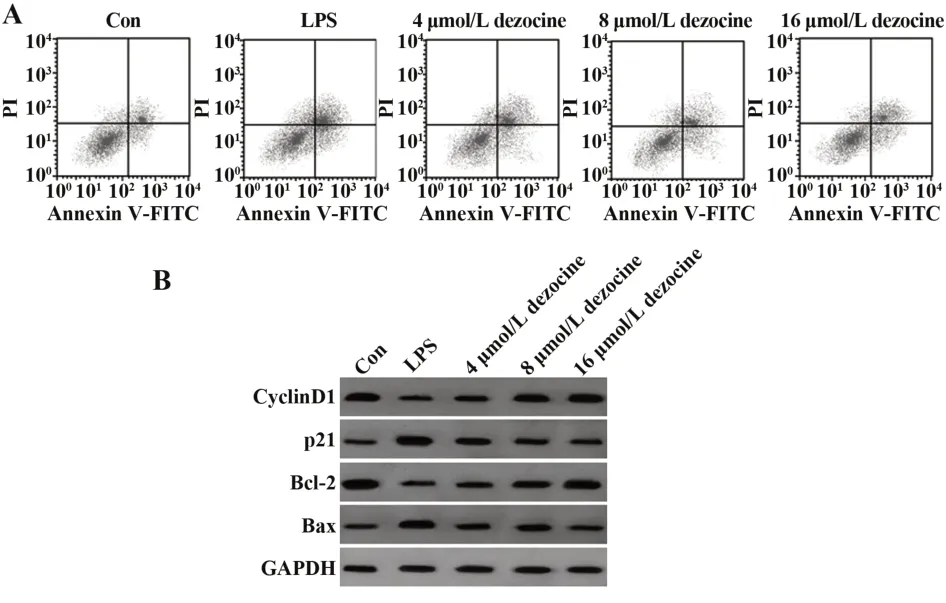
图1 地佐辛对LPS诱导的H9C2细胞凋亡及增殖、凋亡相关蛋白表达的影响Fig.1 Effect of dezocine on LPS-induced H9C2 cells apoptosis and expressions of proliferation and apoptosisrelated proteins
2.2地佐辛对LPS诱导的H9C2细胞氧化应激的影响 与Con组比较,LPS组H9C2细胞MDA含量及培养上清中LDH含量升高(P<0.05),细胞中SOD和GSH-Px活性降低(P<0.05)。与LPS组比较,不同剂量地佐辛组H9C2细胞MDA含量及培养上清中LDH含量降低(P<0.05),细胞中SOD和GSH-Px活性升高(P<0.05),且呈剂量依赖性(P<0.05,表2)。
表2 地佐辛对LPS诱导的H9C2细胞氧化应激的影响(±s,n=3)Tab.2 Effect of dezocine on oxidative stress of LPS-induced H9C2 cells(±s,n=3)

表2 地佐辛对LPS诱导的H9C2细胞氧化应激的影响(±s,n=3)Tab.2 Effect of dezocine on oxidative stress of LPS-induced H9C2 cells(±s,n=3)
Note:Compared with Con group,1)P<0.05;compared with LPS group,2)P<0.05;compared with 4 µmol/L dezocine group,3)P<0.05;compared with 8µmol/L dezocine group,4)P<0.05.
?
2.3地佐辛对LPS诱导的H9C2细胞miR-204-3p表达的影响 与Con组比较,LPS组H9C2细胞miR-204-3p表达降低(P<0.05)。与LPS组比较,不同剂量地佐辛组H9C2细胞miR-204-3p表达升高(P<0.05),且呈剂量依赖性(P<0.05,表3)。
表3 地佐辛对LPS诱导的H9C2细胞miR-204-3p表达的影响(±s,n=3)Tab.3 Effect of dezocine on expression of miR-204-3p in H9C2 induced by LPS(±s,n=3)
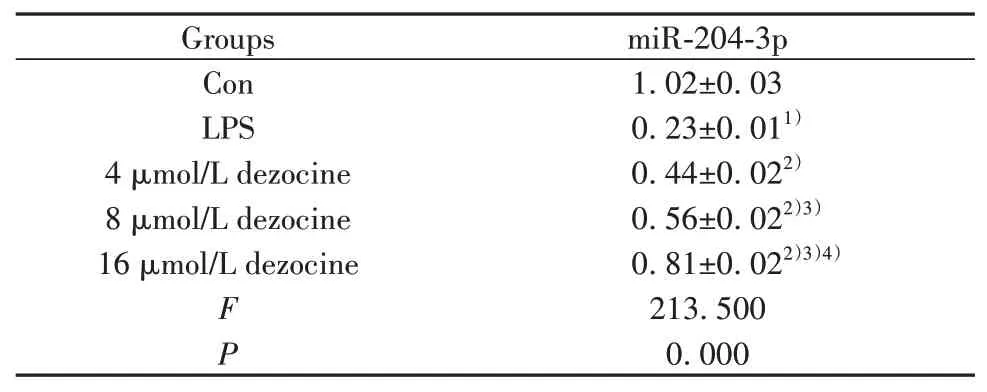
表3 地佐辛对LPS诱导的H9C2细胞miR-204-3p表达的影响(±s,n=3)Tab.3 Effect of dezocine on expression of miR-204-3p in H9C2 induced by LPS(±s,n=3)
Note:Compared with Con group,1)P<0.05;compared with LPS group,2)P<0.05;compared with 4 µmol/L dezocine group,3)P<0.05;compared with 8µmol/L dezocine group,4)P<0.05.
?
2.4干扰miR-204-3p表达逆转地佐辛对LPS处理的H9C2细胞增殖和凋亡的影响 与16 µmol/L地佐辛组或16 µmol/L地佐辛+anti-miR-NC组比较,16µmol/L地佐辛+anti-miR-204-3p组H9C2细胞OD值及CyclinD1、Bcl-2蛋白表达降低(P<0.05),细胞凋亡率及p21、Bax蛋白表达升高(P<0.05),而16 µmol/L地佐辛组或16 µmol/L地佐辛+anti-miRNC组各指标差异无统计学意义(P>0.05,图2、表4)。
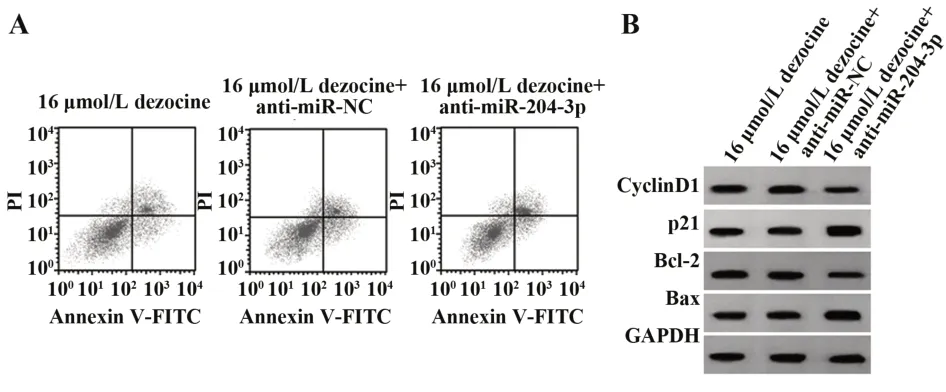
图2 干扰miR-204-3p表达逆转地佐辛对LPS诱导的H9C2细胞凋亡及增殖、凋亡相关蛋白表达的影响Fig.2 Interfering with miR-204-3p reversed effect of dezocine on LPS-induced H9C2 cells apoptosis and expressions of proliferation and apoptosis-related proteins
表4 干扰miR-204-3p表达逆转地佐辛对LPS处理的H9C2细胞增殖和凋亡的影响(±s,n=3)Tab.4 Interfering with miR-204-3p reverses effect of dezocine on proliferation and apoptosis of H9C2 cells induced by LPS(±s,n=3)
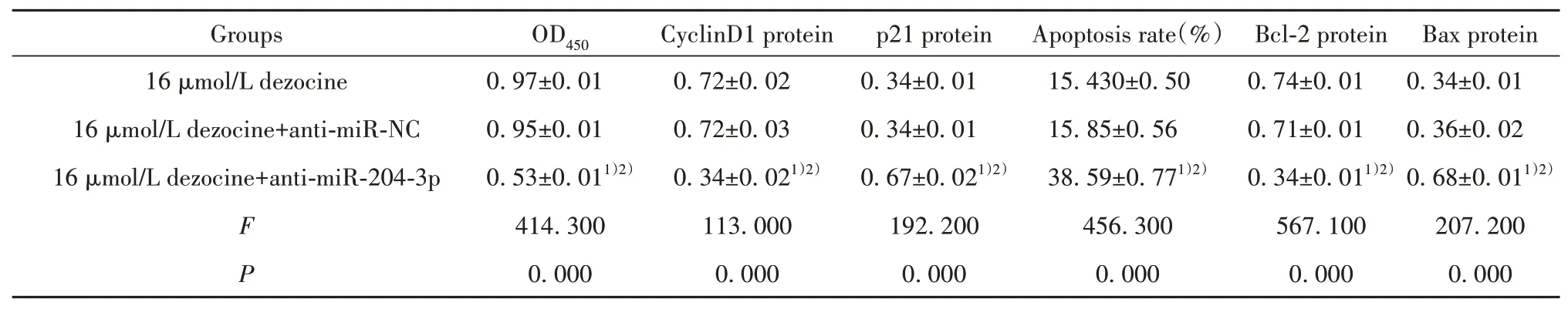
表4 干扰miR-204-3p表达逆转地佐辛对LPS处理的H9C2细胞增殖和凋亡的影响(±s,n=3)Tab.4 Interfering with miR-204-3p reverses effect of dezocine on proliferation and apoptosis of H9C2 cells induced by LPS(±s,n=3)
Note:Compared with 16µmol/L dezocine group,1)P<0.05;compared with 16µmol/L dezocine+anti-miR-NC group,2)P<0.05.
?
2.5干扰miR-204-3p表达逆转地佐辛对LPS诱导的H9C2细胞氧化应激的影响 与16 µmol/L地佐辛 组 或16 µmol/L地 佐 辛+anti-miR-NC组 比 较,16 µmol/L地 佐 辛+anti-miR-204-3p组H9C2细 胞MDA含量及培养上清中LDH含量升高(P<0.05),细胞SOD和GSH-Px活性降低(P<0.05),而16 µmol/L地佐辛组或16 µmol/L地佐辛+anti-miR-NC组各指标差异均无统计学意义(P>0.05,表5)。
表5 干扰miR-204-3p表达逆转地佐辛对LPS诱导的H9C2细胞氧化应激的影响(±s,n=3)Tab.5 Interfering with miR-204-3p reverses effect of dezocine on oxidative stress of H9C2 cells induced by LPS(±s,n=3)

表5 干扰miR-204-3p表达逆转地佐辛对LPS诱导的H9C2细胞氧化应激的影响(±s,n=3)Tab.5 Interfering with miR-204-3p reverses effect of dezocine on oxidative stress of H9C2 cells induced by LPS(±s,n=3)
Note:Compared with 16µmol/L dezocine group,1)P<0.05;compared with 16µmol/L dezocine+anti-miR-NC group,2)P<0.05.
?
3 讨论
LPS是革兰氏阴性菌细胞壁主要成分,可引起细胞凋亡、炎症反应和氧化应激等,导致多器官功能损伤,是建立心肌细胞损伤模型的常用诱导剂[6]。本研究显示,LPS可抑制H9C2细胞增殖,且促进其氧化应激和凋亡,与XU等[7]结果一致,说明LPS诱导的心肌细胞损伤模型建立成功。
地佐辛作为一种阿片受体激动-拮抗剂,常用于手术麻醉[8]。研究显示,地佐辛可能通过抑制HCN通道开放增加抗氧化应激相关蛋白Cu/Zn-SOD和Mn-SOD表达减少β淀粉样多肽诱发的原代大鼠皮质星形胶质细胞凋亡[9]。地佐辛可通过抑制Caspase-3表达和降低细胞氧化应激反应减轻大鼠脑缺血再灌注神经元损伤[10]。本研究显示,不同剂量地佐辛促进LPS诱导的H9C2细胞增殖,且抑制其凋亡。细胞增殖和凋亡受多种基因调控。CyclinD1是细胞周期调控蛋白,其表达升高可加速细胞周期进程,促进细胞增殖[11]。p21是细胞周期抑制因子,其表达增加则抑制细胞增殖[12]。Bax和Bcl-2参与调控细胞凋亡。Bax是促凋亡蛋白,其表达升高可加速细胞凋亡;而Bcl-2与Bax作用相反,其表达升高抑制细胞凋亡[13]。本研究显示,不同剂量地佐辛抑制了LPS诱导的H9C2细胞CyclinD1和Bax蛋白表达,促进p21和Bcl-2蛋白表达,进一步说明地佐辛可促进LPS诱导的H9C2细胞增殖,且抑制其凋亡。
氧化应激是心肌损伤的重要机制之一[14]。正常生理条件下,机体组织处于氧化和抗氧化动态平衡。病理条件下,机体组织自由基生成速率超过清除速率,产生氧化应激损伤。LDH是一种存在于细胞质的糖酵解酶。细胞受损时,细胞膜通透性增加,LDH被立即释放至细胞外,培养基中LDH活性高低可反映细胞受损程度[15]。MDA作为脂质过氧化产物之一,可反映机体组织氧化应激水平[16]。SOD和GSH-Px是机体内重要的抗氧化酶,可清除自由基,减轻自由基对机体组织的损伤[17]。本研究显示,不同剂量地佐辛降低了LPS诱导的H9C2细胞培养上清中LDH及细胞MDA水平,且提高了细胞SOD和GSH-Px活性,表明地佐辛减轻了LPS诱导的H9C2细胞氧化应激损伤。
作为一种miRNA,miR-204-3p参与多种疾病发展进程。目前对miR-204-3p的研究多集中于肿瘤。研究显示,miR-204-3p在结肠癌、乳头状甲状腺癌、肾细胞癌等肿瘤中表达下调,发挥抑癌基因作用[18-20];而miR-204-3p在口腔鳞状细胞癌和骨肉瘤等肿瘤中表达上调,促进肿瘤发展[21-22]。此外,miR-204-3p还参与非肿瘤发生发展。如HAN等[23]研究显示,miR-204-3p可靶向下调Bdkrb2表达抑制高糖诱导的足细胞凋亡,改善足细胞功能,为糖尿病肾病治疗提供了潜在靶点。本研究显示,LPS抑制H9C2细胞miR-204-3p表达,而地佐辛则促进LPS诱导的H9C2细胞miR-204-3p表达,且下调miR-204-3p表达逆转了地佐辛对LPS诱导的H9C2细胞增殖的促进作用及凋亡和氧化应激的抑制作用,提示地佐辛通过上调miR-204-3p表达促进LPS诱导的H9C2细胞增殖,且抑制其凋亡和氧化应激。
综上,地佐辛可抑制LPS诱导的心肌细胞凋亡和氧化应激,减轻心肌细胞损伤,其作用机制可能与上调细胞miR-204-3p表达有关。

