特发性肠系膜静脉硬化性结肠炎CT诊断价值
黄绍翠 刘传现
特发性肠系膜静脉硬化性结肠炎(idiopathic mesenteric phlebosclerosis colitis,IMP)又称静脉硬化性结肠炎,是一种罕见的缺血性肠病,临床上对此病认识不足,容易误诊、漏诊,该病无典型临床症状,但CT 征象比较典型,其影像表现结合肠镜检查有助于该病的诊治与随访。本次研究回顾性分析11 例IMP 患者CT 影像表现,以期为临床诊治提供帮助。
1 资料与方法
1.1 一般资料 收集2018 年3 月至2020 年12 月嘉兴市中医医院诊断为IMP 患者11 例,其中男性10 例、女性1 例;年龄50~75 岁,中位年龄62.82 岁。所有患者临床资料完整,均行螺旋CT 检查,并且其中3 例有肠镜检查。临床上病史较长,多为反复发作的腹部不适,可急性起病,多表现为恶心、呕吐、腹痛、腹胀,表现不典型,3 例为急性阑尾炎入院检查,8 例临床诊断为不全性肠梗阻行CT 检查。8 例有长期饮酒史,其中4 例饮五加皮酒;4 例有服用中药史(具体药物不详);2 例有肝硬化病史。
1.2 方法
1.2.1 CT检查 采用美国GE lightspeed 16 排螺旋CT 进行全腹部平扫,其中1 例行动脉期、静脉期、延迟期三期增强扫描。扫描参数:管电压120 kV,管电流180 mAs,扫描层厚7.5 mm,重建层厚2.5 mm,螺距1.0,矩阵512×512。增强检查:利用高压注射器经肘静脉注射碘佛醇对比剂(350 mg/ml),注射剂量3.0 ml/kg,注射速率2.5 ml/s。使用GE AW4.7后处理工作站进行后期重建。CT 资料由两名从事腹部疾病诊断的高年资诊断医生双盲法读片,最后统一意见给出结果。
1.2.2 肠镜检查 检查前2 天常规进食少渣半流质饮食,检查当天口服复方聚乙二醇电解质散导泻。采用日本富士能FUJINON4400 型电子结肠镜进行检查。检查时,常规插肠镜至回肠末端后,退镜逐段观察。肠镜检查表现由本院内镜中心副主任医师给出结果。
2 结果
2.1 CT 检查结果 所有患者升结肠均累及,1 例单纯累及升结肠,6 例累及升结肠及横结肠,4 例累及全结肠,其中1 例累及直肠;11 例皆见肠系膜静脉呈条状、线样钙化,其中2 例为随访后出现此征象,随访时间约2~3 年;11 例肠壁见较均匀分布的点状钙化,且结肠肠壁均有不同程度的水肿、增厚,其中2 例邻近小肠壁增厚,增强后肠壁无明显坏死,7 例呈不全性肠梗阻表现,4 例伴有肠系膜脂肪间隙模糊,3 例伴有肠系膜淋巴结增生。
2.2 肠镜检查及病理 3 例肠镜下可见肠壁溃疡、糜烂,并可见肠壁颜色改变,其中2 例可见紫蓝色,1 例病变肠壁同时出现黑色、紫蓝色改变,3 例见静脉曲张。肠黏膜充血水肿,见散在点状红斑,局部肠段僵硬。病理可见:肠壁内的血管壁及周围可见纤维化,静脉血管曲张,部分血管钙化,肠壁黏膜面见糜烂灶,严重者形成溃疡灶,其局部可见肉芽组织增生。部分肠管黏膜为慢性炎症改变,可伴固有膜间质小血管增生、玻璃样变。
2.3 IMP患者腹部特征性影像图见图1
由图1 a 可见,IMP 患者升结肠肠壁增厚,升结肠、横结肠管腔扩张,肠系膜静脉未见明显钙化,误诊为结肠炎;由图1 b 可见,3 年后该患者CT 复查见升结肠、横结肠壁厚,管腔扩张,肠系膜静脉较广泛钙化,诊断为IMP。
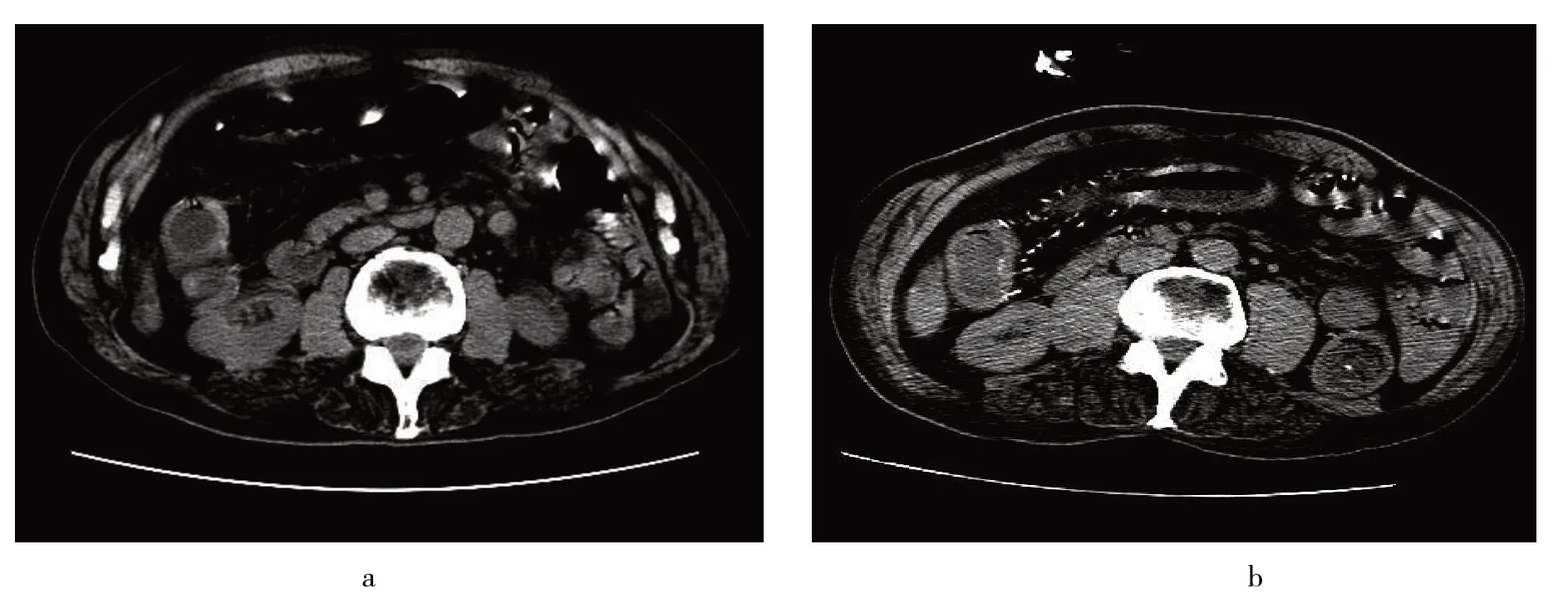
图1 IMP患者腹部CT图
3 讨论
临床IMP 罕见[1],最早报道见于90 年代日本学者Koyama 等[2]研究,Iwashita 等[3]总结多例患者的临床、病理学资料后,于2003 年将其命名为IMP。IMP 发病机制不明,文献报道以亚洲人居多,可能与亚洲地区生活、饮食习惯等关系密切,多篇文献报道IMP 与服用中草药有关[2,4,5]。本次研究中8 例长期饮酒,其中4 例长期饮用五加皮酒,另有4 例长期口服中药,在一定程度上支持以上观点。另外,肝硬化、门静脉高压与其变化是否有关[6],有待进一步研究。
IMP 多见于中老年人,文献报道女性多见,本次研究中男女比例10∶1,与文献报道不符,可能与病例报道较少有关,需进一步统计分析。IMP 病史多较长,长者可达数十年,初发症状无特异性,多慢性起病,表现为反复腹泻等症状,早期易漏诊、误诊;也可急性起病,多为恶心、呕吐、腹胀、腹痛等急腹症症状;或因停止排气、排便诊断为不全性肠梗阻;便血少见,肠穿孔更罕见,本组病例中未见肠穿孔。实验室检查可见大便隐血阳性,白细胞、C 反应蛋白可升高,与非特异性结肠炎无明显区别。
IMP 主要CT 征象表现为:①肠系膜静脉钙化:为特征性表现,IMP 即以肠系膜静脉硬化为主要病理改变,轴位扫描肠系膜静脉钙化可表现为条状、线样及点状,与血管走行一致,与肠管垂直或环绕肠管,重建以后显示更直观;结肠壁亦可见点状、分布较均匀钙化,有学者形象称其为“路灯征”[7],CT动脉血管造影检查有助于确定病变血管来源。部分患者早期CT 检查可无静脉钙化,仅表现为肠壁水肿、增厚,或者钙化较少,经过随访后可见静脉明显钙化,本次研究有2 例经2~3 年随访出现此征象;②受累肠管:以结肠为主,本次研究所有患者皆累及升结肠,部分患者累及升结肠及横结肠,甚至累及全结肠[8];少部分患者累及回肠末端,使回肠肠壁出现水肿、增厚;③不全性肠梗阻:IMP 多见肠腔扩张,肠壁早期可不厚,呈均匀的薄壁扩张,后期可见肠壁增厚,引起肠腔变窄,梗阻处近端肠腔扩张,可见积气及液平,小肠也可扩张积液,肠壁较均匀增厚,增强CT检查见均匀环形、分层强化;④肠系膜脂肪间隙模糊:因静脉钙化引起肠壁缺血,可引起结肠周围系膜反应性渗出,邻近腹膜模糊,脂肪密度增高;⑤淋巴结反应性增生:部分患者可见系膜淋巴结略大,直径多<10 mm[9]。
IMP 肠镜表现:①肠壁黏膜颜色:病变肠壁黏膜颜色可因静脉钙化、肠壁缺血发生改变,紫蓝色黏膜是本病的特征性表现[9,10],有学者描述为黑褐色、灰蓝色;②肠镜下可见结肠壁静脉曲张,黏膜充血水肿,随着病变进展为黏膜糜烂,严重者有大小不一、形态不规则溃疡形成,溃疡表面可见炎性渗出物;③肠腔扩张,管壁较僵硬,活动度较差。
综上所述,IMP 临床虽罕见,但是其具有特征性的CT 表现,如肠系膜静脉钙化,结肠壁内“路灯征”等,使得CT检查在定位、定性方面具有重要作用,结合患者临床病史,可对处于不同阶段的IMP 作出较准确诊断,并可用于随访。

