脑桥心形梗死的临床特征及病因学研究
傅方望 项唯 黄环 沈洁 李岩 陈伟
脑桥梗死是后循环梗死中最常见的类型,约占所有缺血性脑卒中患者的7%[1]。绝大多数的脑桥梗死为单侧单发病灶,双侧脑桥梗死在临床中较为少见,但因为脑干的神经结构紧密,内有多个颅神经核团、运动感觉传导束、网状上行激活系统等重要结构穿过,双侧脑桥梗死常出现四肢瘫痪、吞咽障碍、意识障碍等高致残、高致死症状。脑桥心形梗死是双侧脑桥梗死的一种罕见类型,有其独特血管解剖学基础及特征性的影像学表现[2],国内外明确报道的病例仅数十例[3~7],目前对其临床特征及病因学的认识较匮乏。本研究回顾性分析11 例脑桥心形梗死患者的临床表现、病因、治疗及临床预后资料。
1 资料与方法
1.1 一般资料 回顾性收集2013 年1 月到2022 年1 月在温州医科大学附属第二医院收治的脑桥心形梗死的患者11 例,其中男性7 例、女性4 例;年龄36~76 岁,平均年龄(62.64±12.10)岁;入院美国国立卫生院卒中量表评分(national institutes of health stroke scale,NIHSS)平均为(14.82±12.21)分;高血压9 例、2 型糖尿病6 例、高脂血症5 例、房颤2 例;饮酒4 例、吸烟3 例。入选标准为:①发病1 周内;②脑梗死诊断符合《中国急性缺血性脑卒中诊治指南2018》中急性脑梗死的诊断标准[8];③符合弥散加权成像显示同时分布在脑桥两侧,呈典型心形外观的急性脑梗死。排除标准为:①出血性脑梗死;②非急性期双侧脑梗死;③合并肿瘤,炎性脱髓鞘等疾病;④不能配合MRI 扫描。本次研究通过医院医学伦理委员会的审批,患者均签署知情同意书。
1.2 方法
1.2.1 详细收集纳入研究患者的各项临床资料,包括人口学资料、脑卒中危险因素、临床表现特点、神经系统体格检查资料、心电图、心脏超声、实验室检查、头颅MRI、头颅电子计算机断层扫描血管造影(computed tomography angiography,CTA)、头颅磁共振血管成像(magnetic resonance angiography,MRA)、数字减影血管造影(digital subtraction angiography,DSA)、治疗方法、药物使用、出入院NIHSS评分、3 个月改良Rankin 量表(modified Rankin scale,mRS)评分等。
1.2.2 根据患者实验室检查、头颅MRI 影像学资料、常规血管评估资料,初步进行脑桥心形梗死的病因学分型。脑桥心形梗死病因分型包括:大动脉病变(large cerebral artery disease,LAD)、穿支动脉病变(basilar artery branch disease,BAD)、小动脉病变(small-artery disease,SAD)、心源性栓塞、其他病因。待完善HR-MRI 扫描后再次进行脑桥心形梗死病因学分型,对比检查前后脑桥心形梗死病因分型的差异。
1.3 评判标准 3 个月mRS 评分≥3 分定义为预后不佳。
2 结果
2.1 脑桥心形梗死患者临床症状学 11 例脑桥心形梗死患者临床表现为意识障碍7 例、构音障碍10 例、吞咽功能异常9 例、尿失禁7 例、头晕5 例、头痛3 例、复视4 例;表现为不同程度的肢体无力10 例,其中偏瘫2 例、三肢瘫痪1 例、四肢瘫痪7 例;出现呼吸衰竭4 例,其中3 例需要有创呼吸支持;4 例表现为闭锁综合征。
2.2 脑桥心形梗死患者神经系统症状 11 例脑桥心形梗死患者中,4 例发病存在意识障碍,3例入院后出现病情迅速加重,出现意识障碍;4 例存在眼球活动障碍,2 例存在瞳孔改变,2 例真性球麻痹,8 例假性球麻痹,10 例存在肌力下降,5 例巴宾斯基征阳性。
2.3 脑桥心形梗死患者影像学特征 病灶分布:6 例病灶位于脑桥上部,6 例位于脑桥中部,4 例位于脑桥下部,5 例患者存在上中部同时受累,3 例存在中下部同时受累。5 例为孤立脑桥心形梗死,6 例存在脑桥以外的病灶,其中小脑4 例,枕叶4 例,中脑2 例,丘脑2 例,颞叶1 例。CTA/MRA 显示,6 例患者存在椎基底动脉不同狭窄,1 例患者基底动脉闭塞,1 例存在斑块,3 例患者血管成像正常。
2.4 病因学分型 初步病因学分型:LAD 型6 例、BAD 型3 例、SAD 型3 例、心源性栓塞型1 例、动脉夹层1 例。通过HR-MRI扫描分析血管壁病变进行再次病因学分型:LAD 型3 例、BAD 型5 例、心源性栓塞型1 例、动脉夹层2 例。6 例存在脑桥外病灶的患者均存在明显的血管异常,其中3 例为LAD型,2 例为动脉夹层,1 例为心源性栓塞型。孤立性脑桥心形梗死的患者均为BAD型。
2.5 脑桥心形梗死患者CTA/MRA、DSA 图像及HR-MRI图见图4
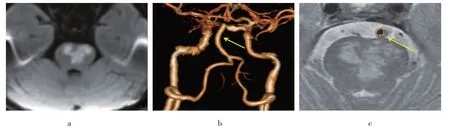
图4 脑桥心形梗死患者DWI、CTA及HR-MRI图
由图4 a 可见,DWI 提示脑桥心形梗死;由图4 b 可见,CTA 未见基底动脉病变(黄色箭头);由图4 c可见,HR-MRI 提示基底动脉斑块形成,管腔轻度狭窄(黄色箭头)。此例患者发病初诊断为SAD型,根据HR-MRI结果调整为BAD型。
2.6 临床预后 所有患者随访1 年或直至死亡。6 例(54.55%)患者存在早期神经功能恶化。8 例(72.72%)患者3 个月预后不佳,1 年死亡率为36.36%。
3 讨论
脑桥有其独特的血管分布供应[9~11],由基底动脉的3 组穿支动脉供血,包括脑桥旁中央动脉、短旋动脉及长旋动脉[9]。基于其血管解剖及其供血分布,临床上多表现为孤立性的单侧脑桥梗死,其主要病因与脑小血管病相关[10,12]。双侧脑桥梗死由双侧脑桥旁中央动脉受累所致,临床少见,仅占不到脑干梗死的10%。双侧脑桥梗死的机制常认为与椎基底动脉严重狭窄所致的低血流动力学因素,基底动脉斑块堵塞穿支口等因素密切相关。如同时或者先后合并短旋动脉病变,则表现为对称性分布的脑桥心形梗死,这在临床上更为罕见[13]。它在2012年首先被Ishizawa 等[3]报道,迄今为止,国内外报道仅仅数十例,大多为个案报告,其确切发病机制目前仍在探索之中[2~7]。
脑桥心形梗死累及的神经结构与梗死的大小范围密切相关,同时也和其水肿程度相关,症状轻微的患者可表现为眼球活动障碍及共济失调,严重的患者可表现为四肢瘫痪,意识障碍等。Kumral等[4]曾报道了14 例双侧脑桥梗死患者,其中7 例表现为比较典型的心形梗死病灶,该研究人群中,9 位患者表现为四肢瘫痪,1 例患者表现为三个肢体瘫痪,8 例患者表现为明显的意识障碍。本次研究收集了本院10 年来脑桥心形梗死患者的资料,有7 例表现为四肢瘫痪,7 例表现为意识障碍,8 例遗留明显神经功能障碍,1 年随访时有4 例死亡,与既往文献报道基本一致。国内外报道的病例,临床预后均较差,大多数患者死亡或者遗留有严重神经功能缺损症状[2,3,5~7]。这也证明了脑桥心形梗死是一种恶性脑梗死,预后差,需要早期积极干预。
因为脑桥心形梗死是一种罕见的脑干梗死类型,目前尚无大样本量的临床研究去探索其发病机制及病因学分型。脑桥梗死病因多为BAD 型,其次是小动脉病变及LAD 型,心源性栓塞较少见[10]。Kumral 等[4]报道的14 例脑桥心形梗死患者,5 例考虑为BAD 型,仅1 例考虑为LAD 型。但马召玺等[11]发现85.71%的脑桥心形梗死患者为LAD 型,1 例为SAD 型,1 例为心源性栓塞,与之前的其他研究有较大区别,考虑与其采用的病因分型标准不同有关,同时该研究纳入的双侧脑桥梗死患者有78.54%合并有其他部位梗死,孤立性脑桥梗死的比例远远小于其他研究。本次研究证实孤立性脑桥心形梗死多为BAD 型,而合并其他部位梗死的患者多存在大动脉狭窄或者闭塞,病因多为LAD型,少数患者为动脉夹层。综合上述证据,孤立性脑桥心形梗死的发病机制以BAD 型为主,包括基底动脉局部的斑块向穿支动脉延伸,椎基底动脉系统的不稳定斑块脱落堵塞穿支血管,穿支动脉开口自身的斑块形成等,而脑桥心形梗死合并其他部位梗死的患者,发病机制更多的是椎-基底动脉病变,导致远端多发栓塞或者低灌注,其中多数为LAD 型,少数患者为动脉夹层等其他病变。心源性栓塞在脑桥心形梗死中罕见。
HR-MRI 在检测血管壁病变方面有独特的优势,可以清晰地显示血管壁的结构,是一种观察是否存在斑块及斑块是否稳定的可靠的无创检测方法[14]。Klein 等[13]对MRA 正常的患者行HR-MRI,70%的患者发现了基底动脉斑块,而MRA 存在狭窄或者血管壁不规则的患者在HR-MRI上全部发现了斑块。可能的机制为斑块形成后导致正向重构,向血管壁外延伸,但向内并不足以引起基底动脉狭窄。另外,HR-MRI对于血管炎,血管夹层的检测,要远远优于MRA/CTA 等检查[14]。本次研究通过HR-MRI,2 例病因由SAD 型更正为BAD 型,2 例LAD 型更正为BAD 型,1 例LAD 型更正为动脉夹层,也证明了HR-MRI对于脑桥心形梗死病因诊断的重要性。
综上所述,脑桥心形梗死是一种罕见的脑干梗死类型,病情危重,致残率高,死亡率高,孤立性脑桥心形梗死的主要病因为BAD 型,而脑桥心形梗死伴发其他部位梗死的主要病因为LAD 型,HR-MRI对脑桥心形梗死的病因诊断具有重要意义,可以协助尽早明确发病机制,指导进行合适的治疗,并可以预测预后。

