益生菌制剂联合多奈哌齐对中重度阿尔茨海默病患者临床疗效及炎症因子的影响
何鲜艳 高晓峰 李振涛 程建贞 胡荣晋
阿尔茨海默病(Alzheimer's disease,AD)是一种神经系统退化性疾病,对患者本人及家庭造成了巨大痛苦[1]。多奈哌齐是一种相对特异性的可逆性乙酰胆碱酯酶抑制剂,可改善患者认知功能[2],但相关研究指出,其对于部分患者认知功能的改善尚不理想[3]。有报道发现,肠道菌群异常与AD 的发生密切相关[4]。目前对于益生菌制剂联合多奈哌齐治疗对AD 的临床疗效尚处于探索阶段。故本次研究旨在探究益生菌制剂联合多奈哌齐治疗中重度AD 患者的临床疗效及对炎症因子的影响。现报道如下。
1 资料与方法
1.1 一般资料 选择2021 年1 月至2022 年1 月衢州市第三医院80 例中重度AD 患者为研究对象,其中男性48 例、女性32 例;年龄56~82 岁,平均年龄(70.94±4.39)岁;病程0.5~6 年,平均(1.92±0.26)年;纳入标准包括:①符合有关中重度AD 的诊断标准[5];②患者或其家属知情同意且签署同意书;③病程≥6 个月。并剔除:①既往有脑卒中病史者;②先天性智力障碍患者;③合并脑血管畸形患者;④合并严重炎症疾病患者;⑤合并严重胃肠道疾病患者;⑥其他疾病引起的认知功能障碍者;⑦合并严重免疫功能异常者。本次研究经医院伦理委员会审批,采用随机数字表法将患者分为观察组和对照组,每组40 例。观察组中男性25 例、女性15 例;年龄56~81 岁,平均(70.85±4.47)岁;病程0.5~6 年,平均(1.94±0.27)年;文化程度:初中以下10 例、初中及高中22 例、大专及以上8 例。对照组中男性23 例、女性17 例;年龄59~82 岁,平均(71.02±4.31)岁;病程0.5~5年,平均(1.89±0.26)年;文化程度:初中以下8 例、初中及高中21 例、大专及以上11 例。两组比较,差异均无统计学意义(P均>0.05)。
1.2 方法 对照组给予多奈哌齐片[由卫材(中国)药业有限公司生产] 5 mg 口服治疗,每日1 次,共治疗3 个月。观察组在对照组基础上给予益生菌制剂(由米雅利桑株式会社生产)联合治疗,益生菌制剂2片口服,每日3 次,共治疗3 个月。
1.3 监测指标 ①临床疗效:根据治疗前及治疗3 个月后的简易精神状态量表(mini-mental state examination,MMSE)评分变化情况评定治疗疗效[6],疗效指数=治疗前后MMSE 评分变化值/治疗前MMSE评分×100%。显效为疗效指数>20%,有效为疗效指数12%~20%,无效为疗效指数<12%。②认知功能:采用MMSE 及AD 评估量表认知次量表(Alzheimer's disease assessment scale-cognitive subscale,ADAS-Cog)评价患者治疗前及治疗3 个月后的认知功能[7],MMSE 主要包括时间定向、地点定向等方面,共30 项,分值范围为0~30 分,得分越低表示认知障碍越严重;ADAS-Cog 包括单词回忆测试、物体和手指命名等14 项目,每项0~5 分,得分越高表示认知功能越差,0 分为无痴呆,70 分为完全无认知功能。③日常生活能力:采用AD 评估量表日常生活能力次量表行为量表(Alzheimer's disease assessment scale-activity of daily living scale,ADASADL)评价患者治疗前及治疗3 个月后的日常生活质量[8],共23 项,分值范围为0~78 分,得分越高表示患者日常生活能力越强。④炎症因子:于治疗前及治疗3 个月后采用酶联免疫吸附法检测患者血清肿瘤坏死因子-α(tumour necrosis factor-α,TNFα)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)。⑤氧化应激指标:采用酶联免疫吸附法检测患者治疗前及治疗3 个月后的超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)及丙二醛水平。⑥肠道菌群检测:所有患者于治疗前及治疗3 个月后采集约0.5 g 新鲜粪便,使用10 倍稀释法连续稀释至109,滴种于选择性培养基上,应用法国生物梅里埃公司VITEK Compact 型全自动微生物分析系统及配套试剂检测患者主要菌群(双歧杆菌、肠球菌、肠杆菌),结果以对数值(lg 菌落数/g)表示。⑦不良反应:统计两组患者治疗期间恶心呕吐、嗜睡等不良反应发生情况。
1.4 统计学方法 采用SPSS 22.0 统计学软件进行数据分析。计量资料以均数±标准差()表示。计量资料组间比较采用t检验;计数资料比较采用χ2检验。设P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较见表1
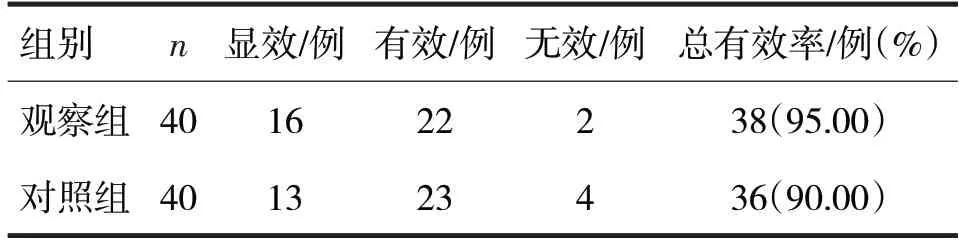
表1 两组临床疗效比较
由表1 可见,两组治疗总有效率比较,差异无统计学意义(χ2=0.72,P>0.05)。
2.2 两组治疗前后的认知功能及日常生活能力比较见表2

表2 两组治疗前后的认知功能及日常生活能力比较/分
由表2 可见,两组治疗前MMSE、ADAS-Cog 和ADAS-ADL评分比较,差异均无统计学意义(t分别=0.36、1.83、1.81,P均>0.05)。治疗后,观察组患者MMSE、ADAS-ADL评分均高于对照组,ADAS-Cog评分低于对照组(t分别=2.92、2.37、-2.78,P均<0.05)。
2.3 两组治疗前后的炎症因子水平比较见表3

表3 两组治疗前后的炎症因子水平比较
由表3 可见,两组治疗前TNF-α、IL-1β、IL-6水平比较,差异均无统计学意义(t分别=0.92、1.50、1.06,P均>0.05)。治疗后,观察组TNF-α、IL-1β、IL-6 水平低于对照组,差异均有统计学意义(t分别=4.17、6.30、3.36,P均<0.05)。
2.4 两组治疗前后的氧化应激反应比较见表4
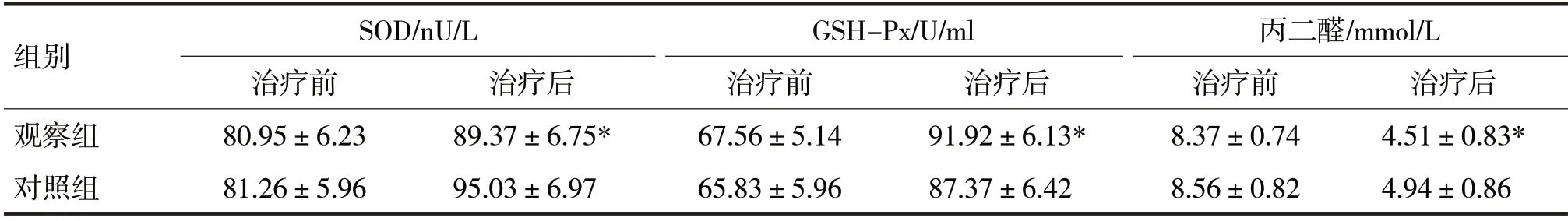
表4 两组治疗前后的氧化应激反应比较
由表4 可见,两组治疗前SOD、GSH-Px 和丙二醛水平比较,差异均无统计学意义(t分别=0.23、1.39、1.09,P均>0.05)。治疗后,观察组SOD、丙二醛水平低于对照组,GSH-Px水平高于对照组(t分别=3.69、3.24、-2.28,P均<0.05)。
2.5 两组治疗前后的肠道菌群比较见表5
由表5 可见,两组治疗前双歧杆菌数量、肠球菌、肠杆菌数量比较,差异均无统计学意义(t分别=0.75、1.35、1.56,P均>0.05)。治疗后,观察组双歧杆菌数量多于对照组,肠球菌、肠杆菌数量少于对照组,差异均有统计学意义(t分别=-2.49、2.31、3.76,P均<0.05)。

表5 两组治疗前后肠道菌群比较(lg菌落数/g)
2.6 两组不良反应发生率比较见表6
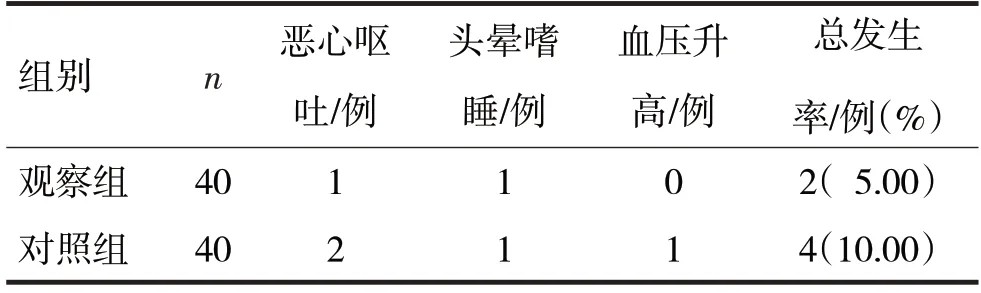
表6 两组不良反应发生率比较
由表6 可见,两组不良反应发生率比较,差异无统计学意义(χ2=0.72,P>0.05)。
3 讨论
AD是老年人中常见的神经系统变性疾病,以广泛的神经元丢失所导致的进行性记忆丧失和全面的认知功能障碍为主要临床表现,严重影响了患者及其家属的生活质量[9]。目前,临床上多采用多奈哌齐等抑制胆碱酯酶活性药物进行治疗,可增加大脑皮层乙酰胆碱含量,利于缓解临床症状,改善患者认知功能。但相关研究发现,单药治疗中重度AD的临床疗效欠佳[10]。临床资料显示,肠道微生物可通过菌群-肠脑轴影响大脑功能及行为[11]。肠道菌可通过产生神经递质和神经调节剂,来激活G 蛋白偶联受体,而影响大脑各个区域,提示通过调节肠道菌群或可起到改善患者认知功能异常的作用。本次研究结果显示,对中重度AD 患者给予益生菌联合多奈哌齐治疗,可改善患者认知功能及日常生活能力,这主要是因为益生菌可通过促进神经递质的合成或受体表达调节大脑活动。大量研究表明,肠道菌可通过产生神经递质和神经调节剂,来激活G 蛋白偶联受体,而影响大脑各个区域[12,13]。本次研究结果显示,益生菌联合多奈哌齐治疗中重度AD患者,可改善肠道菌群,这或为该药物能改善患者认知功能的主要因素,其原因在于,益生菌可通过间接调节肠道菌群或直接合成神经递质及衍生物来诱导脑源性神经营养因子表达,从而调节突触传递和神经元可塑性。
近年来研究发现,老年AD 患者不仅出现了明显的神经退行性病变,还伴有小胶质细胞和星形胶质细胞激活,提示患者存在脑内炎症反应[14]。相关研究也指出,中枢神经系统炎症反应与AD 发病存在一定程度的相关性[15]。研究发现,大脑皮质层和海马区细胞外β-淀粉样肽合成过量、沉积是AD 的重要病理特征和发病中心环节,在AD 患者病理早期阶段,其易感神经元中即已出现氧化损伤。且相关研究发现,氧化损伤是AD 发病的早期因素。益生菌具有抗炎作用,可抑制患者促炎细胞因子升高[16]。本次研究结果显示,对中重度AD患者给予益生菌联合多奈哌齐治疗,可减轻机体炎症状态,降低氧化应激水平。其原因在于,益生菌衍生的阿魏酸可逆转神经炎症,降低海马和皮质Aβ 原纤维水平,可通过清除氧自由基阻止AD 发展。另外,本次研究发现,两组不良反应发生率对比无明显差异,说明在多奈哌齐的基础上,给予益生菌治疗不会增加不良反应,提示该药物治疗的安全性较高。
综上所述,益生菌制剂联合多奈哌齐治疗中重度AD,可调节患者肠道菌群,降低炎症反应,改善机体氧化应激状态。本次研究尚存在不足之处,纳入样本量有限,后期需增加样本量以进一步分析联合治疗对中重度AD的治疗效果。

