牙龈卟啉单胞菌第Ⅸ分泌系统组成的研究进展
李碧榕,蔡 青,尹昭懿,王子璇,孟维艳
牙龈卟啉单胞菌是一种革兰氏阴性杆菌,可分泌血凝素、脂多糖、牙龈蛋白酶等多种毒力因子,是牙周炎的主要致病菌[1-5]。牙龈卟啉单胞菌第Ⅸ分泌系统(type Ⅸ secretion system,T9SS)是近年来发现的一种存在于拟杆菌属的新型分泌系统,可以将细菌胞内合成的蛋白跨外膜运输至细菌细胞表面[6-8]。牙龈卟啉单胞菌可以通过T9SS分泌至少30种蛋白质,其中包括主要毒力因子牙龈蛋白酶(Kgp,RgpA,RgpB)[3,9]。本文将从牙龈卟啉单胞菌T9SS结构蛋白和转录调节因子两个方面介绍其跨外膜转运蛋白装置的组成及功能,以便理解该菌毒力因子的分泌机制,为疾病的治疗策略提供新的思路。
1 T9SS组成和分泌
目前已知T9SS至少由16种结构蛋白质组成[10-12],这些蛋白按照在细胞膜上的定位可分为以下5种:包埋于内膜的蛋白(PorL、PorM),包埋于外膜的蛋白(PorG、PorT、PorP、Sov、PorV、PorQ、PorF、Plug),与外膜相关并定位于周质的脂蛋白(PorE、PorK、PorW),锚定在细胞表面的蛋白(PorU、PorZ)和周质蛋白(PorN)[12-23]。PorU和PorZ分别通过PorV和PorQ锚定于细胞表面[17],PorN通过PorK锚定于外膜,定位于周质内[14]。PorK-PorN-PorM-PorL构成跨周质核心复合体,Sov和PorV构成外膜转位复合体,PorU-PorZ-PorV-PorQ构成附着在外膜上的附着复合体[22],PorM和PorW可能形成了能量转导复合体,PorP和PorT可能是O-脱酰基酶[11]。外膜相关蛋白中的任何一个蛋白失活都会导致T9SS货物蛋白在周质中的滞留和分泌减少,从而降低牙龈卟啉单胞菌的毒力。T9SS分泌的货物蛋白可以被运输至细胞表面[24]。在分泌过程中,货物蛋白的C端保守结构域(C-terminal domain signal,CTD)被切割后产生的新末端连接到阴离子脂多糖(A-LPS)上,形成毒力涂层,即电子致密表层(electron-dense surface layer,EDSL)[25-27]。T9SS向外膜分泌蛋白的调控系统由PorX和PorY组成的双组分系统(two-component system,TCS)及其下游的胞质外功能(extracytoplasmic function,ECF)σ因子SigP组成[28]。最近有研究发现一种新型含CTD的T9SS蛋白PorA能够调节PorXY-SigP信号通路[29]。
2 结构蛋白
2.1 跨周质核心复合体
T9SS功能所需的18个基因中,porK、porL、porM和porN这4个基因位于同一个共转录的操纵子上,表达跨周质核心复合体PorK-PorN-PorM-PorL。PorM-PorK、PorM-PorN、PorK-PorN以及PorP-PorK/PorM之间存在相互作用,PorP是PorK-PorN-PorM-PorL复合体的辅助成分,被认为可以与该复合体在特定条件下结合,存在不稳定的相互作用[18]。
PorM、PorN和PorK形成同源二聚体,而PorL形成同源三聚体,共同组成PorL3/PorM2/PorN2-PorK2跨周质核心复合体(图1紫色部分),其总质量约为410 ku[18]。PorM是这个跨周质核心复合体的核心成分,连接内膜(PorL-PorM)和外膜(PorK-PorN)复合物。PorL由跨膜螺旋和细胞质结构域(PorLC)组成,PorM由跨膜螺旋和周质结构域(PorMP)组成[18]。PorM二聚体包含4个结构域,即D1~D4,呈不对称缠绕的杆状,长度约180Å[21-22]。PorM二聚体通过它的2个螺旋与PorL三聚体的3个螺旋相互作用,将PorM一端锚定于内膜。细菌双杂交分析显示PorL与PorM的相互作用不涉及PorLC。PorMP和PorN在外膜附近发生了寡聚,PorM通过其D4结构域与PorK-PorN环形结构结合,PorM的一端借助PorK-PorN环形结构锚定于外膜,使PorM跨越整个周质,成为连接外膜成分和内膜成分的纽带[18,21-22]。

图1 T9SS结构和功能示意图
PorK和PorN在周质侧的外膜附近以1∶1化学计量比相互作用,形成了一个直径50 nm的环形结构,该大环由两个子环组成,其中较大的子环由PorK亚基组成,较小的子环由PorN亚基组成,PorK环的脂质成分将这个复合体锚定于外膜[14]。Gorasia等[14]通过化学交联和质谱分析推测该环形结构可能通过与PGN_0297(PG0189)外膜蛋白结合来稳定锚定在外膜上,并且该环形结构的形成与PorL或PorM无关,PorL和PorM能够形成一个独立于PorK和PorN的稳定复合物,而Sato等[30]推测认为PorK、PorN、PorL和PorM相互作用共同形成一个大的复合体[14,30-32]。
PorK、PorL和PorM的稳定表达需要PorN,PorN的表达也需要PorK的保护,从而共同形成稳定的环。PorK-PorN环形结构可能构成T9SS分泌通道的一部分[14],该结构可能与外膜上的分泌孔相连,并通过操纵装置调节货物蛋白进出,但目前还没有明确的论据来证明具体是由哪种物质来调节其分泌的[21-22]。
PorL-PorM可能调控PorK-PorN环形结构的开放,且PorL为PorM提供能量,质子流导致跨周质的PorM相对于内膜上5个PorL组成的环旋转,从而驱动外膜蛋白质运输,这种能量通过PorK-PorN传递到外膜[33]。Vincent等[18]认为PorL-PorM作为一个能量转换复合体,将化学能(质子动力或ATP)转化为机械能,并为T9SS的组装或底物通过外膜转运提供能量。Emrizal等[11]通过基因序列分析,推测PorM还可能和PorW形成了能量转导复合体,并通过T9SS激活底物转运。
2.2 外膜转位复合体
约氏黄杆菌中的易位子SprA是牙龈卟啉单胞菌中Sov的同源物,牙龈卟啉单胞菌的Sov可能具有类似SprA跨外膜转运货物蛋白的功能[8]。SprA形成一个极大的(36链)单肽跨外膜β桶,直径约为7.0 nm,足够容纳折叠的货物蛋白,其顶端具有两个开口,一个通向周质侧,另一个通向外膜表面[20]。SprA与T9SS不同成分结构结合,控制跨膜通道的蛋白转运。SprA存在以下两种结合情况:SprA与肽基脯氨酰顺反异构酶(peptidyl-prolyl cis-trans isomerase,PⅡ)和PorV结合形成PorV复合体,或SprA与PⅡ和Plug蛋白结合形成Plug复合体[20]。SprA桶运输结构的两端分别被Plug蛋白(周质侧开口)和PorV(外膜表面侧向开口)封闭,这两种蛋白与SprA的结合是互相排斥的,当SprA形成PorV复合体时,允许SprA桶通道从周质中摄取货物蛋白,而当SprA形成Plug复合体时,则代表货物蛋白已经被释放到外膜表面[20],PorV可能通过识别T9SS底物CTD蛋白并相互作用,触发PorV-底物复合物从SprA桶中释放[17],同时Plug蛋白封闭SprA桶的周质侧开口,直到PorV再次结合在侧面开口,实现了底物通过T9SS单向运输[20]。牙龈卟啉单胞菌中的Sov和PorV在T9SS中可能也发挥相似作用。
2.3 外膜表面附着复合体
外膜蛋白PorU和PorZ分别通过与PorV和PorQ的相互作用锚定在细胞表面,形成PorU-PorZ-PorV-PorQ附着复合体(图1绿色部分)。PorU是一种转肽酶,通过PorV锚定于外膜[17],其在细胞表面暴露的同时需要PorZ的存在[16]。OmpH样蛋白Omp17可能作为分子伴侣参与PorU向外膜的转运,PorU可能是T9SS的最后一个分泌到表面的成分[16,34]。在T9SS将货物蛋白易位至外膜的过程中,PorU切割货物蛋白CTD,并将产生的新末端连接到阴离子脂多糖(A-LPS)上,使货物蛋白锚定在细菌外膜表面[25,35]。PorU可以通过切割RgpB前体(proRgpB)酶原N末端原结构域(prodomain,PD)来激活牙龈蛋白酶RgpB;另外,PorU还可能通过一种非典型的分泌型或表面表达型蛋白酶间接介导PD的切割,从而调节proRgpB的激活,牙龈蛋白酶RgpB的活性或分泌依赖于PorU[9]。
PorZ位于外膜及外膜囊泡中,其晶体结构显示有两个β-螺旋结构域和一个C-末端的β-夹心结构域,它具有完整的CTD结构域,通过T9SS运输到细胞表面,没有被PorU切割[16]。Lasica等[16]发现在PorU缺失的突变体中,PorZ依然可以被转运至外膜,反之在PorZ缺失的突变体中,PorU无法被转运至外膜,说明PorZ暴露于细胞表面与PorU的活性无关,而PorZ的缺失可以阻止PorU暴露于细胞表面,这可能是由于PorZ可以直接与PorQ结合[16-17]。PorZ可以对T9SS货物蛋白进行翻译后修饰,包括酶前体的成熟、CTD的去除以及结合并呈递A-LPS到PorU[36]。
PorV作为外膜穿梭蛋白可以与T9SS分泌至外膜的货物蛋白CTD结构域结合,将其呈递给PorU切割,并输送至外膜分泌装置Sov通道[17,20]。
2.4 外膜支架蛋白
PorE是一种定位在外膜周质侧的脂蛋白,可能作为连接T9SS周质和外膜组分的重要支架发挥作用。PorE在T9SS底物分泌中发挥重要作用,不影响A-LPS的转运[15]。应用计算机对PorE的结构进行模拟,推测PorE具有一个新的N-到C-末端结构,包括一个四肽重复结构域、一个五叶β-螺旋体结构域、一个羧肽酶调节结构域样折叠和一个OmpA_C样肽聚糖结合域[15]。Park等[37]提出具有OmpA_C样结构域的蛋白质通过连接外膜和肽聚糖来稳定细胞结构。Trinh等[23]证明PorE可以与牙龈卟啉单胞菌外膜上肽聚糖中的干肽相互作用,PorE可作为外膜和肽聚糖网络之间的桥梁,将T9SS锚定在外膜上。
牙龈卟啉单胞菌T9SS运输货物蛋白(caogo protein)的过程我们推测如下。货物蛋白通过Sec复合体,其N-末端信号肽(signal peptide,SP)被切割,之后被招募到跨周质核心复合体。货物蛋白通过其CTD结构域与PorM结合,并被传递至PorN和PorK,最终到达Sov外膜转位复合体。货物蛋白通过Sov通道蛋白后,依靠其CTD结构域被PorV捕获。同时A-LPS独立运输到外膜,并被PorU-PorZ-PorV-PorQ附着复合体募集。PorV将货物蛋白传递给PorU,PorU将CTD结构域切割并结合A-LPS,CTD被释放到细胞外界环境中。
3 转录调节因子
3.1 PorX和PorY
PorX是一种反应调节蛋白,而PorY是一种组氨酸激酶,它们组成双组分系统来调控T9SS基因的转录[38]。PorX由一个CheY样受体结构域和一个PglZ功能未知结构域组成,PorY细胞质组氨酸激酶结构域通过跨膜发夹结构固定在内膜上。它们可以激活牙龈卟啉单胞菌中porK,porN,porL,porM,porT,porP和sov基因的表达[28,30]。另外,PorX/PorY系统能够通过与氯化血红素作用使牙龈卟啉单胞菌对氧化应激反应产生抗性[39]。
Vincent等[38]证明,PorX不结合T9SS基因启动子,也不直接激活这些基因的转录,而是在它被PorY激活后,通过内膜上PorL的C末端疏水结构介导与PorL胞质内的结构域相互作用,从而被移位至T9SS分泌装置的基底部(图2),通过动力学作用来促进T9SS蛋白的表达。
3.2 SigP
SigP是胞质外功能(ECF)σ因子家族的转录调节因子[19,40],参与调控牙龈卟啉单胞菌表达毒力因子,可以增强牙龈蛋白酶活性,促进自凝集、血凝以及外膜囊泡的形成[41]。SigP可以与T9SS货物蛋白基因的启动子结合,激活基因转录[28]。PorY激活的PorX还可诱导SigP基因的表达[29]。Kadowaki等[28]发现PorX可以与SigP相互作用并稳定SigP形成异源二聚体,共同发挥激活T9SS基因转录的作用(图2)。PorXY双组分系统可以通过SigPECFσ因子促进T9SS分泌蛋白质[28]。
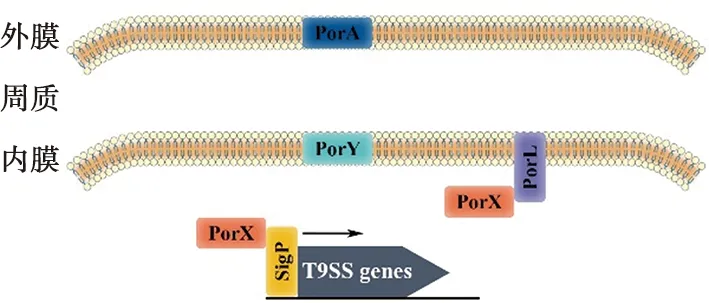
图2 T9SS转录调节因子示意图
3.3 PorA
PorA是一种新型含CTD的T9SS蛋白,存在于外膜表面。PorA可以调节PorXY-SigP信号通路,是第一个发现参与T9SS结构蛋白基因调控的含CTD T9SS蛋白,并且其分泌并不依赖Sov通道。PorA在细胞表面有两种存在形式:第一种是PorA的CTD被PorU切割,而后其末端与A-LPS共价结合;第二种是PorA将CTD保留,共同定位于细胞表面,这种形式的PorA具有激活PorXY-SigP信号通路的能力,从而增加T9SS基因的表达[29]。
4 展 望
牙周炎中,菌斑生物膜可导致免疫微环境的失衡与破坏,其代谢产生的牙龈蛋白酶等毒力因子能够激发机体固有免疫应答,引起炎症反应,造成组织坏死[42]。牙龈卟啉单胞菌通过T9SS分泌包括牙龈蛋白酶等在内的多种毒力因子。抑制T9SS可以使牙龈卟啉单胞菌的毒力减弱,并且使牙龈卟啉单胞菌可以迅速被机体免疫系统从组织中清除,因此T9SS可以作为治疗牙周炎的药物靶点。牙龈卟啉单胞菌T9SS结构蛋白和转录调节因子的相关研究,可以帮助研究人员了解毒力因子产生的过程,并且为药物研制等提供理论基础,但目前仍有许多功能尚不清楚的T9SS蛋白,T9SS各组成部分之间的相互调控和能量传递还有待进一步研究。

