阿托伐他汀钙联合丁苯酞序贯疗法治疗急性缺血性脑血管病的效果及对认知行为学、神经影像学的影响
廖益
急性缺血性脑血管病(AICD)是长期残疾的主要因素,具有高致残、高发病、高致死及低恢复的特点[1]。AICD 治疗的关键在于迅速恢复缺血区灌注,研究证实,溶栓治疗是AICD 最有效的手段,但由于时间窗、适应证等原因,多数患者不能得到有效溶栓治疗[2-3]。丁苯酞为AICD 常用治疗药物,可多靶点抗脑缺血,改善AICD 神经功能缺损[4]。且研究证实,阿托伐他汀钙在降低血脂水平、抗炎、稳定斑块等方面具有明显疗效[5]。但目前关于阿托伐他汀钙联合丁苯酞序贯疗法治疗AICD 能否进一步提高效果,临床尚缺乏报道。认知损害是AICD最常见并发症之一,严重影响患者预后及生存质量。研究证实,AICD 患者梗死灶体积与认知功能密切相关[6]。目前,临床研究中,采用影像学技术探讨AICD 患者疗效及神经机制是较为理想的手段。基于此,本研究尝试探讨阿托伐他汀钙联合丁苯酞序贯疗法治疗AICD 的效果及对认知行为学、神经影像学的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2018 年12 月-2021 年12 月于赣州市立医院就诊的80 例AICD 患者。纳入标准:(1)均符合文献[7]AICD 诊断标准;(2)神经功能缺损评分(NIHSS)≥4 分;(3)首次发病,发病时间<72 h。排除标准:(1)近1 个月内有脑外伤、脑出血、重大外科手术史;(2)合并自身免疫系统、造血系统疾病;(3)合并肿瘤;(4)严重心、肾、肝功能异常;(5)妊娠期或哺乳期妇女。采用随机数字表法将患者分为观察组(n=40)和对照组(n=40)。本研究通过本院医学伦理委员会审核,患者均签署知情同意书。
1.2 方法 两组均给予常规治疗,包括口服抗血小板、控制血糖与血压等药物,对照组在此基础上采用丁苯酞序贯疗法,急性期静滴丁苯酞氯化钠注射液(生产厂家:石药集团恩必普药业有限公司,批准文号:国药准字H20100041,规格:100 mL∶25 mg∶0.9 g/瓶),25 mg/次,2 次/d,共14 d;恢复期口服丁苯酞软胶囊(生产厂家:石药集团恩必普药业有限公司,批准文号:国药准字H20050299,规格:0.1 g/粒),0.2 g/次,3 次/d,共3 个月。观察组在对照组基础上加用阿托伐他汀钙片(生产厂家:辉瑞制药有限公司,批准文号:国药准字H20051408,规格:20 mg/片),40 mg/d,睡前口服,共14 d。
1.3 观察指标及判定标准 (1)疗效。疗效标准:根据NIHSS 评分减少程度进行判定;≥90%为基本痊 愈,≥46% 且<90% 为显效,>17% 且<46% 为进步,≤17%为无效。总有效=基本痊愈+显效+进步。(2)比较两组治疗前后NIHSS 评分、改良Rankin 量 表(mRS)评 分。NIHSS 评 分0~42 分,神经功能缺损程度与评分呈正相关。mRS:完全无症状为0 分;症状轻微,无明显功能障碍为1 分;轻度残疾,可照料日常事务为2 分;中度残疾,能独立行走为3 分;重度残疾,日常生活需帮助为4 分;严重残疾,日常生活完全依赖别人为5 分;死亡为6 分。(3)比较两组治疗前后简易精神状态量表(MMSE)评分、蒙特利尔认知评估量表(MoCA)评分,总分均为30 分,认知能力与评分呈正相关。(4)比较两组治疗前后神经影像学指标[梗死灶体积、相对表观扩散系数值(rADC)],采用超导磁共振成像系统(西门子Avanto1.5T)测量。(5)比较两组治疗前后炎症反应相关指标[白细胞计数、中性粒细胞比率、C 反应蛋白(CRP)]水平,取空腹静脉血3 mL,白细胞计数、中性粒细胞比率采用希森美康XN1000 血细胞分析仪测定,CRP 采用免疫透射比浊法测定。(6)比较两组不良反应发生情况。
1.4 统计学处理 采用统计学软件SPSS 25.0 处理数据,计数资料以率(%)描述,采用χ2检验;计量资料以()描述,组间比较采用独立样本t检验,组内比较采用配对t检验。均采用双侧检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 观察组男27 例,女13 例;年龄42~78 岁,平均(61.87±7.29)岁;体重指数17.6~27.2 kg/m2,平均(22.17±1.93)kg/m2;梗死部位:颞叶4 例,脑干5 例,顶叶皮层7 例,基底节24 例;基础疾病:高血压16 例,冠心病11 例,糖尿病6 例。对照组男29 例,女11 例;年龄41~79 岁,平均(62.51±7.56)岁;体重指数17.4~27.5 kg/m2,平均(22.24±2.08)kg/m2;梗死部位:颞叶3 例,脑干4 例,顶叶皮层8 例,基底节25 例;基础疾病:高血压14 例,冠心病10 例,糖尿病8 例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组临床疗效比较 观察组总有效率为92.50%,高于对照组的75.00%(χ2=4.501,P<0.05),见表1。

表1 两组临床疗效比较[例(%)]
2.3 两组NIHSS 评分、mRS 评分比较 治疗前,两组NIHSS 评分、mRS 评分比较,差异均无统计学意义(P>0.05);治疗后,两组NIHSS 评分、mRS 评分均低于治疗前,且观察组均低于对照组(P<0.05)。见表2。
表2 两组NIHSS评分、mRS评分比较[分,()]

表2 两组NIHSS评分、mRS评分比较[分,()]
*与治疗前比较,P<0.05。
2.4 两组MMSE 评分、MoCA 评分比较 治疗前,两组MMSE 评分、MoCA 评分比较,差异均无统计学意义(P>0.05);治疗后,两组MMSE 评分、MoCA 评分均高于治疗前,且观察组均高于对照组(P<0.05)。见表3。
表3 两组MMSE评分、MoCA评分比较[分,()]

表3 两组MMSE评分、MoCA评分比较[分,()]
*与治疗前比较,P<0.05。
2.5 两组神经影像学指标比较 治疗前,两组梗死灶体积、rADC 比较,差异均无统计学意义(P>0.05);治疗后,两组梗死灶体积均小于治疗前,rADC 均高于治疗前,且观察组梗死灶体积小于对照组,rADC 高于对照组(P<0.05)。见表4。
表4 两组神经影像学指标比较()

表4 两组神经影像学指标比较()
*与治疗前比较,P<0.05。
2.6 两组炎症反应相关指标 治疗前,两组白细胞计数、中性粒细胞比率、CRP 水平比较,差异均无统计学意义(P>0.05);治疗后,两组白细胞计数、中性粒细胞比率、CRP 水平均低于治疗前,且观察组均低于对照组(P<0.05)。见表5。
表5 两组炎症反应相关指标比较()
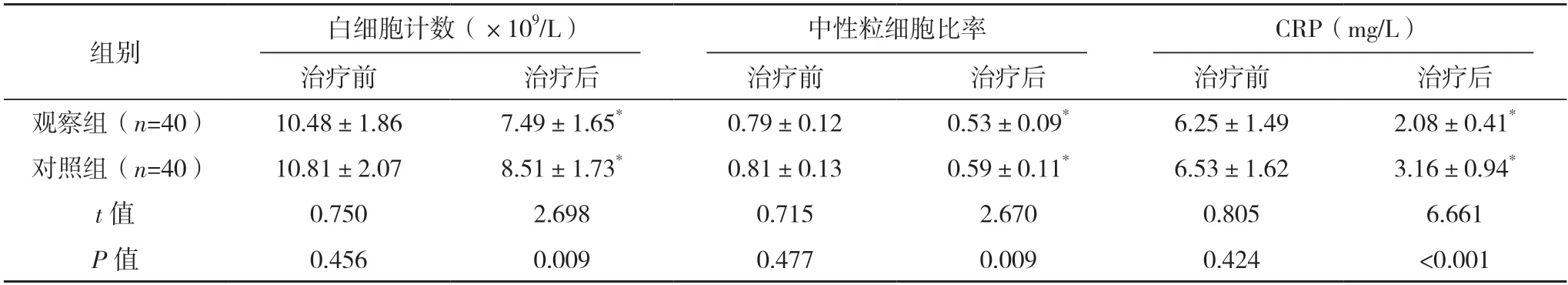
表5 两组炎症反应相关指标比较()
*与治疗前比较,P<0.05。
2.7 两组不良反应发生情况比较 两组不良反应发生率比较,差异无统计学意义(χ2=0.263,P>0.05),见表6。

表6 两组不良反应发生情况比较[例(%)]
3 讨论
尽早恢复缺血半暗带供血、挽救尚存神经元是AICD 治疗的关键环节,其根本在于实现血管再通[8]。近年来,血管再通治疗发展迅速,包括溶栓、颈动脉内膜剥脱术等,但由于限制条件较多,绝大多数患者只能采取改善循环、抗血小板聚集、神经保护、降脂固斑等药物治疗促进组织血流灌注恢复,改善临床症状[9]。
丁苯酞是我国国家级Ⅰ类新药,是目前公认的治疗AICD 的有效药物。动物研究证实,丁苯酞可明显改善脑梗死大鼠局部微循环,降低梗死面积,减轻脑损伤[10]。临床研究表明,丁苯酞显著改善AICD 患者低灌注状态,挽救缺血半暗带神经元,保护线粒体功能,并防止梗死区扩大[11]。另研究显示,丁苯酞可提高AICD 患者循环内皮祖细胞含量,修复内皮损伤,促进血管新生[12]。此外,研究显示,丁苯酞注射液辅料成分环糊精可降低血液胆固醇负荷,促进斑块消退[13]。朱以诚等[14]进行多中心、随机、双盲双模拟、对照试验,既验证脑梗死急性期采用丁苯酞注射液安全有效,又表明丁苯酞序贯疗法可在一定程度上降低患者致残率。另研究证实,阿托伐他汀可让AICD 患者在急性期获益[15-16]。本研究尝试探讨阿托伐他汀钙联合丁苯酞序贯疗法治疗AICD 患者的效果,发现联合治疗可减轻患者炎症反应,改善神经功能及认知功能。阿托伐他汀钙治疗可通过调节血脂水平、抑制自由基生成、降低血小板活性、调控内皮功能等机制保护患者脑损伤[17],因此,阿托伐他汀钙联合丁苯酞序贯疗法可作为治疗AICD 的有效治疗方案。另研究指出,他汀类药物大剂量使用可引发AICD 患者肝损害等不良反应[18]。本研究显示,两组不良反应发生率比较,差异无统计学意义(P>0.05),提示联合用药安全性高,值得临床推广应用。
目前,影像学检查已成为AICD 早期诊断及疗效评价的重要手段。研究显示,AICD 患者梗死体积与神经缺损程度及患者预后明显相关,梗死体积越大,神经缺损越严重,预后越差[19]。rADC 值可反映水分子扩散情况,能够对AICD 患者梗死区改变进行量化评价。急性脑梗死发生时,缺血区域毛细血管血容量减少,脑组织细胞缺氧,导致正常的细胞代谢进程中断。而水分子从细胞外向细胞内转移,导致病灶区域出现细胞毒性水肿改变。物质的转移使得细胞外空间减小,从而出现细胞内外水分子弥散受限[20]。结合两组恢复情况及影像学评价,验证阿托伐他汀钙联合丁苯酞序贯疗法对AICD 治疗有明确积极意义,为此方法临床应用提供积极证据。
综上可知,阿托伐他汀钙联合丁苯酞序贯疗法治疗AICD 患者,可减轻炎症反应,改善神经功能与认知功能,效果显著,安全性高。

