ORAOV1、CD133和KiSS-1在口腔鳞状细胞癌中的表达及其临床意义*
吴志刚 胡凯 杨东昆 刘畅
2012 年全球新发口腔癌病例(包括唇癌)估计 为300 000 例,死亡病例约为145 000 例[1]。口腔鳞状细胞癌(OSCC)约占所有诊断为口腔癌的90%。在中国,口腔癌的主要危险因素有吸烟、饮酒、槟榔及HPV 感染[2-3]。口腔癌过度表达1(oral cancer overexpressed 1,ORAOV1)蛋白,最初被确定为口腔鳞状细胞癌中的候选癌基因[3]。该基因位于人类染色体11q13。越来越多的证据表明,ORAOV1 与细胞周期、细胞凋亡、血管生成和肿瘤发生有关[4]。ORAOV1 的过表达能够促进肿瘤细胞增殖、侵袭和转移,应被视为预测转移和预后的生物标志物。肿瘤干细胞由于其在肿瘤细胞群体中具有自我更新能力和高致瘤性,因此被认为在癌症的发生、发展、转移和复发中起重要作用[5]。造血干细胞抗体CD133 是肿瘤干细胞中最常见的一个标志物,其可以抑制癌细胞凋亡[6]。吻素-1(KiSS-1)基因最初通过消减杂交分析被确定为人类黑色素瘤的肿瘤转移抑制基因。该基因位于人类染色体1q32 上,长度为6 151 个碱基对。KiSS-1 可通过抑制核转录因子κB(NF-κB)与启动子的结合来促进上皮性钙黏蛋白(E-cadherin)表达并抑制基质金属蛋白酶-9(MMP-9)表达。KiSS-1 的正常表达可以抑制肿瘤的转移从而抑制其趋化性和侵袭性[7]。一些证据表明KiSS-1 可以抑制癌症的转移而不影响致瘤性[7]。KiSS-1 编码一个145 个氨基酸的肽,该肽被进一步切割为KiSS-1 家族肽素。然而,KiSS-1抑制转移的机制仍不清楚。本研究主要通过免疫组化方法检测ORAOV1、CD133 和KiSS-1 在OSCC 中的表达情况,并分析它们之间的相互关系及临床病理意义。
1 资料与方法
1.1 一 般资料 选取2012 年1 月-2014 年12 月在蚌埠医学院第一附属医院病理科100 例确诊为OSCC 患者的标本及相应的100 例正常组织作为对照。纳入标准:(1)年龄20~80 岁;(2)病理诊断为OSCC;(3)临床分期Ⅰ~ⅣA 期。排除标准:(1)选取标本前已接受抗癌治疗;(2)伴有严重心、肺、脑疾病;(3)合并其他肿瘤。所有组织样本均在患者书面同意的情况下获得。该研究得到蚌埠医学院伦理委员会批准。随访时间从患者的手术日期到他/她的死亡日期或2020 年12 月。
1.2 方法 所有OSCC 标本和对照标本均采用4%中性福尔马林溶液固定后石蜡包埋,4 μm 厚连续切片,然后用二甲苯及梯度浓度的乙醇溶液连续脱蜡、脱二甲苯至水洗。ORAOV1、CD133 和KiSS-1蛋白的免疫组化染色步骤根据试剂盒说明书操作,阳性对照采用说明书指定的阳性切片,空白对照用PBS 液替代一抗。兔抗人多克隆抗体ORAOV1 购自英国Abcam 公司,鼠抗人单克隆抗体CD133 和KISS-1 购自美 国Santa Cruz 公 司。ElivisionTMPlus和DAB 显色试剂盒购自中国福州迈新生物技术开发有限公司。
1.3 观察指标及判定标准 ORAOV1 主要定位于细胞核,CD133 主要定位于细胞膜和细胞质,KiSS-1主要定位于细胞浆。阳性结果的判定主要是根据染色强度和染色范围分别计分相乘后得出的。阳性强度评分如下:无着色为0 分;淡黄色为1 分;黄色为2 分;棕黄色为3 分。根据阳性细胞百分比对阳性程度进行评分:≤10%为1 分;11%~50%为2 分;51%~75%为3 分;>75%为4 分。将染色强度和染色范围相乘,得出一个介于0~12 的值。根据均数来计算,若积分≥3 分为阳性表达,<3 分为阴性[8]。免疫组化标记染色结果的判定是由两位高年资病理医师通过独立双盲法得出的。
1.4 统计学处理 利用统计软件SPSS 20.0 对本试验中数据进行统计分析,使用卡方检验比较临床病理参数与ORAOV1、CD133 或KiSS-1 之间的相关性。ORAOV1、CD133 或KiSS-1 蛋白表达之间关系采用列联表相关检验。患者治疗后总的生存时间利用Kaplan-Meier 法分析,通过log-rank 法检验;多因素回归分析通过Cox 法分析。P<0.05 为差异有统计学意义。
2 结果
2.1 ORAOV1、CD133 和KiSS-1 的表达 及其与OSCC 临床参数之间的关系 ORAOV1 结果在OSCC标本中的阳性表达率为60%(60/100),高于相应的正常口腔黏膜组织的20%(20/100)(χ2=33.333,P<0.001)。CD133 在OSCC 组织中 的阳性表达率60%(60/100),高于相应的正常口腔黏膜组织的18%(18/100)(χ2=37.074,P<0.001)。KiSS-1 表达在OSCC 组织中的阳性表达率为46%(46/100),低于相应的正常口腔黏膜组织的91%(91/100)(χ2=46.924,P<0.001)。不同年 龄、性 别、位置、吸烟、酗酒、直径、分化程度OSCC 患者的ORAOV1、ORAOV1、KiSS-1 蛋白的表达情况比较,差异均无统计学意义(P>0.05)。不同浸润程度、淋巴结转移、TNM 分期OSCC 患者的ORAOV1、ORAOV1、KiSS-1 蛋白的表达情况比较,差异均有统计学意义(P<0.05)。见表1。
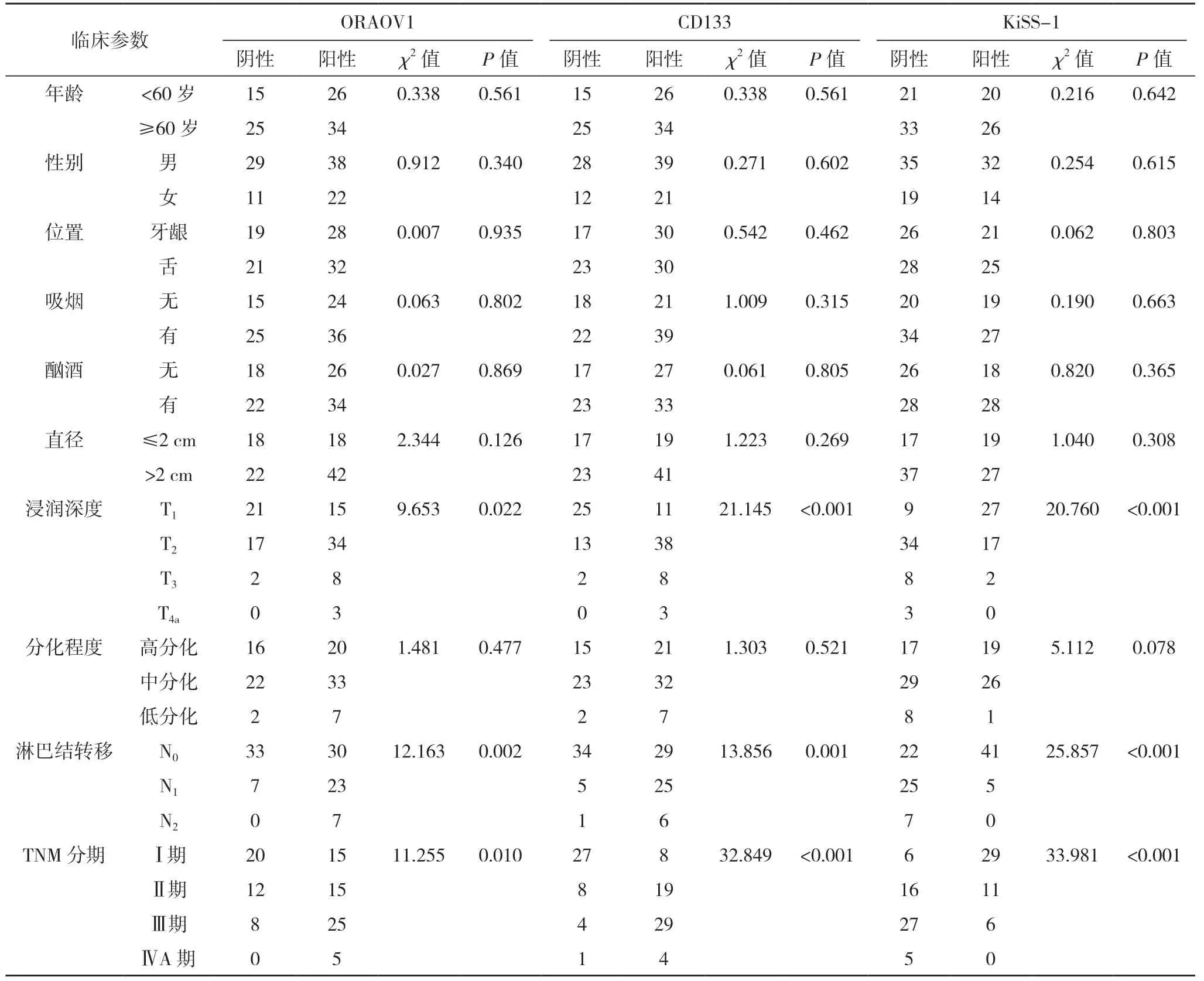
表1 ORAOV1、CD133和KiSS-1与OSSC临床病理参数之间的关系(例)
2.2 OSCC 中ORAOV1、CD133 和KiSS-1 表达的 相关性 列联表相关分析显示,KiSS-1 表达与ORAOV1、CD133 表达均 呈负相 关(P<0.001)。ORAOV1 的表达与CD133 的表达呈正相关(P=0.003),见表2~4。
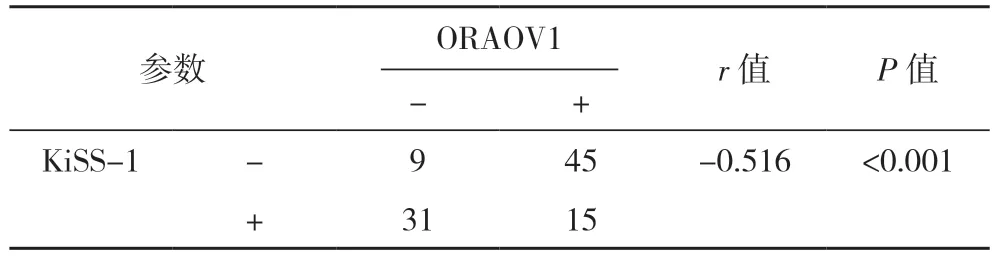
表2 ORAOV1与KiSS-1的关系分析(例)
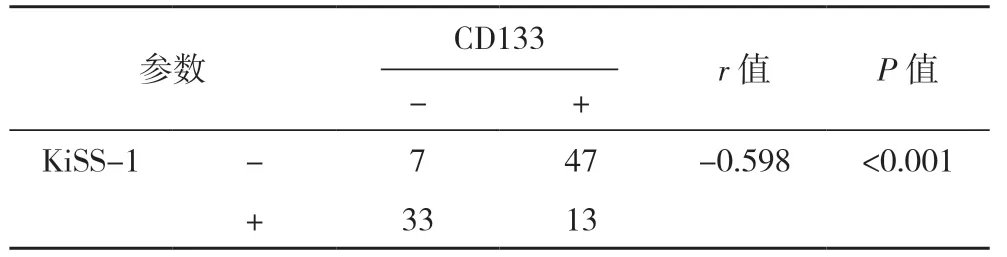
表3 CD133与KiSS-1的关系分析(例)
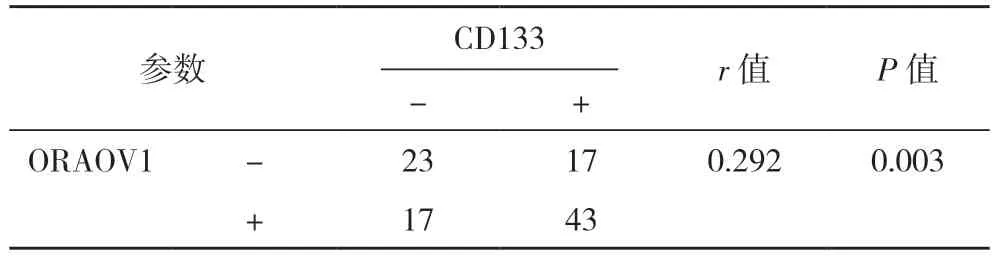
表4 CD133与ORAOV1的关系分析(例)
2.3 影响生存时间的单因素分析 随访数据显示,ORAOV1 阳性表达OSCC 患者的总生存时间(OS)为(43.7±18.4)个月,低于阴性表达OSCC 患者的(71.0±14.6)个月(log-rank χ2=37.015,P<0.001),见 图1A。CD133 阳性表 达OSCC 患者的OS 为(43.2±16.9)个月,低于CD133 阴性表达OSCC患者的(71.8±15.8)个 月(log-rank χ2=46.317,P<0.001),见图1B。KiSS-1 阳性表达OSCC 患者的OS 为(71.4±13.8)个月,高于KiSS-1 阴性表达患者的(40.3±16.1)个月(log-rank χ2=65.535,P<0.001),见图1C。
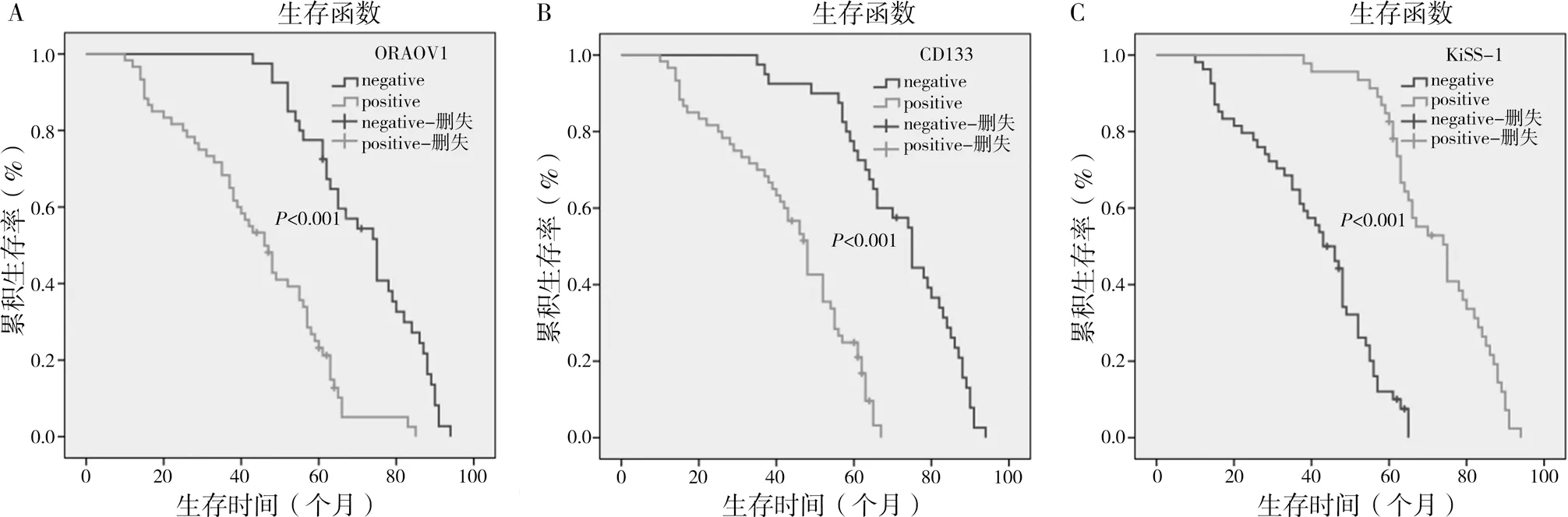
图1 ORAOV1、CD133和KiSS-1阳性与阴性表达OSCC患者生存曲线
2.4 影响生存时间多因素分析 多因素分析显示,ORAOV1、CD133、KiSS-1 蛋白可能是影响OSCC患者术后生存时间的独立因素(P<0.05),见表5。

表5 影响生存时间的多因素分析
3 讨论
肿瘤的异质性会干扰生物标志物评估的可重复性。因此,必须全面评估候选生物标志物的价值以确认其有效性。本研究中,笔者分析了100 例OSCC患者及相对应的正常口腔黏膜组织中ORAOV1 蛋白的表达,并对临床病理特征进行了比较。笔者发现OSCC 组织中ORAOV1 蛋白的阳性表达率高于其在对照组织中的阳性率。此外,其阳性率与OSCC 浸润程度、淋巴结转移、TNM 分期有关。笔者的结果与之前的研究相似,表明ORAOV1 的过表达应该促进OSCC 浸润转移[4,9]。
CD133 是人类造血干细胞的细胞表面生物标志物,存在于各种癌症组织中[4]。在OSCC 中,已经证明CD133 与肿瘤的侵袭进展相关,并显示可预测抗癌治疗的不良预后[10]。在本研究中,CD133 其阳性率与OSCC 浸润程度、淋巴结转移、TNM 分期有关。此外,Kaplan-Meier 生存分析显示,CD133 阳性表达患者的OS 与阴性表达的患者相比,生存时间显著降低。以上结果表明CD133 的过表达可能参与了OSCC 细胞侵袭和转移的过程,预后较差。笔者结果与之前的研究一致,包括口腔癌和其他癌症的研究[4,10-13]。
KiSS-1 被广泛认为是多种癌症转移的抑制基因[7,14-16]。KiSS-1 可以抑制癌细胞增殖、运动、侵袭和转移[17]。本研究结果还表明,OSCC 组织中KiSS-1 的阳性表达率低于其在对照正常组织中的阳性率,其阳性率还与OSCC 浸润程度、淋巴结转移、TNM 分期有关。此外,Kaplan-Meier 生存分析KiSS-1 表达阳性患者的OS 时间长于阴性患者。上述结果表明KiSS-1 的下调或失控应被视为预测OSCC 患者转移和预后的潜在生物标志物,这与之前的研究一致[7,14-20]。
TNM 分期为临床治疗OSCC 提供策略,但并不能描述OSCC 生物学行为的详尽信息。因此,迫切需要寻找新颖有效的候选生物标志物来预测OSCC 的生物学行为、转移和患者预后。本研究多因素分析表明,ORAOV1 和CD133 蛋白的高表达及KiSS-1 蛋白的低表达可能是影响OSCC 患者术后生存时间的独立因素。以上结果表明ORAOV1、CD133 和KiSS-1 的表达可能在一定程度上预测OSCC 的转移和预后方面有重要意义。
OSCC 是主要的常见口腔癌类型。CD133 表达异常增高可能通过促进肿瘤干细胞的增生,而参与OSCC 的肿瘤发生、侵袭、转移和复发过程[18]。肿瘤干细胞的自我更新和多分化能力促进OSCC 细胞快速生长。同时,ORAOV1 的过表达也通过激活一系列细胞周期蛋白促进癌细胞增殖和侵袭而促进肿瘤发生。它还参与血管生成以促进肿瘤侵袭和转移[4]。事实上,肿瘤干细胞所在的微环境主要由微血管或微淋巴管组成。因此,这些微血管支持进一步促进癌细胞侵袭和转移。KiSS-1 通过促进E-cadherin 表达和抑制可降解细胞外基质的基质金属蛋白酶表达来抑制肿瘤转移。因此,KiSS-1 的下调或丢失调节可以促进肿瘤细胞的侵袭和转移。
综上所述,ORAOV1、CD133 和KiSS-1 会影响OSCC 浸润进 展;ORAOV1、CD133 和KiSS-1 的联合检测可以在一定程度上预测OSCC 患者浸润和转移。

