血清腱生蛋白C和尿酸与增生性糖尿病视网膜病变相关性分析〔1〕
覃彦平,黄红波,韩光杰,何健明,柯柳华,覃振仲
(1.柳州市红十字会医院,广西 柳州 545001;2.柳州市中医医院,广西 柳州 545001)
糖尿病视网膜病变(DR)是一种以慢性视网膜微血管炎性病变为特征的糖尿病(DM)并发症[1],是我国DM患者最常见的眼底疾病。DR分为非增生性和增生性两类,以增生性糖尿病视网膜病变(PDR)病情进展最为严重,可引起患者视力丧失,是我国主要的致盲眼病之一。PDR的发病机制尚不明确。研究发现炎性细胞因子与PDR发病有关[2-3]。血清腱生蛋白C(TNC)是一种与炎性反应、纤维血管膜形成等有关的细胞因子[4-5],TNC在PDR患者血清中的表达情况还不清楚。另有研究发现[6],高尿酸血症(HUA)是DM发病的一个危险因素,高尿酸血症可引起血管内皮细胞炎性损伤[7]。目前血清尿酸(SUA)是否参与PDR进展仍有一定争议[8-9]。本研究分析了TNC及SUA在PDR病变中的作用,报告如下。
1 资料与方法
1.1 一般资料
选择临床明确诊断的2型糖尿病(T2DM)患者122 例,其中不伴PDR患者54 例(观察1组),伴PDR患者68 例(观察2组);另选择柳州市中医医院健康体检正常者52 例作为对照组。三组一般资料比较,差异无统计学意义(P>0.05)(见表1)。本研究已获柳州市红十字会医院伦理委员会审核批准。

表1 各组一般资料比较
1.2 诊断标准
2 型糖尿病诊断标准依据1999年世界卫生组织(WHO)对糖尿病的诊断标准。糖尿病视网膜病变患者的诊断标准按照我国2014年糖尿病视网膜病变临床诊疗指南进行诊断。根据血压测量结果及既往血压情况确定有无高血压,高血压诊断采用WHO 1999年标准:舒张压(DBP)≥90 mmHg(1 mmHg≈0.133 kPa),收缩压(SBP)≥140 mmHg。排除1型糖尿病(T1DM)及其他特殊类型糖尿病患者、急慢性感染、甲状腺等内分泌代谢疾病及恶性肿瘤等。
1.3 研究方法
1.3.1 血清TNC测定
采用酶联免疫分析法,试剂盒由上海联硕生物工程有限公司提供,实验严格按说明书进行操作,在检测标本的同时做空白对照样品、阴性对照样品、标准品。测定时以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。
1.3.2 血清血糖和尿酸测定
采用罗氏生化仪分析,采用其配套试剂进行检测。
1.4 观察指标
比较三组生化指标:TNC,SUA及空腹血糖(FBG)水平。采用实验者空腹静脉血液标本,分离血清后检测。比较观察1组及观察2组SBP和(或)DBP。
1.5 统计学方法

2 结 果
2.1 三组生化指标比较
三组血清TNC比较,差异均无统计学意义(P>0.05)。观察2 组SUA值与观察1组及对照组比较,差异均有统计学意义(P<0.05)。观察1组的SUA值与对照组比较,差异无统计学意义(P>0.05)。对照组血清FBG值与观察1组及观察2组两两比较,差异均有统计学意义(P<0.05)。观察2组与观察1组血清FBG值比较,差异无统计学意义(P>0.05)(见表2)。
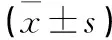
表2 三组生化指标比较
2.2 观察1组及观察2组的DBP和SBP值比较
观察1组与观察2组的SBP和DBP比较,差异均无统计学意义(P>0.05)(见表3)。
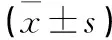
表3 观察1组及观察2组的DBP和SBP比较 单位:mmHg
3 讨 论
PDR是DM患者并发DR的最晚期阶段。PDR的病理机制主要是血-视网膜屏障(BRB)的破坏及视网膜新生血管形成造成的玻璃体视网膜增生性改变。新血管形成需要有特定的血管基底膜微环境即细胞外基质(ECM)[10]。ECM在正常情况下处于稳定状态。由于长期高血糖、高血压导致DM患者机体内生理和生化发生紊乱,致使视网膜血管内皮损伤[11],打破ECM的稳定状态,引起ECM降解,内皮细胞和血管壁细胞迁移、增殖、出芽,最终生成新血管腔[10,12],导致PDR的发生。
TNC是ECM中的一种具有独特六臂体结构的糖蛋白[4]。TNC通过与细胞表面受体及基质蛋白结合来发挥其生物学效应。TNC同时具有黏附性和抗黏附性、可调节炎性细胞转移、上调基质金属蛋白酶(MMPs)表达、促进ECM降解及促进纤维化等多种功能[4,13]。Barbariga等[14]在对角膜新生血管化(CNV)小鼠模型和CNV患者的角膜基质进行蛋白质组学分析时,发现TNC水平上调。Sugimoto等[15]对患有糖尿病性黄斑水肿(DME)患者眼睛房水进行多重分析后,确定TNC为血管梗死相关分子。Kobayashi等[16]的研究也表明TNC可以促进与DR相关的纤维血管膜生成,TNC可作为视网膜ECM重建的一个生物学标志物。但在本研究中,虽然与对照组及观察1组比较,观察2组血清TNC水平平均值增高,但观察2组血清TNC水平与对照及观察1组相比较,差异均无统计学意义(P>0.05)。本研究显示血清TNC水平与PDR发展无关,可能是由于TNC具有的促进ECM降解及促进纤维化等功能主要在角膜新生血管化及促进纤维血管膜生成中发挥作用[14,16],而患者眼球已出现视网膜、视乳头新生血管或纤维膜,视网膜已发生增生性改变,因此TNC在这一阶段发挥作用少,对PDR发展影响也不大。SUA是嘌呤代谢的最终产物,SUA同时具有抗氧化作用和促氧化特性。SUA可导致微血管损伤,因为它一方面可促进慢性炎症反应,抑制内皮一氧化氮合成酶,激活肾素-血管紧张素-醛固酮系统,并直接影响内皮细胞和血管平滑肌细胞功能。另一方面,SUA可抑制高糖和亚硝化应激诱导的DM中的Wnt信号传导,可能对血管组织起保护作用[17]。目前研究者对SUA与DR关系的分析结果不尽相同。Zhu等[18]发现高SUA可以在高血糖的基础上促进视网膜的炎症反应,增加Notch信号通路的活性,从而促进DR的发展。而Xia等[19]的研究则揭示T2DM患者高SUA水平、高尿白蛋白排泄(UAE)及低肾小球滤过率(eGFR)和糖尿病肾病(DN)患病率相关,但与DR患病率无关。在本研究中,观察2组SUA水平与观察1组及对照组两两相比较,差异有统计学意义(P<0.05),说明SUA与PDR发病有关。
高血糖及高血压均是PDR发病的影响因素。长期高血压会使视网膜动脉发生痉挛,脉管变细,进一步发展为视网膜动脉硬化狭窄。Liu等[20]在对亚洲糖尿病和高血压人群进行研究时,发现控制不佳及未经治疗的高血压与任何阶段的DR发生、进展均有显著相关性[20]。本研究中,观察1组及观察2组的血糖及SBP均值偏高,提示两组患者血糖及血压都需及时治疗及控制。
综上所述,本研究发现观察1组及观察2组患者SBP值偏高,观察1组患者血清TNC水平与PDR患病率无关,高SUA与PDR发病有关。可能是由于高SUA通过糖脂代谢紊乱加重血管内皮细胞损伤,引起血管病变,眼球新血管增生,导致PDR发生。因此,在治疗PDR时,除控制血糖、血压外,还应重视对SUA的控制,以降低PDR发病风险。

