Richter综合征2 例并文献复习〔1〕
马东升,徐玉秀,王萌,吴胜胜
(驻马店市中心医院,河南 驻马店 463000)
病例1,男,69 岁,以“发现颈部肿物5 d”为主诉于2019年11月27日首次入院。11月22日患者出现双侧颈部肿物,左侧较右侧疼痛明显,自行口服阿莫西林等药物,效果差。2019年11月27日外院查血常规示白细胞27.4×109/L,血红蛋白115 g/L,血小板269×109/L,中性粒细胞计数6.44×109/L,淋巴细胞绝对值20.44×109/L,患者为求进一步诊治入住驻马店市中心医院。既往病史:糖尿病10 年余,口服消渴丸治疗,具体用量及用法不详,15 d前停用;2006年1月患脑出血,有言语不清后遗症;2006年7月患脑梗死,具体治疗方法不详。体格检查:言语欠流利,张口呼吸,右侧扁桃体肿大明显,表面溃烂,软腭受压隆起,咽腔狭窄,双侧颈部可触及核桃大小淋巴结肿大,部分融合,质软,有压痛;双肺呼吸音粗,可闻及少量干湿啰音;心律齐,各瓣膜区未闻及异常杂音;腹软,无压痛、反跳痛及肌紧张;肝脾肋下未触及,双下肢无浮肿。入院后完善相关检查,血常规示:白细胞29.43×109/L,血红蛋白108 g/L,血小板304×109/L,淋巴细胞计数 22.92×109/L。尿便常规、凝血系列、风湿系列、甲状腺功能均未见异常。生化系列示:总蛋白57.90 g/L,白蛋白32.20 g/L,谷氨酰转肽酶234 U/L,葡萄糖7.81 mmol/L,β2微球蛋白3.38 mg/L,乳酸脱氢酶1 416 U/L,羟丁酸脱氢酶1 062 U/L,钠134 mmol/L,超敏C反应蛋白45.5 mg/L。血清蛋白电泳未发现M蛋白,血清免疫固定电泳未发现异常单克隆条带。心电图示窦性心律,心电图大致正常。心脏彩超示室壁运动正常。颈胸腹增强CT示左肺下叶微小结节,建议随访观察;肝S3,S4,S8段多发转移瘤,请结合临床;肝S8乏血供病变,考虑囊肿;考虑门静脉左支血栓形成,建议进一步检查;胆囊结石并炎症;肝门区囊性占位,请结合其他检查考虑;腹膜后囊实性占位,建议进一步检查;颈部、腹膜后及肠系膜淋巴结肿大;部分网膜密度增高,考虑脂膜炎;颈部占位性病变,最大直径4.4 cm,建议实验室进一步检查。骨髓涂片结果示增生活跃,其中粒系占18.5%,红系占3.0%,粒系和红系比例减低,成熟红细胞部分呈缗钱状排列,淋巴细胞比例增高,为成熟淋巴细胞,全片共见巨核细胞6 个;片中可见分类不明细胞,占19.5%,胞体大,呈不规则形,胞浆染蓝色,有空泡,胞核不规则,核染色质细致,核仁1~4 个(见图1)。
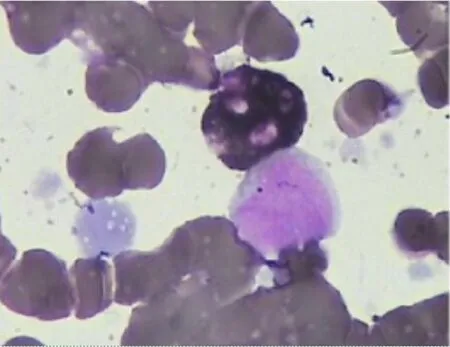
可见分类不明细胞图1 病例1骨髓涂片(瑞特-吉姆染色,×1 000,油镜)
外周血免疫分型示异常成熟B淋巴细胞群,约占核细胞的76.6%。CD19,CD5,CD200,Lambda,CD43表达,CD20,CD79b,CD81,CD148弱表达,CD25,SIgM,CD10,FMC7,CD38,CD103,CD11c,CD3,CD4,CD8,CD56,kappa,SIgD不表达,细胞体积偏小,符合慢性淋巴细胞白血病(CLL)表型。骨髓活组织检查示有核细胞增生较活跃(造血面积约70%),粒/红比例大致正常,粒系以偏成熟阶段细胞为主,偏幼稚细胞散在少数;红系以中晚幼红细胞为主;巨核细胞数量在正常范围,以分叶核为主;淋巴细胞、浆细胞散在多见;骨髓间质未见胶原纤维增生。免疫组化:CD138散在少(+),CD38小簇及散在少(+),PAX-5多(+),CD20多(+),CD10间质(+),CD5少(+),CK(-),CD3少(+),符合B细胞肿瘤,建议行流式细胞学检查分型诊断。颈部淋巴结穿刺活组织检查示:弥漫大B细胞淋巴瘤,非生发中心来源(NON-GCB)型;免疫组化:CD3,CD5背景小淋巴细胞阳性,CD20,CD79a大细胞弥漫阳性,Ki67高表达,约80%(+),CD10(-),BCL2(+),BCL6(-),MUM1(+),CD21示滤泡树突细胞(FDC)网缺失(见图2)。
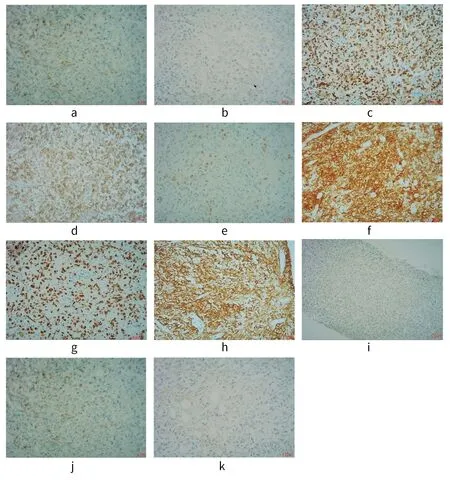
a:免疫组化CD5背景小淋巴细胞阳性;b:免疫组化BCL6-;c:免疫组化MUM1+图;d:免疫组化BCL2+;e:免疫组化CD3背景小淋巴细胞阳性;f:免疫组化CD79a大细胞弥漫阳性;g:免疫组化Ki67高表达,约80%(+);h:CD20大细胞弥漫阳性;i:免疫组化CD21示FDC网缺失;j:免疫组化CD5背景小淋巴细胞阳性;k:免疫组化CD10-图2 病例1免疫组化图
荧光原位杂交(FISH):BCL2(-),BCL6(+),MYC(-)。骨髓FISH示BCL6,IGH/MYC,CCND1均阴性,MALT1阳性。MYD88基因L265P突变检测(-)。诊断:Richter综合征;脑出血后遗症;肺部感染;2型糖尿病;陈旧性脑梗死;冠状动脉粥样硬化;慢性胃炎。给予RCHOP(美罗华375 mg/m2,化疗前1天,环磷酰胺750 mg/m2,第1天,表柔比星60 mg/m2,第1天,泼尼松60 mg/m2,第1天至第5天)方案化疗1 个疗程,复查血常规白细胞8.32×109/L,血红蛋白107 g/L,血小板164×109/L,淋巴细胞绝对值4.11×109/L。治疗3 个疗程后,复查骨髓及全身增强CT评估疗效达完全缓解。继续完成5 个疗程RCHOP方案。随访截至2021年9月,目前患者仍处于完全缓解状态。
病例2,男,66 岁,以“确诊慢性淋巴细胞白血病2 年余,加重3 月余,腹痛、腹胀1 周余”为主诉于2021年8月31日首次入住我院。2 年多前患者因咽干伴扁桃体肿大,于2019年5月27日就诊于石河子大学医学院第一附属医院,行颈部彩超示双颈上部低回声(考虑肿大淋巴结),双侧腮腺内低回声(考虑淋巴结);口咽部MRI示双侧扁桃腺肿大,双侧颌下区、颈部、锁骨上区多发淋巴结肿大,考虑淋巴系统疾患;扁桃体病理提示慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL);血常规示白细胞35.2×109/L;腹部彩超示脾大,第一肝门区及胰头区多发淋巴结肿大;骨髓涂片示淋巴细胞明显增多(占83%,胞体小,成熟细胞为主),基本符合成熟淋巴细胞肿瘤;免疫分型检测到异常成熟小B淋巴细胞,占核细胞的88.8%,符合CD5+CD10-成熟小B细胞淋巴瘤,CLL积分4 分,慢性淋巴细胞白血病可能,建议结合CCND1除外套细胞淋巴瘤(MCL);免疫表型:CD5(+),CD23部分(+),CD19(+),CD20(+),CD138(-),CD10个别(+),BCL-2(+),BCL-6部分(弱+),Ki67(-),CyclinD1(-)。结论:淋巴细胞增多(呈大片状和弥漫性浸润),慢性淋巴细胞白血病可能。染色体核型示:46,XY[20]。FISH示CCND1(-)。诊断为慢性淋巴细胞白血病。2019年6月7日外院予以利妥昔单抗+苯丁酸氮芥治疗,2 个疗程后疗效评估部分缓解(PR),4 个疗程化疗后疗效评估维持PR,先后化疗7 个疗程,末次化疗时间2019年11月21日。2021年3月24日就诊于当地医院,增强CT提示全身多发淋巴结肿大,疗效评估为疾病进展(PD),予以利妥昔单抗+苯丁酸氮芥化疗3个疗程,3个疗程后根据影像学检查评估疗效达疾病稳定(SD),后患者服用伊布替尼(每日300 mg)靶向治疗2 个月,纳差有所好转,腹部肿块进行性肿大。2021年8月24日出现腹痛,为阵发性剧痛,伴腹胀,为进一步诊疗急诊驻马店市中心医院。腹部CT示:腹腔、腹膜后、右侧心隔角旁多发软组织结节(淋巴瘤或转移性病变可能),盲肠周围软组织影,胆囊结石,腹腔渗出性病变,建议进一步检查。给予抗感染、止痛等治疗,急诊以“慢性淋巴细胞白血病”收住我科。既往患“高血压病”3 年余,血压最高160/90 mmHg(1 mmHg≈0.133 kPa),服用硝苯地平缓释片降压,血压控制不详,2018年7月停服降压药物。入院查体:轻度贫血貌,双侧颈部、腋窝可触及淋巴结肿大,质软,无压痛;双肺呼吸音粗,未闻及明显干湿啰音;心律齐,各瓣膜区未闻及异常杂音;腹膨隆,脐周和右中腹可触及巨大肿块,直径约10 cm,质硬,有压痛,活动度差;双下肢无浮肿。入院后完善相关检查。2021年9月1日血常规:白细胞6.44×109/L,血红蛋白119 g/L,血小板98×109/L,C反应蛋白17.83 mg/L,血沉4 mm/h;尿常规未见异常;粪便常规自动分析:免疫法潜血阳性;凝血系列示凝血酶原时间比率0.92 s;生化系列:总蛋白55.5 g/L,球蛋白15.30 g/L,白球比2.6,总胆红素27.8 μmol/L,直接胆红素13.4 μmol/L,间接胆红素14.40 μmol/L,尿素12.6 mmol/L,尿酸642 μmol/L,血β2微球蛋白6.17 mg/L,乳酸脱氢酶583 U/L,羟丁酸脱氢酶516 U/L,钠134 mmol/L,氯94 mmol/L,免疫球蛋白G 6.08 g/L,免疫球蛋白A 0.67 g/L,免疫球蛋白M<0.20 g/L;风湿十五项均阴性;传染病系列均阴性;常规心电图检查示:窦性心律,部分导联ST-T异常;EB病毒定量2.84×104copies/mL。骨髓涂片示骨髓增生活跃,粒系占28.00%,红系占44.50%,粒∶红=0.63∶1,粒系比例减低,中、晚幼粒及杆状核粒细胞比例均减低;部分细胞胞浆颗粒增粗,红系比例增高,以中、晚幼红为主;成熟红细胞大小不等,可见嗜多色性红细胞;淋巴细胞比例正常,为成熟淋巴细胞,占24.5%;单核细胞比例正常,形态大致正常(见图3)。

可见成熟淋巴细胞图3 病例2骨髓涂片(瑞特-吉姆染色,×1 000,油镜)
全片共见巨核细胞342 个,分类25 个,其中成熟无血小板形成巨核细胞19 个,成熟有血小板形成巨核细胞6 个。血小板散在、小堆可见。免疫分型示异常细胞(P4内)CD19+B细胞占全部细胞的14.5%,CD19,CD5,CD123part,CD200,CD25,CD20dim,CD22,HLA-DR,mLambda表达,FMC7,sIgM,CD34,mCD3,CD4,CD8,CD56,CD57,CD33,CD103,CD11c,CD38,CD123,CD10,CD7,mKappa不表达,CD5+CD10-为克隆性小B细胞,CLL积分系统评分为4 分(5 分制),CD7+细胞(P3内)占全部细胞的10.5%,以成熟T淋巴细胞为主,CD4/CD8=0.95,表型未见异常,髓细胞(P5内)占全部细胞的37.6%,单核细胞(P6内)占全部细胞的4.6%,有核红细胞(P6内)占全部细胞的25.2%;染色体核型示:46,XY[20];腹腔肿物活组织检查示小圆细胞恶性肿瘤,考虑淋巴瘤,建议会诊及免疫组化确诊。远程会诊示:高增殖活性的非霍奇金B细胞淋巴瘤。免疫组化CD3(T细胞+),CD5(+),CD20(+),CD23(散在细胞+),Ki-67(95+),Bcl-2(+),MUM-1(+),Cyclin-D1(部分+),CD10(-),CK(-),TdT(-),SOX-11(-)(见图4)。

a:免疫组化CD20(+);b:免疫组化CD23(散在细胞+);c:免疫组化SOX-11(-);d:免疫组化CD10(-);e:免疫组化Bcl-2(+);f:Cyclin-D1(部分+);g:免疫组化MUM-1(+);h:免疫组化CD3(T细胞+);i:免疫组化CD5(+);j:免疫组化CK(-);k:免疫组化TdT(-);l:免疫组比ki-67(95+)图4 病例2免疫组化图
原位FISH:IGH/CCND1(-)。CLL/SLL相关基因突变检测:TP53外显子exon5 4.4%(5833X),外显子exon4 1.4%(7718X)。未检测到ATM,BIRC3,BTK,MYD88,NOTCH1,PLCG2,SF3B1基因突变。诊断为Richter综合征。患者因经济原因拒绝继续应用布鲁顿酪氨酸激酶(BTK)抑制剂及利妥昔单抗,给予来那度胺+CHOP方案化疗2 个疗程,影像学评估疗效达PR。
讨 论
Richter综合征(RS)为罕见的淋巴造血系统疾病,是由低度恶性淋巴细胞增殖性疾病向更高度恶性的淋巴细胞增殖性疾病转化和(或)并发的一种疾病[1]。绝大多数RS会向弥漫性大B细胞淋巴瘤(DLBCL)转化,临床上称为经典型RS。其确诊依赖淋巴结或结外组织病理活组织检查,发病原因不明确,无标准的治疗方案,大部分患者常规化疗疗效差,预后不佳。RS是CLL和小淋巴细胞淋巴瘤(SLL)向侵袭性淋巴瘤转化的临床病理表现,最常见的转化类型是DLBCL。1928年Richter[2]第一次描述了这种病例,1964年报道了4 例相似病例,并命名为RS。该病在国内少见,但近几年的报道有逐渐增多的趋势,国外报道较多。Tsimbefidou和Keating[3]报道了CLL患者向RS转化的发生率为2.2%~8.0%。但Rossi等[4]研究发现在CLL患者的自然病程中RS的发生并不罕见,通过对1996年—2006年185 例CLL患者采取了严格的活组织检查:凡淋巴结直径≥5 cm;迅速的淋巴结增大(3个月内最大横径超过2倍);出现B症状(非感染性发热,盗汗,体质量下降);乳酸脱氢酶(LDH)增高;任何可疑的结外侵犯均进行活组织检查。结果显示,5 年和10 年的RS发病率分别为13.6%和16.2%。大部分患者在CLL早期出现RS转化,部分患者甚至出现在CLL诊断时。病例1类似这种情况,以淋巴结肿大为主要症状,无CLL或SLL病史,骨髓检测到大量成熟淋巴细胞经流式细胞术检测支持CLL的诊断,淋巴结活组织检查,证实DLBCL。说明一部分CLL患者,在疾病诊断时就具有RS转化的倾向,大细胞转化是CLL克隆中内在的生物学特性。
经典的RS在组织病理学上表现为DLBCL,多数累及淋巴结,累及的结外组织包括胃肠道、皮肤、肝脏、扁桃体、骨髓、中枢神经系统等。RS转化可能只累及部分淋巴组织,选择直径最大的淋巴结进行活组织检查可获得较高的阳性率。国内外学者推荐[5-9]选择PET/CT检查最大标准摄取值(SUVmax)最高的部位进行活组织检查穿刺。Falchi等[6]基于CLL患者的大宗研究,将SUVmax最高值的临界值设为5(即将SUVmax最高值≥5的部位视为可疑转化病灶),此时敏感性为88%,特异性为47%,阳性预测值为38%,阴性预测值为92%。Albano等[7]回顾性研究2010年1月—2019年1月86 例经组织学证实的CLL和怀疑临床转化的患者,这些患者接受了PET/CT扫描后发现可疑的RS,并随后对受累部位进行了活组织检查,研究结果显示,18 例高SUVmax (SUVmax>9)的患者中有12 例发生RS,而68 例低-中氟代脱氧葡萄糖(FDG)摄取(SUV<9)患者中只有6 例发生RS。Michallet等[8]基于CLL患者的研究,将SUVmax最高值的临界值设为10,此时敏感性为91.0%,特异性为95.0%,阳性预测值为28.7%,阴性预测值为99.8%。本研究因医疗条件限制,行增强CT后经颈部较大淋巴结和腹腔大包块穿刺活组织检查证实RS转化。
目前,对于RS尚缺乏有效的治疗方法,临床上主要根据其病理类型及转化是否与克隆相关进行治疗,经典型RS治疗方案主要包括免疫化疗(如RCHOP),BTK抑制剂(如伊布替尼),BCL-2抑制剂(如维奈托克[10])、PD-1单抗(如Pembrolizumab[11])、造血干细胞移植[12]及新靶点药物[13]。霍奇金淋巴瘤(HL)变异型RS通常采用HL治疗方案,如ABVD化疗方案,该方案对大多数HL变异型RS患者治疗有效,但容易复发。Abrisqueta等[14]研究发现接受RCHOP治疗的RS患者(n=48)的总有效率(ORR)为58.3%。本中心2 例RS患者,1 例应用RCHOP获得完全缓解,另外1 例应用来那度胺+CHOP方案获得部分缓解,但该患者1个月后复发。Richter综合征的预后很差,中位生存期(PFS)仅为5~8 个月,在CLL患者中发生转化又较为隐匿,故临床医生应重视CLL患者发生RS转化的可能。虽然新药时代BTK抑制剂的应用,RS的缓解率有所提高,但其PFS及总生存期(OS)远远不令人满意,迫切需要新的治疗方法。获得应答的患者可以考虑嵌合抗原受体T细胞(CAR-T)、异基因造血干细胞移植。随着对RS的基础与临床的深入研究,相信RS会得到更有效的控制。

