负压封闭引流技术联合系统性湿性疗法治疗Ⅳ期压疮效果分析
张冰
(广东医科大学附属医院,广东 湛江 524023)
压疮好发于老年、水肿、长期卧床、营养不良、骨折等患者,是常见局限性损伤[1],虽然目前临床致力于预防压疮,但是压疮发生率仍居高不下[2]。压疮是一项全球性健康问题,不仅会增加患者身心痛苦,也会延长住院时间,提升医疗成本,降低生活质量,甚至会诱发感染等多种并发症,导致患者死亡,特别是Ⅳ期压疮深达皮肤全层,或是累及骨骼、肌腱等,造成伤口经久难愈,危害较大。以往常对Ⅳ期压疮患者采用干性疗法,但对于渗液量巨大、存在坏死组织的患者效果有限。系统性湿性疗法以湿性愈合环境理论为依据,强调以活性敷料营造微酸、无氧、湿润的利于伤口愈合的微环境[3],从而加速伤口愈合。负压封闭引流技术(VSD)首创于1993年,之后被用于处理各种急慢性伤口[4],亦取得理想疗效。本文观察了VSD联合系统性湿性疗法对Ⅳ期压疮患者的临床效果,报告如下。
1 资料与方法
1.1 一般资料
选择2020年1月—2022年2月Ⅳ期压疮患者40 例,按照随机方式分为观察组和对照组,每组20 例。对照组男 8 例,女12 例;年龄(68.8±4.5) 岁;髋部1 例,骶尾部8 例,臀部6 例,大转子2 例,背部3 例。观察组:男7 例,女13 例;年龄(69.3±4.4) 岁;髋部2 例,骶尾部7 例,臀部5 例,大转子3 例,背部3 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入和排除标准
纳入标准:依据美国国家压疮咨询委员会(NPUAP)的相关标准确诊为Ⅳ期压疮;患者知晓研究,自愿参与。排除标准:治疗期间因免疫性疾病、出血性疾病等中断治疗者;合并糖尿病者;依从性差,无法完成疗程者;有通往器官、胸腔的瘘管患者;对所用敷料过敏者;因认知、精神障碍无法配合治疗者。
1.3 方法
对照组采用系统性湿性疗法。干燥坏死期:先行清创,之后外贴水胶体敷料;溃疡渗出期:覆盖黏性敷料+藻酸盐敷料+凝胶填塞,并且每日换药;肉芽组织期:覆盖无菌纱布,填塞凡士林油纱+康倍,隔日换药;上皮形成期:外贴薄型水胶体敷料。
观察组采用VSD联合系统性湿性疗法。干燥坏死期以及上皮形成期:同对照组;溃疡渗出期、肉芽组织期:行VSD治疗,准备一次性负压引流护创材料(山东创康生物科技有限公司;产品注册号:国械注准20183661697),仪器为电动负压吸引器。评估且记录创口深度、腔道方向、创口面积、渗液量;清创、涂抹皮肤保护膜;参照伤口愈合世界联盟指南建议,选用间歇模式,设定中心负压-125 mmHg(1 mmHg≈0.133 kPa),待肉芽组织生长良好、每日引流量不足15 mL时拔除VSD管。
1.4 观察指标
压疮愈合计分表(PUSH)评分:含有渗液量[无(0 分)、少量(1 分,<5 mL/24 h)、中量(2 分,5~10 mL/24 h)、大量(3 分,>10 mL/24 h)]、面积(由小到大为0~10 分)、组织类型(包括肉芽组织、坏死组织等,计0~4分)[5],评分高则提示伤口恶化。
视觉模拟评分法(VAS):借助刻有数字、长10 cm的游标卡尺评估疼痛程度,“0”表示“无痛”,“10”表示“剧痛”,在患者选择出代表自身疼痛程度的数字后,医生予以记录[6]。
创面面积:更换敷料时,以镊子、棉签、数码尺等工具测量创面宽度、长度,再计算创面面积。
血红蛋白(Hb)、红细胞计数(RBC)、白细胞计数(WBC):取3 mL静脉血,测定Hb,RBC,WBC[7]。
血清炎性因子:采集血液检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)。
临床治疗参数:评价肉芽组织增生时间、住院时间、换药次数、治疗费用[8]。
创面恢复情况如下。差:肉芽组织生长情况差,创面有大量坏死细胞组织,颜色暗淡;中:肉芽组织生长情况一般,创面有少量坏死细胞组织,颜色为红色略暗;良:肉芽组织生长良好,创面无坏死细胞组织,颜色为红色;优:新生肉芽组织丰富,创面为亮红色;创面恢复优良率=(优+良)例数/总例数×100%[9]。
并发症发生率:记录并发症例数、类型。
1.5 统计学方法

2 结 果
2.1 两组PUSH和VAS评分及创面面积比较
治疗前,两组PUSH评分、VAS评分和创面面积比较,差异无统计学意义(P>0.05)。治疗后,两组PUSH评分、VAS评分低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05);两组创面面积小于治疗前,且观察组小于对照组,差异有统计学意义(P<0.05)(见表1)。

表1 两组PUSH评分和VAS评分及创面面积比较
2.2 两组Hb和RBC及WBC比较
治疗前,两组Hb,RBC,WBC比较,差异无统计学意义(P>0.05);治疗后,两组Hb和RBC高于治疗前,且观察组高于对照组;两组WBC低于治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05)(见表2)。

表2 两组Hb和RBC及WBC比较
2.3 两组血清炎性因子比较
治疗前,两组IL-6和TNF-α比较,差异无统计学意义(P>0.05);治疗后,两组IL-6和TNF-α低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)(见表3)。
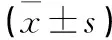
表3 两组血清炎性因子比较
2.4 两组临床治疗参数比较
观察组肉芽组织增生时间、住院时间短于对照组,换药次数、治疗费用少于对照组,差异有统计学意义(P<0.05)(见表4)。
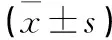
表4 两组临床治疗参数比较
2.5 两组创面恢复情况比较
观察组创面恢复优良率为90%,高于对照组的60%,差异有统计学意义(P<0.05)(见表5)。

表5 两组创面恢复情况比较 单位:例(%)
2.6 两组并发症发生率比较
观察组并发症发生率为5%,低于对照组的30%,差异有统计学意义(P<0.05)(见表6)。

表6 两组并发症发生率比较 单位:例(%)
3 讨 论
压疮是摩擦力、剪切力、压力合作的结果,临床依据压疮所致软组织损伤的解剖学深度进行系统分期[10],旨在指导诊断与治疗。以往常对压疮患者采用干性疗法,该法通过暴露感染的创口,使其脱水干燥结痂,之后借助植皮、手术切痂等清除失活组织,促进创口愈合,亦或是通过使用药物、乙醇湿敷;或借助湿到干的方法,促进炎症消退,加强引流渗液,缩短创口愈合时间。不过对于渗液量巨大、有窦道或潜行难以引流、存在坏死组织、肌腱/骨外露坏死等造成的Ⅲ期、Ⅳ期压疮而言,上述方法效果欠佳。研究发现[11],湿性疗法、VSD能够有效治疗Ⅲ期、Ⅳ期压疮患者,其中湿性疗法有循证依据支持,加之无痛、微创,患者接受度较高,而VSD能够形成密闭环境、增加组织灌注、清除细菌、减轻创口及周围水肿,最终促进创口愈合。
本研究表明,VSD联合系统性湿性疗法对Ⅳ期压疮患者有较好疗效。第一,系统性湿性疗法结合患者压疮及皮肤状况、敷料特点、成本、治疗目标选用恰当敷料,能够取得理想的湿性治疗效果,例如Ⅰ期、Ⅱ期压疮损伤程度较轻,通常选用泡沫敷料、水凝胶、水胶体等,能够促进创口上皮化;Ⅲ期、Ⅳ期压疮,则需结合各阶段治疗目标选用敷料。初期以清创为主,可以选用水凝胶敷料,通过发挥自溶作用实现清创目的,有助于保护暴露的骨骼、肌腱,促进创口愈合,而选用含银敷料重在控制创口感染,适用于严重定植、感染、高危感染类压疮,不过需避免持久使用。一旦创口渗液量巨大,需使用藻酸盐敷料,该类敷料可吸收渗液,加之具有止血功能,能够促进肉芽组织生长,但单用系统性湿性疗法作用有限。近年来,VSD的优越性逐渐得到临床认可。本研究结果显示,观察组PUSH,VAS评分和创面面积、临床治疗参数、创面恢复情况更佳(P<0.05)。分析原因为:一是VSD能够改善创口血流,该法凭借在创口提供物理负压,能够在创口床及周围组织产生压力梯度[12],提高创口血流灌注,扩张微血管,促进血管内皮细胞功能、结构、形态改变,加速分泌血管活性因子,促使毛细血管口径扩大,最终增加创口床血流量,而湿性疗法仅能对创口床起到保持低氧、湿润环境的作用,并不能改善创口血流;二是VSD借助对创口的机械牵拉力还能缩小创口,主要是创口承受物理负压时,容易因机械牵拉力而向中心聚拢,从而减弱创口边缘张力[13],缩小创口面积,同时该机械力也能对细胞增殖、复制产生刺激,加速肉芽组织生长,减少创口深度及面积;三是VSD能改善创口周围组织水肿,因为当创口周围组织承受物理负压时,将会降低其组织压力,减轻微血管后负荷,促进血液流动,清除创口局部堆积的缓激肽、5-羟色胺、组胺、前列腺素等炎性因子,降低血管通透性,减轻周围组织水肿,并且VSD也能促进血管内皮细胞间连接,提高血管基底膜完整性,进而减少组织水肿,但是湿性疗法重在通过吸收过多渗液、借助敷料所含活性成分等减轻组织水肿[14]。第二,清创压疮创面时能够清除大部分感染坏死物质,不过仍存在感染情况,且创口内部还有混合肉芽组织(既有致病菌也有软组织活力),若不彻底清创,容易加重出血,扩大创面,降低后期创面愈合难度,而加用VSD时可以吸走创面细菌与分泌物[15],使留存下的感染组织逐渐成为无菌新鲜肉芽组织,从而控制创面感染,促进肉芽组织生长,提升Hb和RBC,降低WBC。第三,IL-6是促炎症介质,对炎症反应、免疫应答反应有重要作用;TNF-α产生于T细胞、巨噬细胞,能够参与炎症反应,导致血管功能紊乱或损伤内皮细胞,加重炎症损害,影响血液循环。本研究显示观察组IL-6和TNF-α低于对照组(P<0.05),可能是因为VSD联合系统性湿性疗法能够清理分泌物及坏死组织,抑制细菌繁殖,故能降低炎症介质表达水平。第四,本研究显示观察组并发症发生率低于对照组(P<0.05),表明加用VSD还能减少并发症发生,可能与VSD能够尽快促进创口愈合有关。
本研究病例数相对偏少,尚需扩大样本量进一步了解VSD联合系统性湿性疗法的临床应用价值。

