血管内皮生长因子胎盘微血管密度在胎盘植入并发感染患者中的表达及意义
金凤梅, 王丽萍
(1.河北省承德市中心血站, 河北 承德 0670002.承德医学院附属医院, 河北 承德 067000)
胎盘植入原名病态粘附胎盘,是指胎盘绒毛不同程度的侵入子宫肌层,引起产时、产后出血,围生期紧急子宫切除和继发感染、损伤等严重的并发症,甚至母婴双亡[1]。造成胎盘植入的原因与多方面的因素有关,普遍认为与母体子宫内膜的损伤情况、胎盘附着部位、子宫手术史、子宫病变等有关[2,3]。胎盘植入的发生率逐年升高,由胎盘植入引起的产妇病死率已达到7~10%[4]。胎盘植入没有典型的临床症状,临床诊断主要依据高危因素结合超声或者磁共振检查,确诊需要根据手术中或者分娩时所见及分娩后的病理学检查。随着胎盘绒毛侵入的加深,临床超声、磁共振检测的准确性将会降低。因此,早期预测胎盘植入发生及其是否存在并发感染的可能对临床上早期预防、治疗胎盘植入并发感染具有重要意义。大量研究报道,前置胎盘和胎盘植入的诊断均可通过血管内皮生长因子(Vascular endothlialgrowth factor,VEGF)、胎盘微血管密度(Microvesseldensity,MVD)在母体中的含量进行预测[5]。于是推测VEGF、MVD的表达水平可能与胎盘植入并发感染的可能性也存在联系。本研究拟通过检测分析535例胎盘植入患者的胎盘组织、血清中VEGF、MVD的表达水平与胎盘植入并发感染的关系,揭示VEGF、MVD在胎盘植入并发感染的中的价值。
1 资料与方法
1.1临床资料
1.1.1样本来源:样本来自承德医学院附属医院2011年9月至2021年2月期间接诊的胎盘植入患者535例(其中终止妊娠后,发生感染者215例,剩余320例为未发生感染者)孕产妇的胎盘组织和静脉血。从医院病案科收集患者终止妊娠时孕周、病史、年龄、剖宫产次数、人工流产次数等临床资料。病历资料来自承德医学院附属医院病案科。纳入研究的所有住院分娩孕妇均需在住院后3d内采血1.8mL至混有0.2mL的枸杞酸钠真空采血管。胎盘组织的获取均在剖宫产产出胎盘后快速剪取植入病灶区组织或正常胎盘中央组织2块,每块大小为1cm×1cm×1cm的立方块。一块组织用0.9%生理盐水冲洗后-80℃保存,另一块用10%甲醛溶液封闭保存。胎盘植入并发感染诊断标准[6]:发热,体温>37.8℃,且具备以下≥2个条件,除外其他因素,可诊断:①子宫紧张有压痛;②实验培养结果证实;③末梢血白细胞计数>15×109L-1。纳入标准:所有患者均诊断为胎盘植入;临床资料完整;患者对本研究知情同意;排除标准:产前患有高血压、糖尿病、肝肾功能障碍、肿瘤、感染、多器官衰竭等疾病的患者;非单胎妊娠患者;因胎盘植入导致子宫切除者、手术死亡者。
1.1.2实验材料:TRIzol液(Invitrogen)购自北京索莱宝公司;实时荧光定量聚合酶链式反应(Real-time quantitative reverse transcription polymerase chain reaction,RT-qPCR)试剂盒购自TaKaRa公司;人VEGF 酶联免疫吸附试验(Enzyme-linked immunosorbent test,ELISA)检测试剂盒购自上海康朗生物科技有限公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)购自北京康为世纪公司;兔抗血管内皮生长因子(Vascular endothlial growth factor,VEGF)多克隆抗体、兔抗CD34单克隆抗体、辣根过氧化物酶标记的二抗均购自上海艾博抗公司;辣根过氧化物酶标记的链霉亲和素购自北京博尔西科技公司;二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色试剂盒购自北京鼎国昌盛生物公司。
1.2方 法
1.2.1样本处理:将收集的胎盘组织、血清分为胎盘植入并发感染组、未感染组。将收集的全部胎盘组织从-80℃取出,备用。打开10%甲醛溶液中保存的胎盘组织,用于制备石蜡切片。将采取的全部血液抽取上层血清,用于ELISA实验。
1.2.2RT-qPCR实验:将胎盘组织从-80℃取出,无菌研磨。加入3倍组织体积的无菌蒸馏水,充分研磨,然后用TRIzol液提取组织中的总RNA,并将其逆转录为cDNA。再采用SYBR-Green荧光定量PCR检测试剂盒(美国赛默飞世尔科技有限公司)检测VEGF mRNA表达。qRT-PCR检测程序(反应体系:1×SYBR GreenⅠ混合物10μL、0.2μmoL/L PCR上下游引物各0.5μL、重蒸水0.8μL、RT产物2μL、;反应条件:95℃变性(5min),94℃(30s),60℃(30s),72℃(40s),共40个循环)。以GAPDH为内参,2-△△Ct法计算VEGF的相对表达量。反应程序设置程序按照RT-qPCR试剂盒要求设置:95℃,10min,40个循环,60℃,60s。VEGF,上游引物,5'-TGCGGATCAAACCTCACCAA-3',下游引物5'-ACAGTGAACGCTCCAGGATT-3'。GAPDH,上游引物,5'-AAGAGGGATGCTGCCCTTAC-3',下游引物5'-TACGGCCAAATCCGTTCACA-3'。
1.2.3WB实验:将组织从-80℃冰箱中取出,充分研磨。加入5倍体积的裂解液,充分裂解,提取总蛋白。用BCA试剂盒对蛋白定量,沸水中煮沸10min对蛋白变性。用变性后的蛋白上清液用于SDS-PAGE蛋白电泳,将蛋白聚集在琼脂胶上。使用转膜仪将胶上的蛋白转移到PVDF膜,转膜过程需在4℃低温条件下进行。再用2.5%的脱脂奶粉对膜进行37℃封闭2h。结束后,将膜轻轻置入1∶1000倍稀释的兔抗VEGF多克隆抗体溶液中,4℃孵育一夜。取出膜,充分清洗,再浸入1∶500倍稀释的辣根过氧化物酶标记的二抗溶液中,37℃反应1.5h。最后用ECL发光试剂盒显影曝光。
1.2.4ELISA实验:将VEGF ELISA检测试剂盒、待检测血清恢复至室温。按照VEGF ELISA检测试剂盒说明书要求操作,判定血清中VEGF的含量。
1.2.5免疫组织化学实验:参考乔小改等[7]的操作方法,检测组织中VEGF、微血管密度(Placental microvesseldensity,MVD)的表达。免疫组织化学:将组织标本修剪成1cm3组织块,经石蜡包埋,切成4μm厚的切片,再展片、烤片、复水、修复、复温。然后使用山羊血清封闭处理,然后加入稀释的一抗溶液(VEGF,1∶200;CD34,1∶100),4℃孵育过夜。恢复至室温后,充分洗涤,再置于稀释的拉更过氧化物酶标记的二抗溶液、辣根过氧化物酶标记的链霉亲和素。结束后,经DAB显色,复染、脱水、透明、封胶处理。VEGF、CD34判定阳性标准为细胞质呈棕黄色。结果由病理医师采用双盲法独立判定。结果以阳性细胞的百分数作为判定标准:5%及以下为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。细胞染色深度积分法则:无着色为0分,淡黄色1分,棕黄色2分,棕褐色3分。结果:将上述两项的得分的乘积作为总分。总分在0~2分判为阴性,3~12分判为阳性。MVD值的计算采用Weidner法,用CD34标记微血管内皮细胞,棕黄色以上均为阳性。显微镜计数时,采用5点法观察、计数,视野内有染成棕黄色的血管内皮细胞计为1个,取平均值。
1.3统计学分析:数据均使用软件SPSS22.0分析。对符合正态分布的数据,使用均数±标准差表示,两组间比较采用独立样本t检验。定性资料以n(%)表示,行χ2检验;符合正态分布的变量采用Pearson相关分析法分析变量间的相关性。P<0.05表示差异或相关性有统计学意义。
2 结 果
2.1两组患者的临床资料比较:535例胎盘植入患者中,并发感染215例,占40.18%,年龄26~45岁,平均(34.87±4.91)岁;终止妊娠时孕周28~39周,平均(33.91±2.45)周。未并发感染320例,年龄26~43岁,平均(32.03±4.12)岁,终止妊娠时孕周28~39周,平均(33.83±2.43)周。胎盘植入并发感染组35岁以上所占比例、剖宫产次数≥1患者所占比例和人工流产次数≥2患者所占比例均高于胎盘植入无并发感染组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者的资料分析n(%)
2.2VEGF在两组胎盘植入患者胎盘组织中的表达及血清含量:结果如图1A和表2所示,与胎盘植入无并发感染组相比,胎盘植入并发感染组胎盘组织中VEGF的mRNA和蛋白表达均显著升高,血清中VEGF含量显著升高(P<0.05)。免疫组织化学结果如图1B、C所示,与未感染组相比,感染组胎盘组织呈明显的褐色(P<0.05)。

表2 VEGF在两组胎盘植入患者胎盘组织中的表达及血清含量

图1 VEGF蛋白表达及免疫组织化学图A:VEGF蛋白在胎盘组织中的表达;B、C:VEGF在感染组和未感染组胎盘组织中的免疫组织化学图
2.3MVD在胎盘植入并发感染患者胎盘组织中的表达:结果表3所示,与胎盘植入无并发感染组相比,胎盘植入并发感染组胎盘组织MVD值显著升高,差异有统计学意义(P<0.05)。
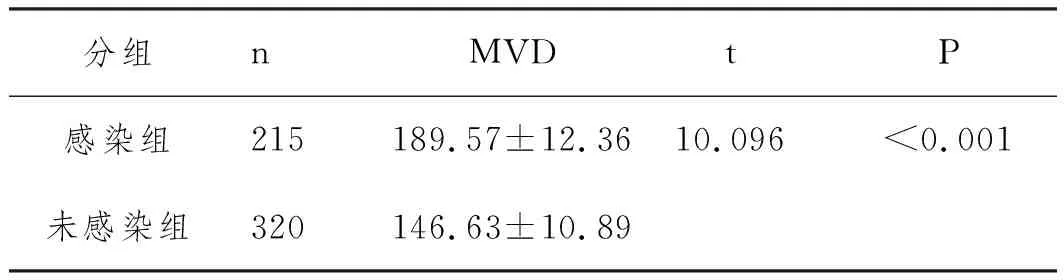
表3 MVD在胎盘中的表达
2.4感染胎盘组织VEGF水平与MVD的相关性:Pearson相关分析,胎盘组织VEGF含量与MVD值呈正相关(r=0.645,P<0.001)。
3 讨 论
胎盘植入并发感染的发生不仅与护理因素相关,还可能与患者体内一些基因表达失调有关[8]。VEGF参与了胚胎血管生成的多种生理病理过程,VEGF可促进胚胎发育,提高子宫内膜容受性,促进发育中的胚胎与子宫内膜的相互作用,参与胚胎着床过程[9]。VEGF在胚胎着床中具有多种的作用,VEGF表达的失调,可能导致不孕、胎盘植入并发症[10]。柳月霞等[11]在研究中发现,VEGF在胎盘植入患者血清中的表达水平明显高于疑似胎盘植入患者或正常孕妇,揭示VEGF在早期胎盘植入诊断的潜在价值。本研究检测了胎盘植入并发感染孕妇、胎盘植入未感染孕妇胎盘、血清中VEGF的表达水平,结果发现VEGF在胎盘组织的表达水平和血清中的含量均明显高于胎盘植入未感染孕妇。这与VEGF在胎盘植入孕妇胎盘中的表达高于前置胎盘孕妇胎盘的研究结果相类似。推测VEGF不仅具有预测胎盘植入发生的可能性,还有预测胎盘植入伴感染的潜力。
MVD的表达水平与妇科疾病、颅神经根疾病的发生、发展紧密相关。乔小改等[7]在研究中报道,MVD在凶险性胎盘前置合并胎盘植入孕妇胎盘中的表达高于未合并胎盘植入孕妇,并且MVD、VEGF在凶险性胎盘前置组织中的表达水平呈正相关。研究报道,MVD在前置胎盘、胎盘植入孕妇胎盘组织中的表达显著上调,并且MVD、VEGF在前置胎盘、胎盘植入孕妇胎盘组织中的表达成正相关,证实MVD、VEGF在胎盘中的表达异常与胎盘植入的发病存在联系。由此可见,MVD、VEGF在胎盘前置、胎盘植入孕妇胎盘中的异常表达确实参与疾病的发生发展过程。本研究检测了MVD在胎盘植入并发感染孕妇、胎盘植入未并发感染孕妇胎盘组织中的表达发现,MVD在胎盘植入并发感染胎盘中的表达明显升高。结合前人的实验结果,暗示孕妇胎盘组织中MVD表达水平可能与该病的凶险程度有关,即MVD越高,胎盘绒毛入侵子宫越严重。此研究还发现,胎盘植入并发感染胎盘组织中MVD、VEGF的表达呈正相关,这与二者在胎盘前置、胎盘植入孕妇胎盘中的表达关系相一致。由这些实验结果猜测,VEGF、MVD在胎盘植入胎盘中的表达量可能能够初步推测孕妇发生胎盘植入并发感染的可能性。本研究是在支持VEGF、MVD可用于预测前置胎盘、胎盘植入发生的基础上,进一步验证VEGF、MVD与胎盘植入并发感染发生相关密切。

