miR-383-3p靶向PTEN/PI3K/Akt/mTOR信号通路对冠心病大鼠内皮细胞凋亡的影响
蔡贵东, 靳孟妮, 王小军, 王宗社, 舒瑞朝, 段朝阳, 马 恩
(1.陕西省宝鸡市中心医院, 陕西 宝鸡 7210002.西安交通大学第二附属医院, 陕西 西安 710004)
冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CHD)是以动脉粥样硬化(atherosclerosis,AS)为病理基础的心血管疾病,而内皮细胞凋亡被认为是AS发生的启动因素[1~3]。因此,有效抑制内皮细胞凋亡可能是CHD有前景的治疗方法,但目前影响内皮细胞凋亡的分子机制仍然未阐明。微小RNA(miRNA)作为长度约18-22个核苷酸的非编码小型内源性RNA,可通过与目标mRNA 3'UTR区配对来负调控基因表达[3]。有研究揭示miR-383-3p在AS、冠状动脉疾病等血管疾病中具有重要作用[4,5],AS大鼠心肌组织中miR-383-3p下调,其过表达可抑制冠状动脉内皮细胞凋亡[4]。但miR-383-3p在CHD中的详细作用机制还不甚清楚。人第10号染色体缺失的磷酸酶/磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白(gene of phosphate and tension homology deleted on chromsome ten/Phosphoinositide 3-kinases/protein kinase B/mammalian target of rapamycin,PTEN/PI3K/AKT/mTOR)在细胞凋亡、自噬过程中具有重要调控作用,抑制PI3K/AKT通路可诱导CHD小鼠内皮细胞凋亡[6]。研究发现,miR-383-5p在乳腺癌中可通过抑制PI3K/AKT/mTOR通路发挥抗肿瘤作用[7],而其对CHD的影响是否与该通路有关还未可知,基于此,本研究以期通过探究miR-383-3p靶向PTEN/PI3K/Akt/mTOR信号通路对CHD大鼠内皮细胞凋亡的影响,为CHD治疗机制研究提供参考。
1 材料与方法
1.1实验动物:将从昆明医科大学购得的90只SD大鼠(SPF级,215-260g)于通风良好及12h/12h正常昼夜交替的环境饲养,许可证:SCXK(滇)K2020-0004。本研究经本院动物伦理委员会批准实施。
1.2试剂及仪器:293T细胞(CM8693X,上海淳麦生物科技);HE染色试剂盒、Lipofectamine 2000 Transfection Reagent、血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒(AR1180、11668027、E-EL-R1430km,上海恒斐生物);BCA试剂盒、双荧光素酶报告基因检测试剂盒(E112-01/02、DD1205-01/02,南京诺唯赞);TUNEL试剂盒、一氧化氮(Nitric Oxide,NO)(1521、XFR31390,上海信帆生物);兔抗Bcl-2、Bax抗体、Goat Anti-Rabbit IgG H&L (HRP)(ab182858、ab32503、ab6721,Abcam);兔抗PI3K、Akt、p-PI3K、p-Akt、PTEN、GAPDH、mTOR、p-mTOR抗体(4249、9272、4228、4060、9559、2118、2983、2971,Cell Signaling Technology);实时荧光定量PCR(Quantitative Real-time,qRT-PCR)试剂盒(F-430,北京美科美生物);内皮素-1(endothelin 1,ET-1)(YS04235B,上海雅吉生物);血管内皮生长因子(vascular endothelial growth factor,VEGF)(ab100786,深圳海思安生物);凝胶成像系统E-Gel Imager(广州市科之蓝仪器);全自动生化分析仪PUZS-300(上海帝博思生物)。
1.3 方 法
1.3.1分组和CHD模型大鼠构建:将大鼠分为control组、CHD组(模型组)、mimic NC组、miR-383-3p mimic组、miR-383-3p mimic+pcDNA3.1组、miR-383-3p mimic+pcDNA3.1-PTEN组,每组15只;造模前24h及造模后每两周,mimic NC组、miR-383-3p mimic组、miR-383-3p mimic+pcDNA3.1组、miR-383-3p mimic+pcDNA3.1-PTEN组大鼠分别于尾静脉注射100μL慢病毒液(50μg/100mL)及质粒,control组、CHD组注射等量生理盐水;除control组外其余组大鼠进行CHD模型构建:连续6周饲喂大鼠高脂饲料(猪油15%、胆固醇5%、胆酸钠0.2%、丙基硫氧嘧啶0.2%+基础饲料79.6%)后间隔24h,连续3d腹腔注射垂体后叶素(30μg/kg)[8],生理记录仪进行心电图检测,Ⅱ导联心电图中J点位移均≥0.2mV,表明全部建模成功[9];control组饲喂正常基础饲料并腹腔注射等量的生理盐水。
1.3.2qRT-PCR检测冠状动脉miR-383-3p、PTEN表达:造模结束后从每组大鼠中随机挑选5只,颈椎脱臼处死后室温下分离获取其冠状动脉,经液氮冷冻后,添加预冷的Trizol试剂进行匀浆,依次添加氯仿、异丙醇、乙醇处理以提取冠状动脉总RNA,经微量核酸仪测定其浓度及纯度后逆转录成cDNA,以cDNA为模板,分别以U6、GAPDH为内参,进行qRT-PCR扩增(引物见表1),扩增程序:95℃ 30s、95℃变性5s、60℃退火30s、72℃延伸30s,×30,2-△△Ct计算miR-383-3p、PTEN表达(n=5)。
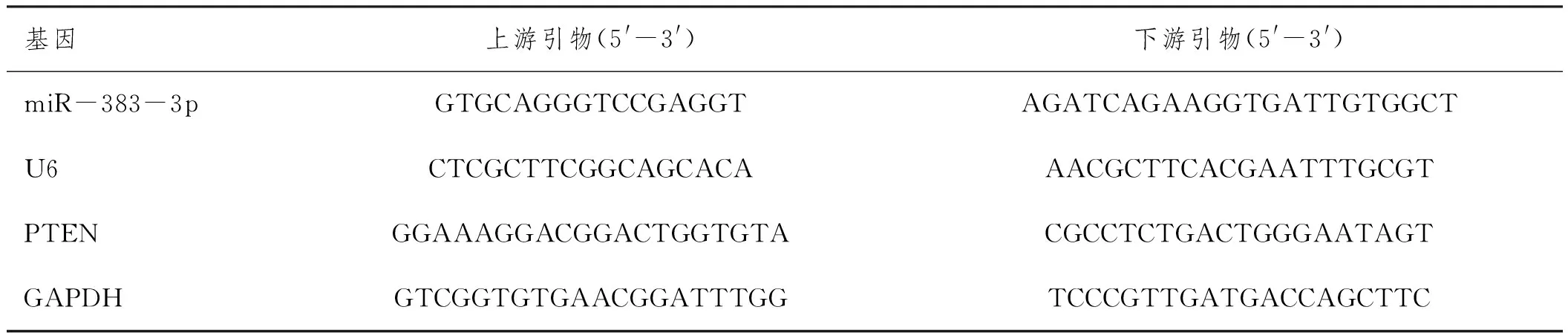
表1 引物序列
1.3.3全自动生化分析仪测定大鼠血脂水平:抽取大鼠腹主动脉血5mL,静置1h后,进行3000r/min离心(15min)取上清液,4℃保存。使用全自动生化分析仪测定血清中三酰甘油(Triglyceride,TG)、低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL-C)、总胆固醇(Total Cholesterol,TC)水平(n=10)。
1.3.4ELISA法检测血清AngⅡ、ET-1、VEGF、NO水平:使用ELISA试剂盒检测2.3所得血清中AngⅡ、ET-1、VEGF、NO水平(n=10)。
1.3.5HE染色观察冠状动脉组织病理变化:从每组中挑选5只大鼠,将其冠状动脉组织浸于多聚甲醛中,脱水后将组织包埋于石蜡中,制成4μm切片后HE染色,依次经脱水、透明、封片后光镜下观察(×200)。
1.3.6TUNEL法检测冠状动脉内皮细胞凋亡:将2.5所制切片置于TUNEL反应液中进行避光孵育(1h),PBS洗涤,经过DAB染色及封片后于400倍光镜下观察棕黄色凋亡细胞(n=5),凋亡指数(AI)%=(凋亡数/总细胞数)×100%。
1.3.7双荧光素酶报告基因实验验证miR-383-3p与PTEN靶向关系:starBase2.0网址预测miR-383-3p与PTEN的结合位点;将PTEN上与miR-383-3p结合的片段进行扩增后插入到pmirGLO载体,以构建野生型PTEN-wt质粒;使用基因突变技术对二者结合位点进行突变,构建突变型PTEN-mut质粒。将293T细胞分为PTEN-wt+miR-383-3p mimics组、PTEN-wt+mimic NC组、PTEN-mut+miR-383-3p mimics组、PTEN-mut+mimic NC组,将mimic NC、miR-383-3p mimics分别与PTEN-wt、PTEN-mut共转染到293T细胞,经24h培养后测定萤火虫、海肾荧光值,计算293T细胞的荧光素酶相对活性;将293T细胞分为control组、mimic NC组、miR-383-3p mimics组,使用mimics-NC、miR-383-3p进行转染,Western blot检测PTEN蛋白表达。
1.3.8Western blot检测冠状动脉组织Bcl-2、Bax及PTEN/PI3K/Akt/mTOR通路蛋白表达:将每组其余5只大鼠处死,取冠状动脉组织于冰上裂解并提取总蛋白,BCA法定量后通过SDS-PAGE电泳进行蛋白分离,经转膜及封闭后孵育GAPDH、PI3K、Akt、p-PI3K、p-Akt、Bcl-2、Bax、PTEN、mTOR、p-mTOR抗体(兔抗1∶1000)一抗过夜(4℃),次日孵育经1∶2000稀释的HRP-IgG二抗,ECL显色,通过凝胶成像仪曝光拍照,Image J软件分析各蛋白的条带灰度值,计算PI3K、Akt、p-PI3K、p-Akt、Bcl-2、Bax、PTEN、mTOR、p-mTOR表达(n=5)。
2 结 果
2.1各组大鼠冠状动脉组织miR-383-3p、PTEN表达比较:结果显示miR-383-3pmimic可显著增加miR-383-3p表达水平(P<0.05),pcDNA3.1-PTEN可显著增加PTEN mRNA表达水平(P<0.05),见图1。
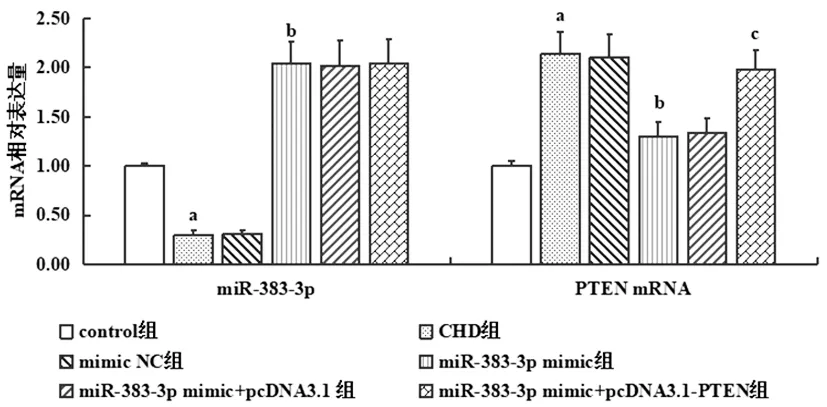
图1 各组大鼠冠状动脉组织miR-383-3p、PTEN表达比较注:与control组相比,aP<0.05;与CHD组相比,bP<0.05;与miR-383-3p mimic组相比,cP<0.05
2.2各组大鼠血脂水平比较:结果显示CHD大鼠TG、LDL-C、TC水平显著增加(P<0.05),HDL-C水平显著降低(P<0.05),miR-383-3p过表达可显著降低CHD大鼠TG、LDL-C、TC水平(P<0.05),显著增加HDL-C水平(P<0.05),而PTEN高表达则可显著逆转miR-383-3p对CHD大鼠血脂水平的改善作用(P<0.05),见图2。

图2 各组大鼠血脂水平比较注:与control组相比,aP<0.05;与CHD组相比,bP<0.05;与miR-383-3p mimic组相比,cP<0.05
2.3各组大鼠血清AngⅡ、ET-1、VEGF、NO水平比较:结果显示,CHD大鼠血清ET-1、AngⅡ水平显著升高(P<0.05),VEGF、NO水平显著减少(P<0.05);miR-383-3p过表达可显著降低CHD大鼠ET-1、AngⅡ水平(P<0.05),显著增加VEGF、NO水平(P<0.05);而PTEN高表达则可显著逆转miR-383-3p对CHD大鼠内皮细胞功能障碍的改善作用(P<0.05),见图3。

图3 各组大鼠血清AngⅡ、ET-1、VEGF、NO水平比较注:与control组相比,aP<0.05;与CHD组相比,bP<0.05;与miR-383-3p mimic组相比,cP<0.05
2.4HE染色观察冠状动脉组织病理变化:结果显示CHD大鼠冠状动脉结构模糊形态不规则,内皮细胞呈无序排列;miR-383-3p过表达后冠状动脉结构明显得到改善;而PTEN过表达则可逆转miR-383-3p过表达的上述改善作用,见图4。

图4 HE染色观察冠状动脉组织病理变化(HE,比例尺:50μm)
2.5各组大鼠内皮细胞凋亡比较:结果显示CHD大鼠内皮细胞凋亡显著增加(P<0.05);miR-383-3p过表达可显著抑制内皮细胞凋亡(P<0.05);而PTEN过表达则可显著逆转miR-383-3p对内皮细胞凋亡的抑制作用(P<0.05),见图5、6。
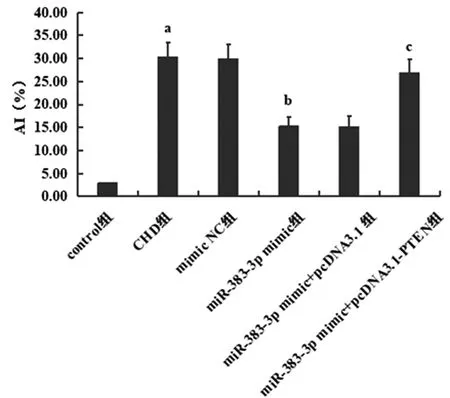
图5 各组大鼠内皮细胞凋亡比较注:与control组相比,aP<0.05;与CHD组相比,bP<0.05;与miR-383-3p mimic组相比,cP<0.05

图6 各组大鼠内皮细胞凋亡比较(TUNEL,比例尺:50μm)
2.6各组大鼠冠状动脉组织Bcl-2、Bax表达比较:通过Western blot检测冠状动脉组织Bcl-2、Bax表达情况,结果显示CHD大鼠冠状动脉组织Bax表达显著升高(P<0.05),Bcl-2表达显著减少(P<0.05);miR-383-3p过表达显著降低Bax表达(P<0.05),显著增加Bcl-2表达(P<0.05);而PTEN过表达则可显著逆转miR-383-3p对上述蛋白表达的影响(P<0.05),见图7。
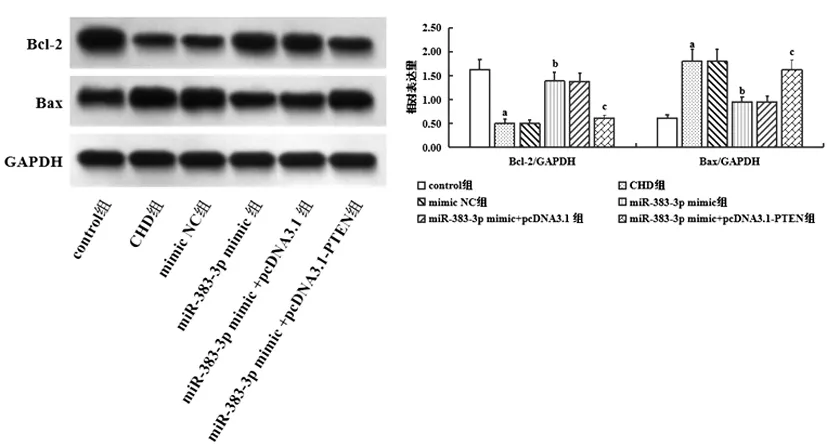
图7 各组大鼠冠状动脉组织Bcl-2、Bax表达比较注:与control组相比,aP<0.05;与CHD组相比,bP<0.05;与miR-383-3p mimic组相比,cP<0.05
2.7miR-383-3p与PTEN靶向关系验证:TargetScan预测显示:miR-383-3p与PTEN存在结合位点,见图9(a);为探究miR-383-3p对PTEN调控作用,通过双荧光素酶报告基因实验对miR-383-3p与PTEN靶向关系进行验证,结果显示miR-383-3p过表达可显著降低荧光素酶相对活性(P<0.05),见图9(b),并且显著降低PTEN蛋白表达水平(P<0.05),见图8(c)、(d)。

图8 miR-383-3p与PTEN靶向关系验证a, miR-383-3p与PTEN结合位点;b,荧光素酶相对活性比较(与PTEN-wt+mimic NC组相比,aP<0.05。);c, miR-383-3p过表达对PTEN蛋白表达的影响;d Western blot检测PTEN蛋白表达的量化图
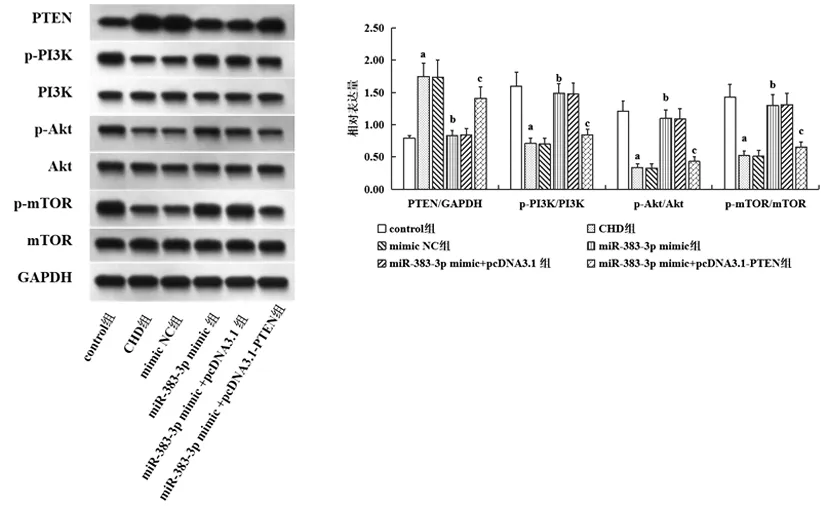
图9 各组大鼠冠状动脉组织PTEN/PI3K/Akt/mTOR通路蛋白表达比较注:与control组相比,aP<0.05;与CHD组相比,bP<0.05;与miR-383-3p mimic组相比,cP<0.05
2.8各组大鼠冠状动脉组织PTEN/PI3K/Akt/mTOR通路蛋白表达比较:通过Western blot实验检测大鼠冠状动脉组织PTEN/PI3K/Akt/mTOR通路相关蛋白表达情况,结果显示CHD大鼠冠状动脉组织PTEN表达显著升高(P<0.05),p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR表达显著减少(P<0.05);miR-383-3p过表达显著降低PTEN表达(P<0.05),显著增加p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR表达(P<0.05);而PTEN过表达则可显著逆转miR-383-3p过表达对p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR表达的促进作用(P<0.05),见图9。
3 讨 论
CHD是一种威胁人类健康的常见心血管疾病,其发生与内皮细胞损伤等AS过程密切相关,内皮细胞损伤、长期高脂血症及炎症反应可导致内皮功能障碍,致使脂质进入动脉内膜下,逐渐演变成AS斑块,最终导致CHD发生[10]。因此,拮抗内皮细胞损伤对CHD治疗具有重要意义。
miRNA广泛参与细胞生长和凋亡的调控,与冠状动脉疾病、AS、心肌梗塞等多种心血管疾病的发生有关[4,10]。miR-383-3p作为miRNA成员之一,被发现在AS大鼠心肌组织中表达下调,其过表达可通过抑制白介素1受体Ⅱ表达减轻炎症反应,抑制冠状动脉内皮细胞凋亡,促进内皮细胞存活及血管构建[4]。炎症反应时巨噬细胞中激活的缺氧诱导因子1α可通过抑制miR-383表达增加腺苷三磷酸消耗,增加细胞坏死性凋亡,从而促进AS小鼠病变进程[11]。但目前关于miR-383-3p在CHD中的影响机制研究甚少,而本研究发现,miR-383-3p在CHD大鼠冠状动脉组织中表达明显降低,与前人研究相一致[4],表明miR-383-3p参与大鼠CHD的发生。在生理状态下,NO/ET处于动态平衡,当发生血管内皮损伤时,调控血管收缩的ET及AngⅡ水平显著增加,而具有维持血管稳态作用的NO水平显著降低[12]。本研究发现,miR-383-3p过表达可显著增加HDL-C、VEGF、NO水平、Bcl-2表达水平,减少TG、LDL-C、TC、ET-1、AngⅡ水平、冠状动脉组织病理损伤程度、内皮细胞AI、Bax表达,该结果表明,miR-383-3p过表达能够有效降低CHD大鼠血脂水平及冠状动脉内皮细胞凋亡,改善内皮细胞功能障碍及病理损伤,有作为CHD潜在治疗靶点的潜能。
PI3K作为一种磷脂酰肌醇激酶,可通过磷酸化为PIP3来激活Akt和下游效应器mTOR,以此参与细胞存活及凋亡,而其上游因子PTEN则可将PIP3去磷酸化为PIP2,因此被作为PI3K拮抗剂[13]。有报道称,miR-26a-5p可通过靶向PTEN激活PI3K/Akt通路,促进冠状动脉疾病小鼠内皮细胞增殖,抑制细胞凋亡[6]。三氯生可通过抑制PI3K/Akt/mTOR通路刺激人脐静脉内皮细胞(HUVEC)损伤[14]。本研究生物信息学分析发现,PTEN是miR-383-3p的靶向基因,miR-383-3p过表达能够显著抑制CHD大鼠冠状动脉组织中PTEN表达,促进p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR表达,该结果表明miR-383-3p能够通过抑制PTEN表达激活PI3K/Akt/mTOR信号通路。猜测miR-383-3p过表达对CHD大鼠冠状动脉内皮细胞凋亡的抑制作用是否可能与其调控该通路有关,基于此猜想,本研究在miR-383-3p过表达基础上对PTEN进行过表达,发现,PTEN过表达可逆转miR-383-3p高表达对CHD大鼠内皮细胞凋亡及功能损伤的改善作用,该结果表明,miR-383-3p可通过靶向抑制PTEN表达激活PI3K/Akt/mTOR信号通路,从而起到抑制CHD大鼠内皮细胞凋亡,改善内皮损伤的作用。
综上所述,miR-383-3p可通过靶向抑制PTEN表达来激活/PI3K/Akt/mTOR信号通路,从而起到抑制CHD大鼠内皮细胞凋亡的作用。本研究为CHD治疗靶点的寻找提供了新方向。本研究目前仅限于大鼠体内实验,对体外细胞实验还有所欠缺,因此,在后续会继续深入。

