敲低CircCDR1as在糖皮质激素诱导的骨微血管内皮细胞活性及血管生成中的作用研究
艾克热木江·阿尔肯, 日夏提·帕尔哈提, 张 峥, 翟 生
(新疆医科大学第五附属医院骨科中心, 新疆 乌鲁木齐 830011)
股骨头坏死(osteonecrosis of the femoral head,ONFH)是临床常见的股骨头血液循环障碍性疾病,以缺血性坏死为主,具有进行性、多发性和致残性等特点[1]。ONFH通常发生在20~50岁之间的个体中,患者在早期阶段无明显症状,随着病程的进展在5年内将发生股骨头塌陷,大约65%的ONFH患者最终需要全髋关节置换术,这给患者和社会带来巨大的经济和医疗负担[2]。ONFH发病原因复杂,糖皮质激素是一类临床常用的抗炎药物和免疫抑制剂,而过量使用糖皮质激素是引发ONFH的重要危险因素。人股骨头骨微血管内皮细胞(bone microvascular endothelial cells,BMECs)是构成附着在骨小梁上的单层结构,能够与血液中的成分直接接触,除了为骨组织和骨细胞提供氧气和营养外,还具有内分泌功能,对于维持股骨头内正常微环境具有重要意义。以往研究表明,ONFH部位存在着不同程度的BMECs损伤或功能障碍异常,导致股骨头骨质血运异常[3,4],这与ONFH的发生发展关系密切。环状RNA(CircRNA)是一种共价键合的非编码RNA,来自前体mRNA的线性RNA的反向剪接,在人类疾病中发挥各种调节作用。小脑变性相关蛋白1反义转录物(cerebellar degeneration-related protein 1 antisense,CDR1as)由X染色体上的DNA反义链转录后剪切不同外显子的 3' 端供体和 5'端受体,以3'-5'磷酯共价键结合环化,再剪切内含子后形成的 circRNA,参与癌症、骨病和代谢性疾病的病理进程[5]。本实验将shCDR1as转染至人BMECs中敲低CircCDR1as表达,再经过糖皮质激素诱导后观察BMECs生长及血管形成的变化情况,以探究CircCDR1as在ONFH中对BMECs生理功能的影响。
1 资料与方法
1.1临床资料:收集2020年10月至2021年12月在我院进行治疗的患有糖皮质激素诱导的7例ONFH患者的股骨头组织,作为ONFH组,其中男性5例,女性2例,年龄41~68岁,平均年龄(46.55±4.27)岁,另收集同期7例因股骨颈骨折行全髋关节置换术患者的无病变正常股骨头组织,作为对照组,其中男性6例,女性1例,年龄40~69岁,平均年龄(44.85±4.23)岁。排除因酒精、创伤或缺血诱发的ONFH以及HIV、乙型或丙型肝炎感染的患者。每位患者对实验知情同意且签署知情同意书,并在我院伦理委员会指导下进行研究。
1.2主要材料与试剂:氢化可的松(美国辉瑞公司),HE染色液(北京雷根生物公司),M-MLV反转录试剂盒和MTT细胞增殖检测试剂盒(北京索莱宝生物公司),Trizol试剂盒和实时荧光定量PCR扩增试剂盒(日本Takara公司),内皮细胞培养基(美国ScienCell公司),Triton X-100染液(上海翌圣生物公司),Lipofectamine RNAiMAX(美国Invitrogen公司),EdU染料(北京凯诗源生物公司),Matrigel(美国Corning公司),PVDF膜(瑞氏Roche公司),RIPA缓冲液、Bradford蛋白检测试剂盒、ECL显色液及DAPI染料(上海碧云天生物研究所),FITC标记的CD31抗体、CD54抗体、CD144抗体、CD34抗体、CD45抗体、CD117抗体(英国Abcam公司),vWF、VEGF、VEGFR-2、GAPDH抗体及Alexa Fluor 488标记的荧光抗体(北京博奥森生物公司)。shNC和shCDR1as由广州锐博生物公司合成,基因引物序列交由上海生工生物工程公司合成。
1.3方 法
1.3.1HE染色:将两组患者股骨头组织用10%福尔马林固定,置于10%EDTA溶液脱钙6周。梯度酒精脱水,包埋在石蜡中,切成厚度为5μm的切片,二甲苯脱蜡,梯度酒精复水,加入苏木精染色5min,伊红染色2min,常规脱水透明,中性树胶封片,在光学显微镜下观察股骨头内骨髓组织坏死程度,并摄取图片。
1.3.2实时荧光定量聚合酶链式反应:Trizol法提取组织或细胞总RNA,微量核酸测定仪检测总RNA的纯度、浓度。按照M-MLV试剂盒说明书操作将总RNA进行逆转录合成cDNA,qRT-PCR实验进行扩增反应,具体参照实时荧光定量PCR扩增试剂盒说明配制反应体系,通过Applied Biosystems 7500 PCR仪器定量检测,反应程序设为两步快速循环法,设置为:95 ℃ 10 min,1次循环;95 ℃ 15 s,60 ℃ 1min,40次循环,扩增结束后,采用2-ΔΔCt法计算目的基因的相对表达水平。基因引物序列如下:CircCDR1as,上游引物5'-CGTCTTCCAGCATCTCTGTGT-3',下游引物5'-GCCATCGGAAACCCTGGATA-3';GAPDH(内参基因),上游引物5'-AATCCCATCACCATCTTCC-3',下游引物5'-CATCACGCCACAGTTTCC-3'。
1.3.3股骨头BMECs分离培养与鉴定:在无菌条件下将收集的股骨颈骨折行全髋关节置换术患者的股骨头组织剥开,去掉筋膜及其它杂质,切成细小骨粒,将其放入肝素化的培养管中,用预热的HBSS液反复冲洗,去除油脂及细碎骨质,具体参照文献方法分离培养人BMECs。将细胞重悬于完全性内皮细胞培养基中,置于37℃、体积分数5%CO2环境条件下常规传代培养。培养14d后,通过倒置显微镜观察细胞生长情况与形态特征。为了评估细胞表面标志物,用0.25%胰蛋白酶处理BMECs,PBS洗涤,FACS 缓冲液重悬细胞,并与FITC标记的抗CD31抗体、抗CD54抗体、抗CD144抗体、抗CD34抗体、抗CD45抗体及抗CD117抗体在4℃环境下避光孵育30min,PBS洗涤,通过流式细胞仪分析细胞表面标记蛋白表达。
1.3.4细胞免疫荧光染色:将分离培养的生长良好的BMECs接种至防脱片载玻片上,置于37℃、体积分数5%CO2环境条件下培养12h。PBS洗涤后,以4%多聚甲醛固定,使用0.1%Triton X-100孵育穿透10min,10%山羊血清室温封闭2h,滴加特异性一抗CD31(1∶200)和vWF(1∶200),置于4℃下共孵育过夜。次日,PBS洗涤,将其与Alexa Fluor 488标记的二抗在室温下共孵育1h,PBS清洗后,DAPI避光孵育30min,结束后封片,自然晾干,通过激光共聚焦显微镜观察染色情况,并摄取图片。
1.3.5细胞转染与分组处理:实验分为四组,具体分组与处理如下:①对照组,BMECs正常培养;②GC组,采用0.1mg/mL糖皮质激素氢化可的松培养BMECs 24h;③shNC+GC组,将shNC转染至BMECs后,再用0.1mg/mL氢化可的松培养24h;④shCDR1as+GC组,将shCDR1as转染至BMECs后,再用0.1mg/mL氢化可的松培养24h。细胞转染中,利用Lipofectamine RNAiMAX分别将shNC和shCDR1as序列转染至对应的shNC+GC组与shCDR1as+GC组BMECs,实验步骤严格参照试剂盒说明书操作。
1.3.6MTT法:收集各处理组BMECs,调整密度按1×105个/孔植入96孔板内,置于37℃、体积分数5%CO2环境条件下培养。培养至24h、48h、72h,加入50μL MTT试剂液至待测细胞孔,轻轻混匀,继续孵育4h,洗掉上清,再加入150μL DMSO至待测细胞孔,在摇床上振荡10min,待结晶物完全溶解,在酶标仪上检测490nm处各孔的吸光度(OD)值。
1.3.7EdU染色:收集各处理组BMECs,调整密度以1×105个/孔植入24孔板内,加入10μmoL/L EdU染色,PBS清洗,再以Apollo567避光染色30min,DAPI避光孵育30min,进行染核,洗涤后封片,自然晾干,通过激光共聚焦显微镜观察细胞染色情况并摄取图片,红色荧光为EdU阳性细胞,随机选择5个视野,计数该视野下EdU阳性细胞数目与总细胞数目,以两者比值作为EdU阳性细胞率。
1.3.8体外成管实验:将稀释的Matrigel添加于24孔板内,每孔铺胶150μL,均匀平铺后置于室温下,待其凝固成胶,备用。将各处理组BMECs按5×104个/孔植入铺有Matrigel的24孔板内,并放入37℃、体积分数5%CO2环境条件下培养,24h后,通过光学显微镜观察成管情况,随机选择5个视野,计数该视野下成管数目。
1.3.9Western blot:在各处理组BMECs中加入预冷RIPA缓冲液,置于冰上裂解后提取总蛋白,Bradford法检测蛋白浓度。将蛋白样品与上样缓冲液混合,煮沸10min使其变性,制备10% SDS-PAGE凝胶,将处理后蛋白加至加样孔内,恒压电泳分离蛋白,通过湿转仪转至PVDF膜,再将膜浸入5%脱脂奶粉,室温封闭2h,TBST洗膜,滴加一抗,4℃孵育过夜。次日,TBST洗膜,滴加对应二抗,室温放置1h,TBST再次洗膜,ECL显色,经过凝胶成像系统扫膜后拍摄图片,Image J软件分析蛋白条带灰度值,以目的蛋白与GAPDH的灰度值之比统计各目的蛋白的相对表达量。
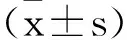
2 结 果
2.1ONFH患者与股骨颈骨折患者的股骨头组织病理学特征比较:HE染色结果显示,对照组股骨颈骨折患者的骨小梁较粗,骨细胞结构完整,而ONFH组可见骨髓结构紊乱,骨髓坏死,有空骨腔出现,成典型的ONFH病理形态,见图1。

图1 ONFH患者与股骨颈骨折患者的股骨头组织病理学观察(HE染色,×100)
2.2CircCDR1as在ONFH组织中的表达检测结果:qRT-PCR检测结果显示,ONFH组织中CircCDR1as相对表达量显著高于对照组组织中CircCDR1as相对表达量(P<0.05),见图2。

图2 qRT-PCR测定ONFH组织与股骨颈骨折组织内CircCDR1as表达水平注:与对照组比较,*P<0.05
2.3BMECs的鉴定结果:分离的细胞在原代培养14d后,使用倒置显微镜观察到细胞呈现梭形,汇合形成单层,基本覆盖培养皿底部,见图3A。用流式细胞术检测该细胞是否存在特征性造血和内皮标志物,发现CD31、CD54和CD144均呈阳性表达,而CD34、CD45和CD117均呈阴性表达,见图3B。通过细胞免疫荧光染色检测到,细胞内CD31与vWF均明显表达,见图3C,由此说明成功分离到BMECs。

图3 BMECs的鉴定注:A:倒置显微镜观察细胞生长与形态(×100);B:流式细胞术检测细胞表面标记物表达;C:细胞免疫荧光染色观察CD31与vWF表达(×100)。
2.4各组BMECs中CircCDR1as表达水平比较:BMECs进行转染处理后,qRT-PCR检测各组细胞内CircCDR1as表达水平,结果显示,转染shCDR1as的细胞内CircCDR1as相对表达量显著低于对照组和shNC组(P<0.05),见图4A,表明转染成功。此外,与对照组比较,GC组CircCDR1as相对表达量显著上调(P<0.05);与shNC+GC组比较,shCDR1as+GC组CircCDR1as相对表达量显著下调(P<0.05),见图4B。

图4 各组BMECs中CircCDR1as表达水平比较注:A:qRT-PCR检测BMECs转染效果,与对照组比较,*P<0.05;B:qRT-PCR检测不同处理组BMECs内CircCDR1as表达水平,与对照组比较,*P<0.05;与shNC+GC组比较,#P<0.05。
2.5敲低CircCDR1as对GC诱导的BMECs活性的影响:MTT法测定各组BMECs增殖活性,检测结果显示,在培养24、48、72h后,与对照组比较,GC组细胞增殖活性显著下降(P<0.05),而shCDR1as+GC组细胞增殖活性显著高于shNC+GC组(P<0.05),见图5A。EdU染色后观察到,各组BMECs内呈现不同程度红色荧光染色,与对照组比较,GC组红色染色细胞数目减少,EdU阳性细胞率显著降低(P<0.05);与shNC+GC组比较,shCDR1as+GC组红色染色细胞数目明显增多,EdU阳性细胞率显著升高(P<0.05),见图5B。

图5 各组BMECs增殖能力比较注:A:MTT法检测各组BMECs增殖活性;B:EdU染色检测各组BMECs增殖水平,与对照组比较,*P<0.05;与shNC+GC组比较,#P<0.05。
2.6敲低CircCDR1as对GC诱导的BMECs血管生成的影响:经体外成管实验检测发现,GC组细胞形成的管腔数目显著少于对照组细胞形成的管腔数目(P<0.05);另外,shCDR1as+GC组细胞形成的管腔数目又显著多于shNC+GC组细胞形成的管腔数目(P<0.05),见图6。

图6 体外成管实验检测各组BMECs血管形成情况注:与对照组比较,*P<0.05;与shNC+GC组比较,#P<0.05。
2.7Western blot检测结果显示,与对照组比较,GC组细胞内VEGF与VEGFR-2的蛋白相对表达量显著下调(P<0.05);与shNC+GC组比较,shCDR1as+GC组细胞内VEGF与VEGFR-2的蛋白相对表达量则显著上调(P<0.05),见图7。
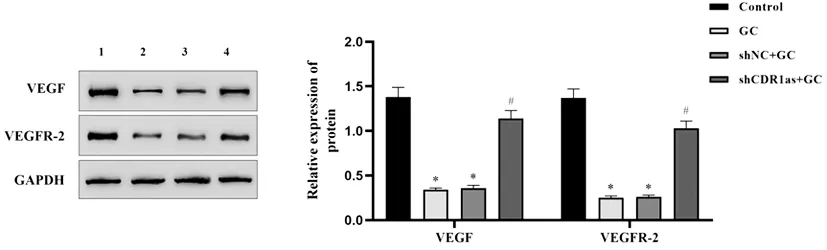
图7 Western blot检测各组BMECs内VEGF与VEGFR-2蛋白表达水平注:1:对照组;2:GC组;3:shNC+GC组;4:shCDR1as+GC组。与对照组比较,*P<0.05;与shNC+GC组比较,#P<0.05。
3 讨 论
目前,糖皮质激素常用于治疗严重急性呼吸综合征、急性淋巴细胞白血病、多发性骨髓瘤、系统性红斑狼疮以及类风湿性关节炎等疾病[6,7]。其中5%~40%的患者在使用大剂量糖皮质激素后出现ONFH,而由糖皮质激素诱发ONFH的发生率在非创伤性ONFH中居首位。糖皮质激素诱发的ONFH是多种内外因素引发股骨头髓内微血管病变,血栓形成致使股骨头供血供氧不足,引起骨细胞死亡,最终导致股骨头结构改变甚至完全塌陷,此外,过量使用糖皮质激素可导致脂质代谢紊乱、血管内皮损伤、髓质脂肪堆积及成骨细胞无序分化,阻碍骨修复和骨重建[8]。然而,导致糖皮质激素诱发ONFH的确切发病机制和分子机制仍不清楚。由于进行活检以诊断糖皮质激素诱导的ONFH在临床上是不可行的,因此迫切需要用于早期诊断的生物标志物,这对于ONFH的早期诊断和治疗十分关键。
BMECs受损或功能障碍会导致股骨头微循环障碍,这是糖皮质激素诱导的ONFH发展的关键。据报道指出糖皮质激素刺激对BMECs转录组影响显著,能够诱导特异性基因表达,调控BMECs生理活动进而影响ONFH的早期阶段[9];研究表明糖皮质激素可以诱导BMECs中miRNA的差异表达,这有助于糖皮质激素诱导的ONFH的进一步发展[10]。此外,研究指出从糖皮质激素诱导的ONFH患者股骨头组织分离的BMECs,其活性、血管形成及迁移能力均降低,但细胞凋亡水平明显增加[11]。在本研究中,从股骨颈骨折行全髋关节置换术患者的股骨头组织中分离出BMECs,观察到其呈典型的内皮细胞形态,细胞表面标记物CD31、CD54和CD144均呈阳性表达,而CD34、CD45和CD117均呈阴性表达,并表现出CD31和vWF高表达,这些结果均表明成功分离到BMECs。而在使用糖皮质激素诱导后,BMECs增殖活性和EdU阳性细胞率均下降,该结果进一步说明了糖皮质激素诱导能够使BMECs活性下降,这可能影响ONFH病理进程的关键环节。
本研究经检测发现,ONFH患者股骨头组织内骨髓结构紊乱,有大量骨髓坏死和空骨腔出现,且CircCDR1as在ONFH患者股骨头组织内表达明显上调,由此推测,CircCDR1as可能参与ONFH的发生发展。许多CircRNA在进化上是相当保守的,并且参与了多种人类疾病的发生和发展,目前,已揭示了CircCDR1as在几种疾病中的表达水平及具体作用,例如,ZAghajani等[12]研究指出CircCDR1as在前列腺癌组织中表达水平异常升高,并前列腺癌的肿瘤细胞行为和表型方面发挥着关键作用;研究表明非创伤性ONFH患者血浆中CircCDR1as表达上调,且局部坏死组织中的CircCDR1as表达水平也明显高于邻近正常组织,其表达与患者的疾病严重程度呈正相关[13]。根据以上研究结果,CircCDR1as可能作为评估糖皮质激素诱导的ONFH进展的潜在生物标志物。本研究结果还显示,敲低CircCDR1as能够抑制糖皮质激素诱导的BMECs活性下降,对BMECs起到一定的保护作用。
研究证明,ONFH患者BMECs血管生成活性降低反映了BMECs的功能障碍[14]。BMECs排列在血窦和血管内层,在血管稳态和血管生成中发挥关键作用,由于持续暴露于糖皮质激素刺激下,会致使局部BMECs功能障碍并诱导细胞凋亡,而BMECs凋亡或功能障碍会损害血管修复与血管生长过程,最终导致股骨头局部血流减少,这加速了ONFH的恶化[15]。因此,BMECs的血管生成能力下降可能是糖皮质激素诱导的ONFH的潜在机制。本研究结果显示,在糖皮质激素诱导后,BMECs的血管形成能力降低,VEGF与VEGFR-2的蛋白相对表达量均下调,说明血管生成受到抑制。BMECs管腔的形成是新生血管生成的第一步,这对于骨修复和骨重塑至关重要。血管生成由多种分子机制驱动,VEGF是生理和病理生理条件下血管生成的关键介质,能够通过促进血管内皮细胞的分裂和生长来诱导血管生成,并与骨形成中间充质浓缩、软骨形成、软骨吸收和血管侵袭等步骤密切相关[16]。VEGFR-2是作为一种酪氨酸激酶受体,可通过其细胞外结构域与VEGF结合,激活其下游信号转导通路,进而促进血管生成。在本研究中,敲低CircCDR1as促进了糖皮质激素诱导的BMECs血管生成,提高了细胞内VEGF与VEGFR-2的蛋白相对表达量,由此提示,CircCDR1as能够影响糖皮质激素诱导的BMECs血管生成进而参与ONFH的病理进程,敲低CircCDR1as可对ONFH中血管生成起到促进作用。
综上所述,本研究结果表明CircCDR1as在糖皮质激素诱导的ONFH患者股骨头组织内表达上调,敲低其表达能够显著提高糖皮质激素诱导的BMECs活性与血管形成能力,并且提高VEGF与VEGFR-2的蛋白表达水平,改善了糖皮质激素诱导的BMECs功能障碍。这不仅为揭示糖皮质激素性ONFH的发病机制提供了实验依据,而且对于临床上ONFH的诊疗提供了新思路。但本研究仅限于体外细胞学实验,后续将进行动物回植实验,此外,关于CircCDR1as的具体作用机制也有待进一步深入探究。

