基于生物信息学方法筛选分析与COPD相关基因
吴德洪
(成都市第三人民医院呼吸与危重症医学科,四川 成都 610031)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)简称慢阻肺,是最常见的慢性气道疾病,由于吸烟和日益严重的空气污染,预计其未来发病率将进一步升高[1]。COPD发病机制复杂,最重要的机制之一为炎症[2],表现为气道或肺泡异常,且多种炎症细胞参与,肺泡巨噬细胞被认为是其中最重要的炎症细胞之一[3]。肺泡巨噬细胞是肺泡腔表面的主要细胞类型,是炎症发生和消退的主要调节因子[4]。因此,深入探究肺泡巨噬细胞参与COPD所涉及的分子生物学机制,将为进一步研究COPD发生发展机制提供理论依据以及潜在治疗靶点。本研究通过挖掘慢阻肺肺泡巨噬细胞基因芯片数据以探究慢阻肺发病过程中可能的关键基因,现报道如下。
1 资料与方法
1.1 数据来源 登录GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)搜索并筛选出GSE130928芯片数据,含24名健康非吸烟者与22名慢阻肺患者,标本为经支气管肺泡灌洗液提取的肺泡巨噬细胞。
1.2 DEGs分析 使用R软件工具包筛选DEGs,以|log2FC|>0.500及P<0.050为条件筛选出DEGs。
1.3 WGCNA分析 利用R软件“WGCNA”工具包构建加权共表达网络,获取与临床性状最相关的模块及基因。
1.4 GO和KEGG分析 利用WGCNA最佳模块基因与DEGs取交集得到共表达基因,使用David数据库进行GO富集分析,包括生物学功能(BP)、细胞成分(CC)、分子功能(MF),利用在线网站kobas进行KEGG富集分析,取P<0.05前5项进行展示。
1.5 蛋白质-蛋白质相互作者用(PPI)分析 使用在线网站STRING分析共表达基因间的相互作用关系构建PPI网络,确定关键基因。
2 结果
2.1 COPD DEGs筛选 从GSE130928芯片中共获取DEGs 602个,其中上调基因295个,下调基因307个。
2.2 WGCNA分析 利用WGCNA R工具包中的函数计算软阈值。本研究中在无尺度拟合指数R2为0.9时取得最佳软阈值为9,基于此构建WGCNA分层聚类树,共得到22个基因模块,其中purple模块与COPD相关性最高(R=-0.750,P=2e-09),见图1,模块基因(module)与DEGs取交集得到共表达基因(n=135)韦恩图,见图2。
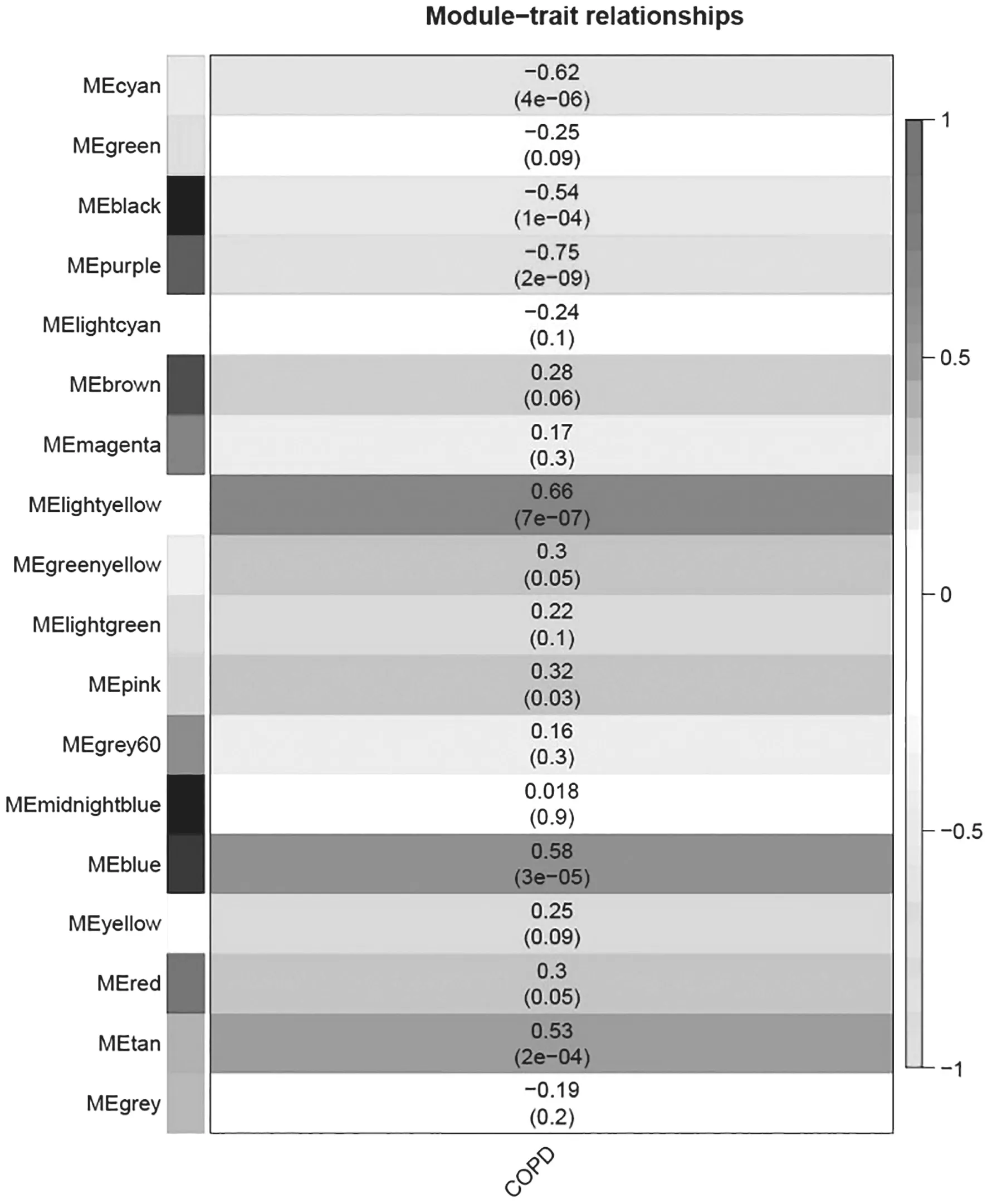
图1 模块与临床性状相关关系图
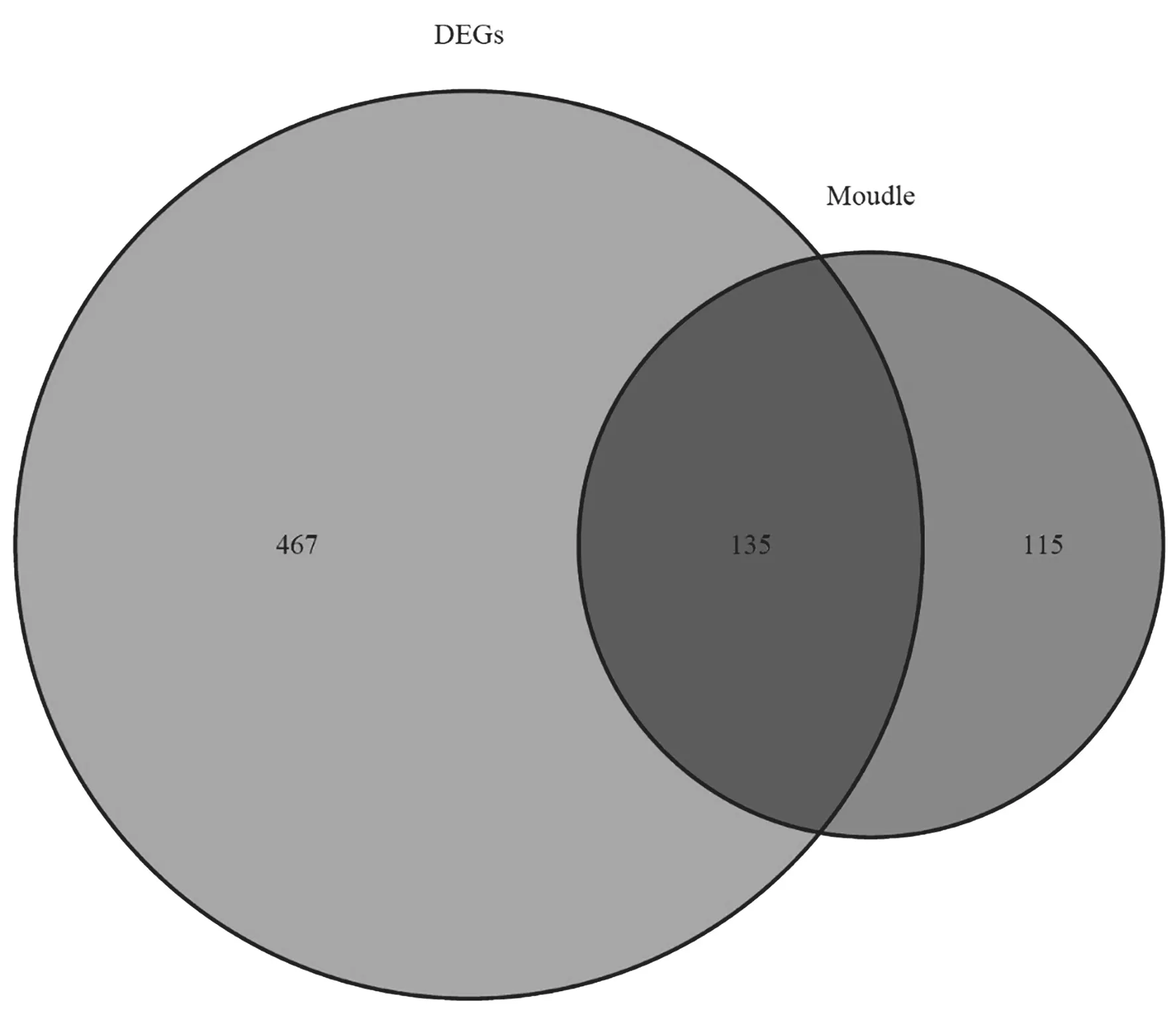
图2 共表达基因韦恩图
2.3 GO功能注释及KEGG通路富集分析 GO富集结果显示,在BP上主要与免疫反应、对病毒的响应等相关,在CC上主要富集在细胞外、细胞质的核周区,在MF上主要富集于内肽酶活性、受体、蛋白质及脂质结合;KEGG富集分析与Nod样受体信号通路、病毒感染、细胞因子及细胞因子受体相互作用相关,展示排名前5的结果,见图3。
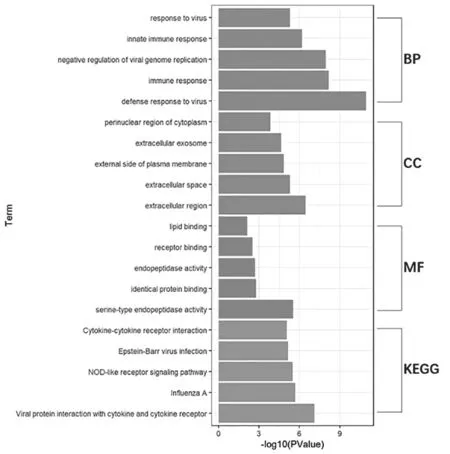
图3 GO富集及KEGG代谢通路图
2.4 PPI分析 将135个共表达基因导入STRING数据库,排除不能形成互作关系的单个差异蛋白,得到共表达基因蛋白互作网络图,见图4,筛选出关键基因CXCL9、CXCL10、CCL5、STAT1、IRF1。
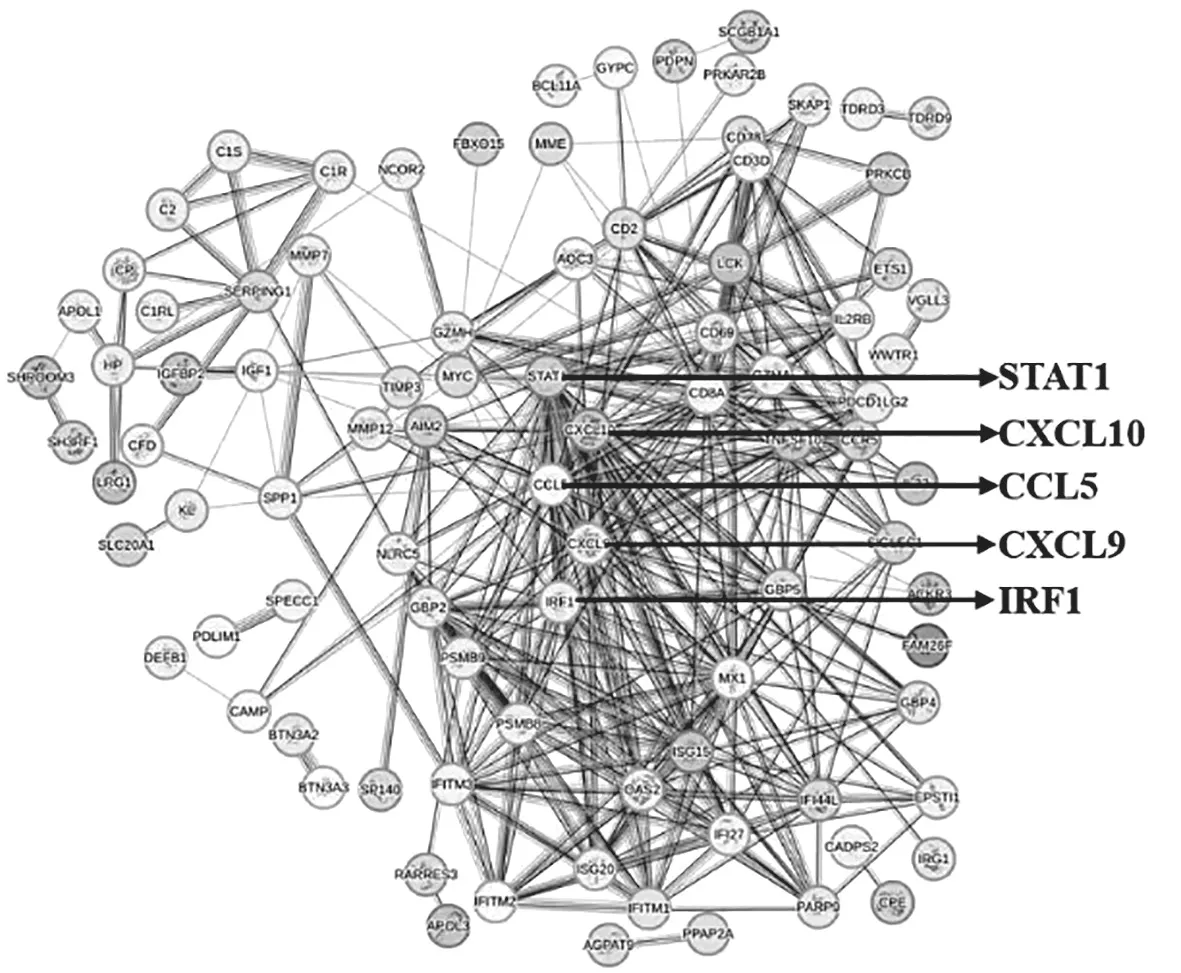
图4 共表达基因蛋白互作网络图
3 讨论
COPD是一种常见的以持续气流受限为特征的可以预防和治疗的疾病,气流受限进行性发展,与气道和肺脏对有毒颗粒或气体的慢性炎性反应增强有关。COPD肺部炎症与免疫相关,其中巨噬细胞是人肺实质中主要的免疫细胞,COPD气道、肺实质、肺泡灌洗液以及痰中巨噬细胞增加,可被香烟烟雾提取物激活释放炎症介质,包括多种细胞因子、趋化因子和活性氧。
本研究通过WGCNA筛选出与慢阻肺最相关模块;GO及KEGG分析发现,共表达基因主要与免疫及炎症等分子生物学过程相关;经共表达基因PPI分析筛选出关键基因CXCL9、CXCL10、CCL5、STAT1、IRF1。研究显示[5],Nod样受体蛋白-3(NLRP3)在COPD疾病进展中起关键作用,NLRP3炎性小体可识别固有免疫系统,通过诱导炎症细胞和炎性介质浸润,刺激气道分泌细胞外基质,使气管平滑肌发生增殖、气道重塑,进而发生COPD。针对Nod样受体信号通路特点,NLRP3炎性小体可能成为慢阻肺气道重塑药物治疗靶点。前列腺素和白三烯为脂质介质,在动物吸烟模型中,白三烯B4受体拮抗剂可调节肺泡巨噬细胞中自噬溶酶体途径减轻炎症反应;而在慢阻肺等气道炎症性疾病中,前列腺素可通过抑制淋巴细胞、嗜酸性粒细胞以及中性粒细胞的活化达到减轻炎症反应的目的[6]。研究证实[7],JAK/STAT通路广泛参与COPD发病过程中的细胞炎症及免疫应答,气道炎症及肺气肿程度与STAT3表达水平成正相关,JAK/STAT信号通路中STAT1、STAT3的过表达和活化被抑制后可减轻气道炎症、抑制COPD急性发作与加重。肺动脉血管内皮细胞衰老分泌的炎性细胞因子可诱导肺动脉平滑肌细胞发生增殖和迁移,促进肺动脉血管重塑最终形成COPD肺动脉高压[8]。趋化因子CCL5、CXCL9、CXCL10为小分子细胞因子,其中CXCL9、CXCL10主要由肺泡巨噬细胞、支气管上皮细胞和支气管平滑肌细胞产生,在COPD痰中浓度升高,并随中性粒细胞数量增多表达进一步升高,CCL5在巨噬细胞、T细胞等多种类型细胞中均有表达,可引导细胞到炎症部位,COPD大鼠模型血清及肺泡灌洗液中CCL5均明显升高,表明其与COPD炎症相关。炎症介质可上调内皮细胞VCAM-1表达,使炎症细胞进入气道释放炎症因子,导致肺组织结构破坏和重构,而由TNF-α所诱导的转录因子IRF-1可以促进VCAM-1的转录,导致COPD病情加重。因此以关键分子CCL5、CXCL9、CXCL10、RF-1及Nod样受体、JAK/STAT信号通路等为靶点,可能有效干预COPD慢性炎症反应。
综上所述,本研究通过深入挖掘GEO数据库数据,对可能调控慢阻肺的关键基因及相关信号通路进行初步分析,筛选出CCL5、CXCL9、CXCL10、RF-1及STAT1 5个关键基因,为进一步探索COPD发生发展机制研究提供了一定依据。

