浅表性膀胱癌经尿道膀胱癌等离子电切术治疗后患者氧化应激反应水平与疼痛相关性研究
焦向宁,董维平,路 璐,马 江,张璞暹,郅玲然
(1.武警陕西省总队医院泌尿外科,陕西 西安 710054;2.西安市人民医院 西安市第四医院病理诊断中心,陕西 西安 710004)
膀胱癌是我国泌尿外科发病率和病死率均仅次于前列腺癌的恶性肿瘤[1]。浅表性膀胱癌属于早期癌变,新发膀胱癌中约75%~85%属于浅表性癌病,癌变组织并未侵犯至周边,积极手术治疗的治愈率较高[2]。经尿道膀胱癌等离子电切术(Transurethral resection of bladder tumor,TURBT)是浅表性膀胱癌有效治疗方案之一,能有效降低闭孔反射和膀胱穿孔率,手术成功率高,术后复发率低,安全性好[3-4]。外科手术属于侵入式操作,其对肿瘤部位组织的操作会对机体造成创伤,引发术后疼痛,过于强烈的术后疼痛会影响患者情绪和生理代谢,从而不利于术后恢复[5]。但关于术后疼痛发生机制尚未完全明确。外科手术操作作为外源性刺激,会引起患者体内氧化应激反应,导致体内丙二醛(Malondialdehyde,MDA)、活性氧(Reactive oxygen species,ROS)等氧化产物水平升高,超氧化物歧化酶(Superoxide dismutase,SOD)等抗氧化物质水平下降[6-7],造成局部组织受损,加重局部炎症反应。以往针对复杂性区域性疼痛综合征的研究证实,区域性疼痛与炎症反应密切相关,主要表现为局部促炎细胞因子上调表达[8]。本研究以接受TURBT治疗的浅表性膀胱癌患者为研究对象,分析探究患者术后氧化应激与疼痛的关系,以期为膀胱癌患者术后疼痛管理提供依据,现将结果报告如下。
1 资料与方法
1.1 一般资料 收集2015年1月至2021年12月98例预在武警陕西省总队医院泌尿外科接受TURBT治疗的浅表性膀胱癌患者为研究对象。病例纳入标准:术前影像学检查提示膀胱癌,且经组织病理学检查确诊为浅表性膀胱癌;原发性膀胱癌;无全身免疫系统或血液系统疾病;无药物过敏史或非过敏体质;机体耐受性良好;自愿参与研究且签署知情协议书。排除标准:合并严重心肝肾肺功能异常;合并其他感染性疾病;近3个月内接受过其他外科手术治疗;合并其他部位肿瘤或其他能引起机体氧化应激水平异常的疾病;伴有精神障碍性疾病。患者中男57例,女41例;年龄47~78岁,平均(65.67±6.63)岁;肿瘤直径0.8~3.6 cm,平均(2.20±0.63)cm;病灶数目:单发70例,双发22例,多发6例;病灶部位:侧壁74例,三角区19例,侧壁和三角区均有5例;肿瘤病理学分期:G1期33例,G2期36例,G3期29例;麻醉方式:全麻82例,腰硬联合麻醉16例。本研究通过了医院伦理委员会审核流程。
1.2 手术方法 患者入室,取截石位,消毒,铺巾,完成全麻或腰硬联合麻醉。经尿道置入等离子电切系统(德国OLYMPUS奥林巴斯ESG-400等离子电切系统),探明肿瘤病灶位置、形态、大小、数目,是否带蒂;灌入0.9%无菌氯化钠溶液反复冲洗病灶部位,以维持视野清晰。按照由小到大、由易到难的顺序,沿肿瘤表面向基底层切除病灶,电凝切除病灶基底周边出血点;在电切环协助下取出切下的肿瘤组织,进一步清理肿瘤基底组织和边缘组织,止血后退出电切镜;留置三腔导尿管。术后24 h内持续以0.9%无菌生理盐水冲洗膀胱,直至冲洗液清澈无出血时停止。
1.3 观察指标 ①统计患者一般手术情况,包括手术时间、术中出血量等。②选用视觉模拟评分法(Visual Analogue Scale,VAS),对患者术前(术前24 h)、术后24 h和术后72 h时活动性疼痛状况进行评估,总分0~10分,0~2分为舒适,3~4分为轻度疼痛,5~6分为中度疼痛,7~8分为重度疼痛,9~10分为极度疼痛[9]。③分别留取患者术前、术后24 h和术后72 h时周静脉血样,离心分离,用于测定患者血清疼痛介质[前列腺素E2(Prostaglandin E2,PGE2)、P物质(Substance P,SP)和氧化应激指标(MDA、ROS、SOD)]水平。
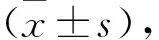
2 结 果
2.1 一般手术情况 患者均顺利完成TURBT治疗,平均手术时间(29.45±8.81)min,平均术中出血量(45.92±15.26)ml。术后病灶基底和切缘检查发现,98例患者中有5例存在肿瘤残留,安排择期进行二次电切治疗。
2.2 术前和术后VAS评分和疼痛介质表达水平变化比较 患者术前、术后24 h和术后72 h时的VAS评分、血清PGE2和SP水平间比较,差异具有统计学意义(均P<0.01),术后24 h的血清VAS评分、PGE2和SP水平显著高于术前,术后72 h显著低于术后24 h,但仍显著高于术前(均P<0.01),见表1。

表1 术前和术后VAS评分和疼痛介质表达水平变化比较
2.3 术前和术后氧化应激指标表达水平变化比较 患者术前、术后24 h和术后72 h时血清MDA、ROS和SOD水平间比较,差异具有统计学意义(均P<0.01),术后24 h的血清MDA、ROS水平显著高于术前,SOD水平显著低于术前(均P<0.01),术后72 h的血清MDA、ROS水平显著低于术后24 h,但仍显著高于术前,术后72 h的SOD水平显著高于术后24 h,但显著低于术前(均P<0.01),见表2。

表2 术前和术后氧化应激指标表达水平变化比较
2.4 术后疼痛程度与血清指标相关性 术后24 h和72 h时不同疼痛程度患者血清PGE2、SP、MDA、ROS和SOD水平间比较,差异具有统计学意义(均P<0.01),术后24 h时重度疼痛者血清PGE2、SP、MDA、ROS水平>中度疼痛者>轻度疼痛者>舒适者,重度疼痛者血清SOD<中度疼痛者<轻度疼痛者<舒适者(均P<0.01);术后72 h时中重度疼痛患者血清PGE2、SP、MDA、ROS水平>轻度疼痛者>舒适者,重度疼痛者血清SOD<轻度疼痛者<舒适者(P<0.01),见表3、4。

表3 术后24 h不同程度疼痛患者血清指标水平比较

表4 术后72 h不同程度疼痛患者血清指标水平比较
2.5 血清氧化应激指标与疼痛介质相关性 Pearson相关分析显示,术后患者血清MDA和ROS表达水平与PGE2、SP水平呈正相关,血清SOD表达水平与PGE2、SP水平呈负相关(均P<0.05),见表5。

表5 血清氧化应激指标与疼痛介质相关性
3 讨 论
浅表性膀胱癌指TaG1至TaG3期膀胱肿瘤,临床主要表现为血尿,尤其间歇性全程无痛血尿,此外有的患者也是以尿频、尿急、尿痛等膀胱刺激症状或盆腔疼痛起病的[10]。TURBT是目前用于浅表性膀胱癌治疗的常用术式,能有效避免膀胱功能损伤,术后恢复快[4]。虽然TURBT属于微创手术,但术中对肿瘤病灶的切割仍会对身体造成不同程度创伤,术中操作还会机体炎症及氧化应激反应,过度的炎症和氧化应激反应亦会对身体组织器官造成损伤[11]。同时,手术操作还会引发术后疼痛。剧烈的术后疼痛会导致患者心跳加快、血压升高、情绪烦躁,影响术后康复效果和效率[12]。
PGE2和SP均是重要的疼痛介质,前者可使痛阈降低,通过激活感觉神经末梢受体,强化痛觉[13];后者属于伤害性刺激神经肽,广泛分布与细神经虾尾组织中,具有致痛和传统疼痛信号的作用[14]。研究发现,在急性损伤发生时,机体SP和白细胞介素-6等炎症介质会随着痛觉在受损组织和中枢神经系统中迅速表达,促使组织释放磷脂类物质,后者降解生成PGE2。PEG2含量增多会直接致痛,或通过增加神经根对止痛介质的敏感性,从而强化痛觉;此外,其含量增高还会引发血管痉挛,组织水肿,促进SP和5-羟色胺等释放,增加中枢神经和周围神经系统敏感性,从而增强痛觉[15]。本研究纳入98例患者经TURBT治疗后,术后24 h和72 h内多数患者出现不同程度痛感。患者术后24 h和72 h的VAS评分和血清疼痛介质PGE2和SP水平显著高于术前。表明,TURBT术中肿瘤病灶切割会对局部组织造成急性损伤,导致疼痛介质高表达,引发不同程度术后疼痛,与黄岚等[16]报道结果相似。
疼痛发生及程度与多种因素有关。以往有研究指出,机体氧化应激水平与疼痛程度密切相关,临床可通过抑制机体氧化应激反应减轻术后疼痛[17]。MDA是机体脂质在自由基作用下所产生的终产物之一,也是反映机体氧化应激水平的代表物质[18]。ROS是线粒体产生的还原性产物。正常生理状态下,机体ROS产生与清除处于动态平衡状态,病理状态下其形成与清除失衡,体内积累过多ROS会导致细胞受损[19]。SOD属于抗氧化剂,可将超氧阴离子还原为过氧化氢,后者在过氧化氢酶作用下进一步被还原并排除体外[20]。本研究结果显示,患者术后24 h和72 h的血清MDA、ROS水平显著高于术前,SOD水平显著低于术前,与马进华等[7]报道结果相似。表明,TURBT虽为微创手术,但仍会对机体造成一定程度氧化应激损伤。不同疼痛程度患者血清PGE2、SP、MDA、ROS和SOD水平间存在统计学差异,随着疼痛程度加重,患者血清疼痛介质和氧化指标水平明显升高,抗氧化物质SOD水平下降,且氧化指标MDA和ROS表达水平与疼痛介质PGE2、SP水平呈正相关,SOD水平与PGE2、SP水平呈负相关(均P<0.05),表明术后出现的氧化应激反应与疼痛间可能存在相互作用,氧化应激反应会刺激神经系统,加重痛感,同时疼痛加重也会刺激氧化介质形成释放。
综上所述,TURBT会刺激浅表性膀胱癌体内疼痛介质表达,引发术后早期不同程度痛感,且患者术后机体氧化应激状态与疼痛评分和疼痛介质表达水平密切相关。临床可通过抑制术后机体氧化应激反应,减轻或缓解术后疼痛,提高患者治疗体验。

