右美托咪定对盲肠结扎穿孔术诱导的脓毒症大鼠急性肺损伤保护作用及其与磷酸化JAK激酶2/酪氨酸磷酸化通路的关系
梁 红,霍红艳
(西安高新医院麻醉科,陕西 西安 710075)
脓毒症是一种由感染引起的严重全身炎症反应,与高发病率和病死率有关。脓毒症临床表现包括血流动力学不稳定、凝血问题和多器官功能障碍等[1-2]。在脓毒症的进展中,具有内皮屏障功能障碍特征的血管渗漏是一个关键的病理生理步骤,可导致组织水肿和器官功能障碍,急性肺损伤(Acute lung injury,ALI)是脓毒症最常见的并发症之一,ALI使许多临床症状复杂化,表现为肺功能减退、肺水肿、中性粒细胞浸润和肺泡毛细血管膜通透性增加[3]。炎症因子的过度释放、粘附分子上调、中性粒细胞聚集、血管完整性丧失、肺泡上皮和肺血管内皮细胞凋亡是脓毒症相关肺损伤的主要病理变化[4-5]。右美托咪定(Dexmedetomidine,DEX)是一种α2-肾上腺素受体激动剂,广泛用于重症监护室危重患者的围手术期镇静、镇痛和抗焦虑[6]。越来越多的证据表明DEX具有抗炎、抗凋亡和抗氧化特性,可减轻动物模型中缺血/再灌注、脂多糖和通气后的肺损伤[7]。最近发现DEX具有调节线粒体融合/裂变以减轻脓毒症相关肺损伤的作用,已被证明可通过抑制细胞凋亡和促进细胞存活来防止胆红素诱导的肺损伤[7]。临床报告的严重脓毒症患者的研究表明,DEX通过其抗炎作用提高了存活率[8]。本研究中探讨了DEX对脓毒症诱导的ALI的保护作用及其与磷酸化JAK激酶2(p-JAK2)/酪氨酸磷酸化(p-STAT3)通路的潜在联系。
1 材料与方法
1.1 实验大鼠 30只健康成年雄性无病原体Wistar大鼠(体重250~300 g)购自陕西省食品药品检验研究院,许可证号SYXK(陕)2018-002。所有动物都饲养在21~ 23 ℃,30%~40% 湿度和12 h明暗循环中,饲养期间大鼠可随意获取食物和水。
1.2 实验仪器 ELISA试剂盒购自上海碧云天有限公司,批号PT512;TRIzol 试剂、RevertAid 逆转录酶均购自赛默飞世科技科技,批号EP0442、15596026;p-JAK2(1∶1000)、p-STAT3(1∶1000)、和 β-肌动蛋白(1∶8000)均购自英国abcam公司,批号分别为ab57602、ab2185和KM9001。
1.3 脓毒症大鼠模型 对所有大鼠肌肉注射50 mg/kg盐酸氯胺酮、5 mg/kg甲苯噻嗪和静脉注射2 g/(kg·h)芬太尼,对所有大鼠进行诱导和维持麻醉,麻醉深度由脚趾捏反应法确定。通过尾静脉导管提供水合和药物输注,以0.5 ml/h的速率注入等渗氯化钠溶液维持水合。建立盲肠结扎穿孔术(CLP)诱导的脓毒症大鼠模型,在实验过程中,让大鼠自主呼吸,同时监测外周血氧饱和度。脓毒症是通过盲肠结扎和穿刺引起的,通过3 cm中线切口进行剖腹探查、结扎和穿孔盲肠。盲肠用3-0丝结扎,用18 G针打孔2次,轻轻挤压,挤出少量粪便。将盲肠重新置于腹腔内,并关闭剖腹切口。在盲肠结扎和穿刺程序之后,将大鼠放回各自的笼子,自由获取食物和水。假手术组(对照组)大鼠仅接受剖腹和关腹操作。
1.4 分组和实验设计 将大鼠随机分为三组:对照组、模型组和 DEX组。每组10只。模型组和DXE组大鼠均行盲肠结扎穿孔术,对照组仅行剖腹和关腹操作。DEX组大鼠给予5 g/(kg·h) DEX静脉滴注1 h,模型组和对照组的大鼠接受等体积的盐水。6 h后大鼠用氯胺酮/甲苯噻嗪组合麻醉每组4只,并抽取血样用于测量炎症因子水平分析。CLP术后24 h,其余各组大鼠静脉注射戊巴比妥200 mg/kg安乐死,采集肺标本进行组织分析、组织学检查。
1.5 实验方法
1.5.1 检测炎症细胞因水平:收集外周血和肺组织样本用于分析炎性细胞因子。使用ELISA试剂盒检测肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)和单核细胞趋化蛋白1 (MCP-1) 的水平。
1.5.2 分析肺组织学:将肺标本固定在2%戊二醛和2%多聚甲醛在0.1 mol/L甲胂酸盐缓冲液(pH 7.4)中的混合物中,用分级酒精系列脱水,并在52 ℃下嵌入石蜡中。制备切片并用苏木精和伊红 (HE) 染色以进行组织学评估。由病理医师对每个肺切片的肺损伤进行评分,观察并记录肺泡毛细血管充血、出血、中性粒细胞在血管壁中的浸润或聚集,以及肺泡壁的厚度。每个项目根据以下等级进行评分:0:最小损坏;1:轻度损坏;2:中度损坏;3:严重损坏;4:最大伤害。
1.5.3 肺组织原位凋亡:通过末端脱氧核苷酸转移酶(TdT)介导的荧光dUTP标记(TUNEL)方法测定肺组织中的原位DNA片段化。根据制造商的说明,使用Apop Tag过氧化物酶原位凋亡检测试剂盒进行TUNEL。过氧化物酶底物3.3-二氨基联苯胺用于观察凋亡细胞。甲基绿(0.5%)用于核染色。在光学显微镜下观察 TUNEL 阳性细胞。对肺中淋巴滤泡形成区域之外的5个不同的大生长区域中的TUNEL阳性细胞进行计数后,计算平均值。
1.5.4 检测氧化应激:氧化应激指数 (OSI) 计算为总氧化剂状态 (TOS) 和总抗氧化剂水平 (TAS) 水平之间的比率。血清TOS和TAS浓度按照商业试剂盒制造商的说明,使用微孔板分光光度计进行测量。TOS测定用过氧化氢 (H2O2)进行校准,结果以μmol H2O2当量/L表示;TAS使用标准抗氧化物(Trolox)进行校准,结果以μmol Trolox 当量/L表示。
1.5.5 检测肺组织凋亡相关基因mRNA表达:使用TRIzol试剂提取肺组织或NR8383细胞中的总RNA。在以下条件下,使用RevertAid 逆转录酶将1 μg总RNA转化为cDNA:25 ℃ 10 min,42 ℃ 60 min和70 ℃10 min。RT-PCR 分析使用Applied Biosystems 7300实时PCR系统和软件,使用BCL2-Associated X的蛋白质(Bax)、B淋巴细胞瘤-2基因(Bcl2)、半胱氨酸蛋白酶-3(Caspase-3)和β-的特异性mRNA引物进行。PCR混合物的预变性在95 ℃下进行5 min,进行40个热循环,包括在95 ℃下变性10 s,在60 ℃下退火和延伸30 s。每个转录物的拷贝数计算为归一化法管家基因β-肌动蛋白的相对拷贝数。2-ΔΔCt方法用于确定靶基因的相对mRNA表达。
1.5.6 检测p-JAK2和p-STAT3的蛋白表达:冷冻的肺标本通过冰上的裂解缓冲液匀浆,将细胞裂解物在4 ℃下以9000 g离心10 min,收集上清液。通过二辛可宁酸测定法定量蛋白质浓度,将蛋白质提取物(40 μg)加热、变性并加载到10% SDS-PAGE上进行电泳,转移到PVDF膜上。在37 ℃下用Tris缓冲盐水(TBST)中的5%脱脂牛奶封闭膜1 h,用p-JAK2(1∶1000)、p-STAT3(1∶1000)、和β-肌动蛋白(1∶8000)在4 ℃过夜。用TBST洗涤四次后,将印迹与适当的辣根过氧化物酶偶联的二抗在室温下孵育1 h。上样对照是组成型表达的蛋白质β-肌动蛋白,印迹通过增强化学发光系统可视化,并使用Image J进行分析。
1.5.7 检测脓毒症大鼠血管通透性:通过大鼠颈静脉注射9 mg/kg异硫氰酸荧光素牛血清白蛋白(FITC-BSA),给药后1 h,打开腹腔,切开腹主动脉,经颈静脉缓慢注入生理盐水直至肺组织变白。用OCT胶包埋右肺组织,并进行冰冻切片(切片厚度10~15 μm)。用4%多聚甲醛固定组织15 min,用0.1% Triton-X渗透5 min,并在37 ℃下与4’,6-二脒基-2-苯基吲哚(DAPI,1∶50)一起培养30 min。在激光共聚焦显微镜下观察肺组织中的FITC-BSA渗出。沿腹部中部切开2 cm的切口,供其他大鼠选择肠系膜固定有丰富的微血管。FITC-BSA被注入股静脉6 min后,通过倒置显微镜观察FITC-BSA渗漏到肠系膜微血管中。

2 结 果
2.1 DEX减轻脓毒症大鼠体内炎症反应 模型组TNF-α、IL-6和MCP-1水平较对照组升高(均P<0.05),而IL-10水平较对照组降低(均P<0.05),DEX组TNF-α、IL-6和MCP-1水平较模型组降低(均P<0.05),IL-10水平升高(P<0.05)。见表1。

表1 三组大鼠肺组织炎症因子水平比较(pg/ml)
2.2 DEX对肺组织病理学和细胞凋亡的影响 模型组HE染色和TUNEL染色评分较对照组升高(均P<0.05),DEX组HE染色和TUNEL染色评分较模型组降低(均P<0.05),见表2。CLP和假手术后24 h获得的肺切片的代表性病理表现:对照组结构正常,肺泡清晰。与对照组比较,模型组肺标本的初步观察表明存在明显的病理病变,包括严重的白细胞浸润、肺泡壁增厚、肺水肿和出血,经DEX预处理后,大鼠病变情况明显减轻。见图1。
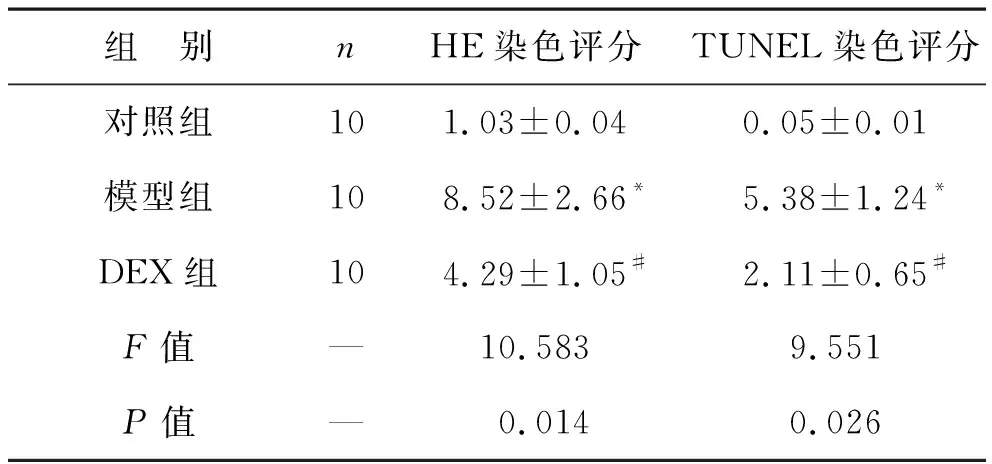
表2 HE和TUNEL染色分析大鼠肺损伤(分)
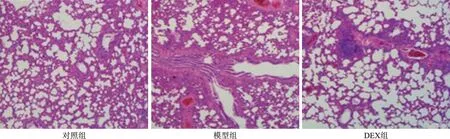
图1 肺切片的代表性病理表现(HE染色,×40)
2.3 三组大鼠氧化应激指标比较 模型组血清TAS水平较对照组降低(P<0.05),DEX组血清TAS水平较模型组升高(P<0.05),模型组血清TOS水平和OSI指数较对照组升高(均P<0.05),DEX组血清TOS水平和OSI指数较模型组降低(均P<0.05)。见表3。

表3 三组大鼠氧化应激指标比较
2.4 肺组织凋亡相关蛋白mRNA表达 模型组Bcl-2 mRNA表达较对照组降低(P<0.05),Bax和Caspase-3 mRNA表达升高(均P<0.05),DEX组Bcl-2 mRNA表达较模型组升高(P<0.05),Bax和Caspase-3 mRNA表达降低(均P<0.05)。见表4。

表4 三组大鼠肺组织凋亡相关蛋白mRNA表达比较
2.5 DEX抑制CLP诱导的p-JAK2/p-STAT3通路的激活 模型组p-JAK2和p-STAT3蛋白表达较对照组升高(均P<0.05),DEX组p-JAK2和p-STAT3蛋白表达较模型组降低(均P<0.05)。见表5。

表5 三组大鼠检测p-JAK2和p-STAT3的蛋白表达比较
2.6 DEX抑制脓毒症大鼠的血管通透性检测 模型组肺血管通透性和肠系膜血管通透性较对照组升高(均P<0.05),DEX组血管通透性较模型组降低(P<0.05)。与对照组比较,脓毒症大鼠的肺血管(A)和肠系膜(B)通透性显著增加(均P<0.05),与模型组相比,Dex可使肺血管和肠系膜的FITC-BSA的渗漏显著缓解(均P<0.05)。见表6。
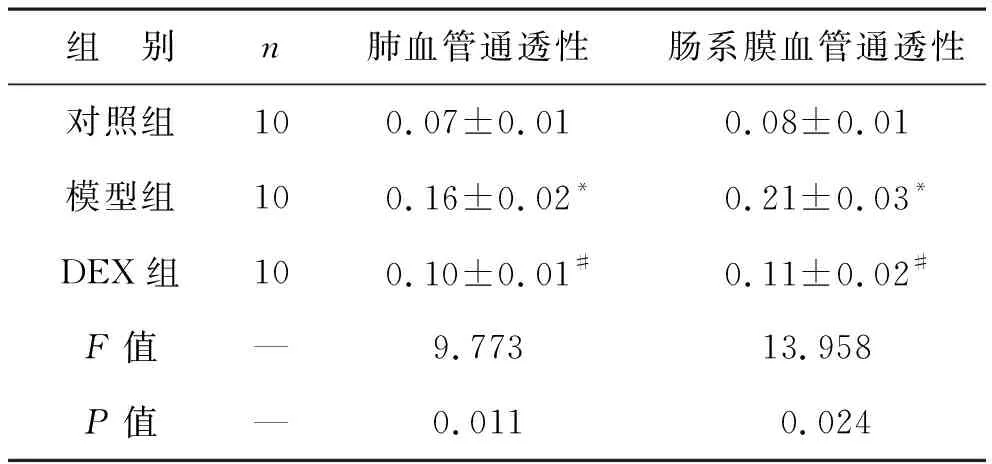
表6 三组大鼠血管通透性比较(μg/g)
3 讨 论
肺损伤是脓毒症的严重并发症,与高病死率相关。肺泡毛细血管屏障损伤、氧化应激、炎症级联刺激、细胞因子反应增加、及肺泡上皮和内皮细胞凋亡是病理性的与肺损伤相关的过程。脓毒症患者通常需要镇静以维持有效的机械通气,以确保患者对这种治疗的依从性,并减少焦虑[9-10]。DEX是一种有效的、高选择性的α2-肾上腺素能受体激动剂,由于其镇痛和镇静作用而无呼吸抑制,因此优选用于重症监护病房的镇静。除了镇静、抗焦虑、镇痛和交感神经阻滞作用外,DEX已被证明具有抗炎和抗凋亡作用。临床表明,腹腔注射DEX可抑制脓毒症小鼠肺组织的炎症反应,并且这种作用部分是由胆碱能抗炎途径介导的[11-12]。CLP诱导体内模型概括了人类全身性脓毒性肺损伤的主要特征,肺组织病理学损伤和肺损伤评分显著上升,TOS、OSI水平升高,TAS降低。本文研究结果表明:DEX赋予肺保护免受CLP诱导的氧化应激损伤,改善肺、肠系膜血管通透性,降低炎症因子水平和细胞凋亡。ALI作为败血症的标志,是导致死亡的主要原因之一,尽管ICU有显著改善,但治疗选择极为有限[13-15]。目前在脓毒症相关肺损伤的发病机制中广泛提出了可能由异常激活的ROS引起的线粒体融合和裂变的异常平衡。事实上,氧化应激源于线粒体活性氧(ROS)的过度产生和内毒素诱导的mtDNA释放,导致线粒体功能障碍和超微结构损伤[16]。本研究中应用血清TOS、TAS和OSI水平反映氧化剂/抗氧化剂平衡。体内研究表明,CLP诱导后24 h足以引起氧化损伤。本研究阐明了DEX通过减轻血管渗漏从而对脓毒症诱导的ALI起到保护作用,为脓毒症的防治提供了新的方向。血管内皮细胞位于血管内皮表面,形成一道屏障。循环血液和组织,避免各种有毒物质和炎症损伤造成的组织损伤。脓毒症引起的内皮损伤导致血管渗漏,从而导致多器官功能障碍综合征[17]。本研究表明,脓毒症大鼠的血管通透性显著增加,DEX给药减轻了血管渗漏,为脓毒症引起的血管渗漏和器官功能障碍的防治提供了新的方向。
肺损伤可由内毒素和其他细菌毒素引起。脓毒症是一种急性炎症,可增加肺上皮细胞的通透性并迅速在肺部积聚液体,导致急性肺水肿伴间质纤维化[18]。博来霉素诱导的纤维化释放炎症细胞,包括中性粒细胞、巨噬细胞和淋巴细胞。中性粒细胞的激活与炎症介质(TNF-α、IL-1β和IL-6)和趋化因子(IL-8和MCP-1)密切相关,它们在ALI中起重要作用。此外,巨噬细胞募集促纤维化细胞因子,如TNF-α或(和)IL-6,为纤维化提供微环境。TNF-α和IL-6反映了机体的炎症程度。TNF-α、IL-1β、IL-6和一氧化氮是重要的促炎细胞因子,这些细胞因子之间的相互作用,伴随着放大级联反应,加速了脓毒症诱导的ALI的进展,从而改变了血管通路通透性,导致肺水肿的形成[19]。在本研究中,我们发现DEX显著抑制CLP刺激的肺组织中炎性细胞因子(TNF-α、IL-6和MCP-1)的表达,提示DEX可能在肺通过抑制炎症反应。肺组织中的细胞凋亡与脓毒症期间肺损伤的发展和进展有关。全身炎症级联反应的启动和中性粒细胞在肺组织中的积累可能会促进细胞凋亡,导致肺功能障碍和脓毒症病死率增加。肺泡凋亡已被证明会破坏上皮屏障功能,引发ALI。在本研究中,检测到凋亡细胞以确定DEX对肺损伤的影响。TUNEL结果显示,与模型组相比,DEX组细胞凋亡率降低,说明外源性DEX能有效抑制脓毒症ALI大鼠肺上皮细胞凋亡。Bcl-2和Bax是Bcl-2家族的重要凋亡因子;Bcl-2是一种抗凋亡蛋白,而Bax是一种促凋亡蛋白。Caspase-3是细胞凋亡下游途径中的关键调节蛋白,可触发细胞凋亡并最终介导细胞凋亡。本研究结果表明,Bax的表达上调,Bcl-2的表达下调,从而刺激Caspase-3诱导肺细胞凋亡。相比之下,DEX逆转了该过程,表明DEX抑制肺上皮细胞的凋亡以防止肺损伤。JAK2/STAT3通路涉及许多生物过程,JAK2/STAT3通路在炎症介导的生物学进展中起关键作用。许多研究报告称,JAK2/STAT3通路参与了ALI的发展。以往研究报告称,JAK与细胞信号传导有关,而STAT3激酶与细胞生长、分化和细胞凋亡有关。相关研究发现STAT可能与ALI的发展有关,并证明JAK2/STAT3水平在严重急性胰腺炎ALI大鼠模型中上调[20]。本研究结果表明,对照组JAK2和STAT3蛋白主要为磷酸化,表达水平较低。CLP诱导后,肺中的JAK2/STAT3信号通路被激活,表现为JAK2和STAT3的磷酸化水平升高,DEX显著抑制JAK2和STAT3的磷酸化水平,显著CLP诱导的ALI大鼠模型中JAK2/STAT3信号通路的激活。
综上所述,DEX通过调控JAK2/STAT3信号通路降低体内炎症反应,减少肺上皮细胞凋亡并改善肺血管通透性,从而可有效抑制与脓毒症相关的ALI,这些发现可能为脓毒症的治疗提供新的方向。

