链霉亲和素-人粒细胞巨噬细胞集落刺激因子融合蛋白的制备与活性鉴定
孙晶莹,李 研,黄晓燕,靳占奎,徐翠香,常 乐,王建华
(1.陕西省人民医院感染与免疫疾病重点实验室,陕西 西安 710068;2.陕西省细胞免疫工程技术研究中心,陕西 西安 710068; 3.陕西省人民医院骨科,陕西 西安 710068;4.陕西省人民医院普外二科,陕西 西安 710068)
粒细胞巨噬细胞集落刺激因子(Granulocyte-macrophage colony-stimulating factor,GM-CSF)是一种造血生长因子和免疫蛋白,能够促进多种血液细胞、尤其是树突状细胞与单核-巨噬细胞增殖分化,增强宿主体内抗原呈递效应[1]。GM-CSF作为不同的细胞因子发挥不同的功能:GM-CSF作为造血生长因子,调节JAK-STAT、PI3K 等通路,促进造血细胞增殖、分化[2];作为免疫调节因子,GM-CSF不仅可促使中性粒细胞、巨噬细胞、树状突细胞(Dendritic cell,DC)增殖,并且可上调 DC 表面的B7蛋白和主要组织相容性复合体(Major histocompatibility complex,MHC)分子表达,进而促进CD4+Th1和CD8+T细胞介导的免疫反应[3]。因此GM-CSF是肿瘤免疫治疗和疫苗中常用的细胞因子[4],而且GM-CSF因其疗效良好、副作用小而被广泛用于癌症治疗[5]。GM-CSF可促进和调节巨噬细胞、中性粒细胞和单核细胞的增殖和分化,增强嗜酸性粒细胞和成熟中性粒细胞对肿瘤的抗药功能[6-8],Nebiker等[9]研究表明在结直肠癌中,GM-CSF高表达患者预后相对较好。此外,GM-CSF还可作为肿瘤疫苗的佐剂,有效增强肿瘤疫苗的免疫作用[10]。但由于GM-CSF在体内适合小剂量使用,且注入体内后会很快被分解代谢,所以肿瘤微环境中的局部有效浓度很难达到有效激活免疫的作用。而用基因修饰法将GM-CSF基因导入肿瘤细胞中制备瘤苗的修饰效率一般都较低,表达产物在局部通常不能达到有效的浓度且不能维持较长时间,抗肿瘤的临床效果有限。因此需要制备一种免疫原性和抗原性较强,且能持久刺激机体免疫力的新型瘤苗才可能达到我们期望的临床治疗效果。
链霉亲和合素(Streptavidin,SA)是一种从链霉菌中分离出来的可溶性同型四聚体蛋白,无糖基化,它能与生物素以极高的亲和力结合[11]。因此在本研究中利用生物素与链亲和素能够稳定结合且不可逆的特点,合成链亲合素连接的人粒细胞巨噬细胞集落刺激因子(SA-hGM-CSF)融合蛋白克服GM-CSF在体内会被快速降解的缺点。我们构建了SA-hGM-CSF-Pet28重组表达载体,并在表达感受态中高效诱导表达获得融合蛋白,经His镍柱纯化、复性后,并利用TF-1细胞对表达蛋白的生物学活性进行了研究。该研究为hGM-CSF表面锚定修饰的肿瘤细胞疫苗提供了实验基础,为后续的临床实验提供了依据。
1 材料与方法
1.1 实验材料 感受态细胞BL21(DE3)货号为:CD601;预染Marker货号为:26616,购于Thermo fisher公司;His镍柱货号为:635657,购于大连宝生物工程有限公司;质粒提取试剂盒货号为:DP214-02,购于北京天根生物科技有限公司;TF-1细胞货号为:CL-0232,购于武汉普诺赛(Procell)生命科技有限公司;CCK-8试剂盒货号为:C0038,购于上海碧云天生物技术有限公司;标准品重组人GM-CSF货号为:MA0603,购于大连美仑生物技术有限公司。
1.2 实验方法
1.2.1 SA-hGM-CSF双功能融合蛋白表达载体构建:在NCBI数据库中查询链霉亲和核素SA和hGM-CSF序列,交由上海生工生物工程股份有限公司合成并插入Pet28表达载体中。SA和hGM-CSF序列信息如表1,合成链霉亲和素时去掉终止密码子TGA,合成后的基因用双酶切进行鉴定。

表1 链霉亲和素-人粒细胞巨噬细胞集落刺激因子序列信息
1.2.2 SA-hGM-CSF融合蛋白的表达:收到合成SA-hGM-CSF-Pet28菌液后进行质粒提取,Nanodrop2000检测浓度和纯度合格后进行转化。从超低温冰箱-80 ℃取50 μl感受态细胞,置于冰盒中融化,加入1 μl重组质粒,轻轻混匀,冰上静置30 min。42 ℃热激45 s,迅速放于冰上置2 min,加入500 μl LB 200 r/min 37 ℃培养 1 h,1500 g离心1 min,弃掉300 μl上清,剩余培养基重悬菌体,涂含卡那霉素抗性的平板,37 ℃培养箱倒置培养过夜。
次日从平板中随机挑取4个单克隆于3 ml含卡那霉素抗性的LB培养基中,37 ℃ 200 r/min摇床过夜培养。按照1∶100的比例将过夜培养的菌液接种于新鲜的含卡那霉素抗性的LB培养基里,37 ℃ 200 r/min培养至菌液OD600约在0.6~0.8之间,加入异丙基硫代半乳糖苷(IPTG)诱导,选择诱导后表达的阳性克隆再摸索最佳诱导浓度及时间,用12% SDS-PAGE鉴定表达情况。
1.2.3 SA-hGM-CSF融合蛋白的表达与鉴定:根据摸索的小摇诱导条件大量诱导表达融合蛋白,表达完成后12000 r/min 2 min离心收集菌体。超声破碎仪设置80 Hz频率,利用超声波裂解细菌,直至溶液变清亮,离心收集蛋白,His镍柱纯化。纯化方法:5 ml去离子水清洗镍柱,10 ml结合液平衡镍柱;加入裂解的蛋白,与镍柱4 ℃结合1 h;5倍镍柱体积(5 ml)的清洗液洗脱杂蛋白;5倍体积(5 ml)的洗脱液洗脱目的蛋白;5倍体积(5 ml)的去离子水清洗掉洗脱缓冲液;镍柱中加入20%的乙醇于4 ℃保存。尿素梯度透析进行蛋白复性,尿素的浓度按照6、4、2、0 mol/L的浓度进行透析,每个浓度于4 ℃透析复性4~6 h。最后在PBS中继续透析复性12 h。上清经过滤除菌,分装后低温保存。利用WB鉴定表达SA-hGM-CSF蛋白,12%SDS-PAGE完成电泳后湿转移蛋白至NC膜上,5%脱脂奶粉封闭NC膜,一抗选择His抗体(1∶1000),二抗为HRP标记的羊抗鼠二抗,化学发光检测实验结果。
1.2.4 SA-hGM-CSF融合蛋白的活性测定:人血液白血病细胞(TF-1)用1640(含2 ng/ml hGM-CSF+10% FBS+1%双抗)培养,培养的细胞用PBS清洗2遍,制备成细胞悬液铺板。细胞计数2.5×104/ml,100 μl/孔铺板96孔板,每组3个复孔,标准品hGM-CSF和表达蛋白SA-hGM-CSF分别稀释至1、2、4、8 ng/ml,加入对应孔中,培养72 h,每孔加入10 μl CCK-8,继续培养2 h检测OD值为450 nm。
2 结 果
2.1 SA-hGM-CSF-Pet28表达载体的构建 合成后的基因用双酶切(NcoI+XhoI)进行酶切鉴定,酶切预期分子量为941 bp和5200 bp,大小均与预期相符。电泳结果见图1。

图1 质粒酶切鉴定结果
2.2 SA-HGM-CSF融合蛋白表达 利用异丙基硫代半乳糖苷(IPTG)进行重组蛋白的诱导表达37 ℃,转速200 r/min, IPTG诱导浓度依次为:0.1、0.2、0.3、0.4、0.5、0.6 mmol/L,在六个IPTG诱导浓度中,SA-hGM-CSF融合蛋白的诱导效果均明显,且在浓度之间诱导量没有显著差异,IPTG 0.6 mmol/L时诱导浓度时蛋白表达量稍高,故选定0.6 mmol/L作为最佳诱导浓度,见图2。设置诱导温度为37 ℃,转速200 r/min,诱导浓度0.6 mmol/L为条件不变。分别收集诱导时间为2~6 h的菌液进行鉴定。在五个时间梯度中,6 h SA-hGM-CSF融合蛋白的诱导效果比较明显,见图3。
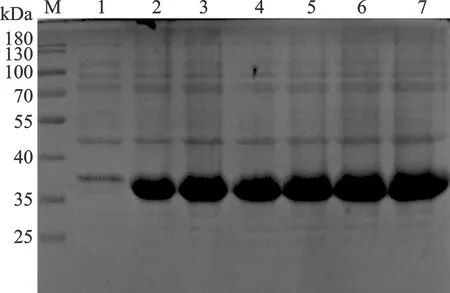
1:诱导前;2~7:IPTG诱导浓度依次为0.1、0.2、0.3、0.4、0.5、0.6 mmol/L图2 不同IPTG诱导浓度SA-hGM-CSF融合蛋白的表达

1:诱导前;2~6:诱导时间依次为2、3、4、5、6 h图3 不同诱导时间SA-hGM-CSF融合蛋白的表达
2.3 SA-hGM-CSF融合蛋白纯化与鉴定 根据优化的诱导浓度和诱导时间,大量培养诱导表达重组蛋白,诱导完成后收集菌体并超声裂解,低温高速离心后收集菌体并用His镍柱纯化并透析,SDS-PAGE电泳检测,并用WB检测表达蛋白与His抗体的反应。结果表明,成功纯化SA-hGM-CSF融合蛋白,并且WB检测表达蛋白与His抗体能够特异结合。见图4。

A:1为诱导前,2为诱导后,3为超声后菌体沉淀,4为超声后菌体上清,5为纯化透析后蛋白;B:表达融合蛋白与抗体的反应结果图4 SA-hGM-CSF融合蛋白的纯化与鉴定
2.4 SA-hGM-CSF融合蛋白活性测定 培养TF-1细胞,用购买hGM-CSF标准品作为对照,表达的SA-hGM-CSF作为实验组,通过CCK8实验检测表达SA-hGM-CSF是否具有生物学活性。结果表明,在1、2、4、8 ng/ml的浓度值,加入表达SA-hGM-CSF与标准品hGM-CSF后的TF-1细胞增殖速率基本一致,证明重组表达SA-hGM-CSF具有生物学活性。见图5。

图5 SA-hGM-CSF融合蛋白活性测定
3 讨 论
21世纪,癌症将成为全球人类死亡原因之一,也是人们预期寿命增加最重要的障碍。根据2018年国际癌症研究机构GLOBOCAN的数据显示,胃癌是全球癌症死亡的第三大主要原因,仅次于肺癌和大肠癌[12-13]。
近年来针对CTLA-4或PD-1通路的免疫检查点抑制剂在治疗实体瘤方面取得了令人瞩目的成功。肿瘤细胞疫苗是利用肿瘤细胞或肿瘤抗原物质诱导机体的特异性细胞免疫和体液免疫反应,增强机体的抗肿瘤能力,达到清除或控制肿瘤的目的[14]。肿瘤细胞疫苗被认为是联合各种治疗手段治疗恶性肿瘤的最佳辅助方法[15-17]。但是对于胃癌患者,由于其肿瘤细胞表面肿瘤特异性抗原或(和)相关抗原表达低下,免疫原性较低,制备的普通胃癌瘤苗抗原性和免疫原性不强,很难刺激机体有效的免疫反应以达到我们的理想效果[18-19]。因此必须制备一种免疫原性和抗原性较强,且能持久刺激机体免疫力的新型瘤苗联合免疫检查点抑制剂,才能达到期望的临床治疗效果。为此在本研究中我们致力于制备SA-hGM-CSF融合蛋白,并利用SA的作用原理将SA-hGM-CSF修饰到肿瘤细胞膜表面,通过增强肿瘤的免疫原性、直接激活免疫活性细胞和改善肿瘤局部的微环境等机制可诱发机体的主动抗肿瘤免疫反应,为肿瘤细胞疫苗治疗胃癌患者提供一定的理论研究基础。
本研究基于本实验室的原核表达技术平台,利用基因重组技术成功构建了SA-hGM-CSF表达质粒。选择Pet-28表达载体克隆效率高,操作简单,表达量高,通过设计6×His标签方便后期使用镍柱亲和层析方法纯化,利用克隆的表达载体获得高纯度的双功能融合蛋白。异丙基硫代半乳糖苷(IPTG)是一种作用极强的诱导剂,不被细菌代谢而十分稳定,因此被实验室广泛应用,本研究通过诱导剂IPTG诱导探索重组蛋白在BL21(DE3)中的表达,通过IPTG诱导浓度和诱导时间的研究摸索,找到最适的表达条件,IPTG诱导浓度0.6 mmol/L和诱导时间6 h,通过超声破碎裂解包涵体,在包涵体裂解的过程中,由于超声时温度的提高会影响重组蛋白,因此超声需要冰浴进行,超声的次数应在允许的范围内越多越好,保证超声后的液体是透明状,若超声不彻底,会导致蛋白量减少,最终利用His镍柱纯化获得纯化的重组蛋白,利用尿素梯度透析进行蛋白复性得到重组蛋白。在细胞水平上验证了表达蛋白的活性,即利用TF-1细胞对融合蛋白的生物学活性进行了鉴定[20-22],结果表明成功表达了具有生物活性的双功能融合蛋白,该研究结果为研制hGM-CSF表面修饰的新型肿瘤细胞疫苗提供基础。

