血清补体C1q、C3与中性粒细胞胞浆抗体相关性血管炎患者临床特征、病理类型及预后相关性研究
谌登珍,马 强
(1.商洛市中心医院呼吸内科,陕西 商洛 726000;2.商洛市中心医院呼吸与危重症医学科,陕西 商洛 726000)
抗中性粒细胞胞浆抗体(Antineutrophil cytoplasmic antibody,ANCA)相关性小血管炎(Antineutrophil cytoplasmic antibody-associated vasculitis,AAV)属于一组自身免疫介导的血管壁坏死性炎症疾病,组织学上通常表现为纤维蛋白样坏死、少量免疫复合物沉淀等[1-2]。AAV发病较为迅速,遗传、环境及感染等因素均会导致其发病,近年来,随着人们生活水平的不断提高,其发病率也呈现明显上升趋势,由于临床表现较为复杂多样,因此误诊率较高[3-4]。发病时累及全身各系统疾病,肺部以及肝肾等脏器由于血管丰富,是患者发病的重要部位,治疗后复发率较高,严重时会导致患者死亡[5-6]。临床上将AAV分为显微镜下多血管炎(Microscopic polyangiitis,MPA)、嗜酸性肉芽肿性多血管炎(Eosinophilic granulomatosis with polyangiitis,EGPA)以及肉芽肿性多血管炎(Granulomatosis with polyangiitis,GPA)[7-8]。补体作为免疫系统的重要成分,能够对外来微生物及病原体进行清除,充分发挥机体免疫功能,形成能够防御病原体的免疫复合物,对维持免疫系统平衡具有不可忽视的作用[9-10],相关研究报道称,血清补体在血管炎的发病中扮演着较为重要的角色[11-12]。基于此,本文主要是通过对AAV患者临床症状、病理类型、血清补体C1q和C3、临床预后等状况进行分析,探究血清补体C1q、C3在ANCN相关性血管炎患者中的表达及意义,为临床诊疗提供参考依据。
1 资料与方法
1.1 一般资料 选取2017年9月至2021年9月在本院就诊并进行治疗的88例AAV患者作为观察组,同时于同一时期选取在本院进行体检的88例健康患者作为对照组。观察组男39例,女49例,年龄42~93岁,平均(63.17±10.06)岁;对照组男43例,女45例,年龄33~92岁,平均(61.98±11.63)岁,两组患者性别、年龄等一般资料比较差异无统计学意义(均P>0.05),具有可比性。本研究获得医院医学伦理委员会审批。病例纳入标准:①观察组患者均符合2012年美国Chapill Hill Consensus Conference系统性血管炎的诊断标准,且经临床诊断及肾活检确诊为AAV;②观察组患者均为初次发病;③所有研究对象临床资料完整且均签署研究知情同意书;④研究对象对本研究配合度较高。排除标准:①存在有恶性肿瘤、脑部疾病史以及其他严重心血管疾病患者;②因环境、药物等因素导致ANCN检测呈阳性患者;③存在有免疫系统、血液系统疾病及其他系统感染疾病患者;④妊娠期以及哺乳期患者;⑤理解、沟通能力差或意识障碍患者;⑥严重心、肝、肾等脏器疾病患者;⑦严重干扰本研究患者。
1.2 分组及研究方法 根据血清补体C1q水平将AAV患者分为低C1q组(C1q≤159 mg/L)与正常C1q组(C1q>159 mg/L);根据血清补体C3水平将AAV患者分为低C3组(C3≤79 mg/dl)与正常C3组(C3>79 mg/dl)。对患者进行随访,并将患者病情达到终末期肾脏病(Endstage renal disease,ESRD)判定为预后不良。收集所有研究对象的性别、年龄等基本信息,测定ANCN采用免疫荧光法及酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)两种方法。收集所有研究对象空腹静脉血,离心分离后,对患者各项血常规、免疫功能、血清补体C1q、C3以及肾功能相关指标进行检测,血常规测定采用全自动血细胞分析仪进行,免疫功能相关指标测定采用AU2700 全自动生化分析仪(日本奥林巴斯公司)进行,血清补体以及肾功能指标检测采用ELISA法进行,检测所用试剂盒均购自武汉默沙克生物科技有限公司,并检测严格参照说明书进行。
1.3 研究指标 ①比较病例组与健康对照组患者血清补体C1q、C3水平;②对不同C1q水平组别患者基本资料及实验室指标进行比较;③对不同C1q水平组别患者临床特征、病理类型及预后进行比较;对不同C3水平组别患者基本资料及实验室指标进行比较;④对不同C3水平组别患者临床特征、病理类型及预后进行比较。
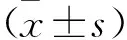
2 结 果
2.1 观察组与对照组患者血清补体C1q、C3水平比较 与对照组相比,观察组的AAV患者体内血清补体C1q、C3水平明显降低,且组间比较差异具有统计学意义(均P<0.05),见表1。

表1 观察组与对照组患者血清补体C1q、C3水平比较
2.2 不同C1q水平组别患者基本资料及实验室指标比较 低 C1q 组和正常C1q组相比,两组患者性别、年龄、ANCA分型以及C3水平均无统计学差异(均P>0.05),低 C1q 组β-2MG水平显著高于正常C1q组,IgM、RBC、Hb以及LDH水平显著低于正常C1q组,差异具有统计学意义(均P<0.05)。见表2。

表2 不同C1q水平组别患者基本资料及实验室指标比较
2.3 不同C1q水平组别患者临床特征、病理类型及预后比较 低 C1q 组和正常C1q组相比,两组患者各项临床特征的发生率以及病理类型比较均无统计学差异(均P>0.05),低 C1q 组ESRD的发生率明显高于正常C1q组,差异具有统计学意义(P<0.05)。见表3。

表3 不同C1q水平组别患者临床特征、病理类型及预后比较[例(%)]
2.4 不同C3水平组患者基本资料及实验室指标比较 低 C3 组和正常C3组相比,两组患者性别、年龄、ANCA分型以及C1q水平比较均无统计学差异(均P>0.05),低 C3组β-2MG、BUN、CysC、Tn、BNP以及LDH水平显著高于正常C3组,PLT、WBC以及Hb水平显著低于正常C3组,差异具有统计学意义(均P<0.05)。见表4。
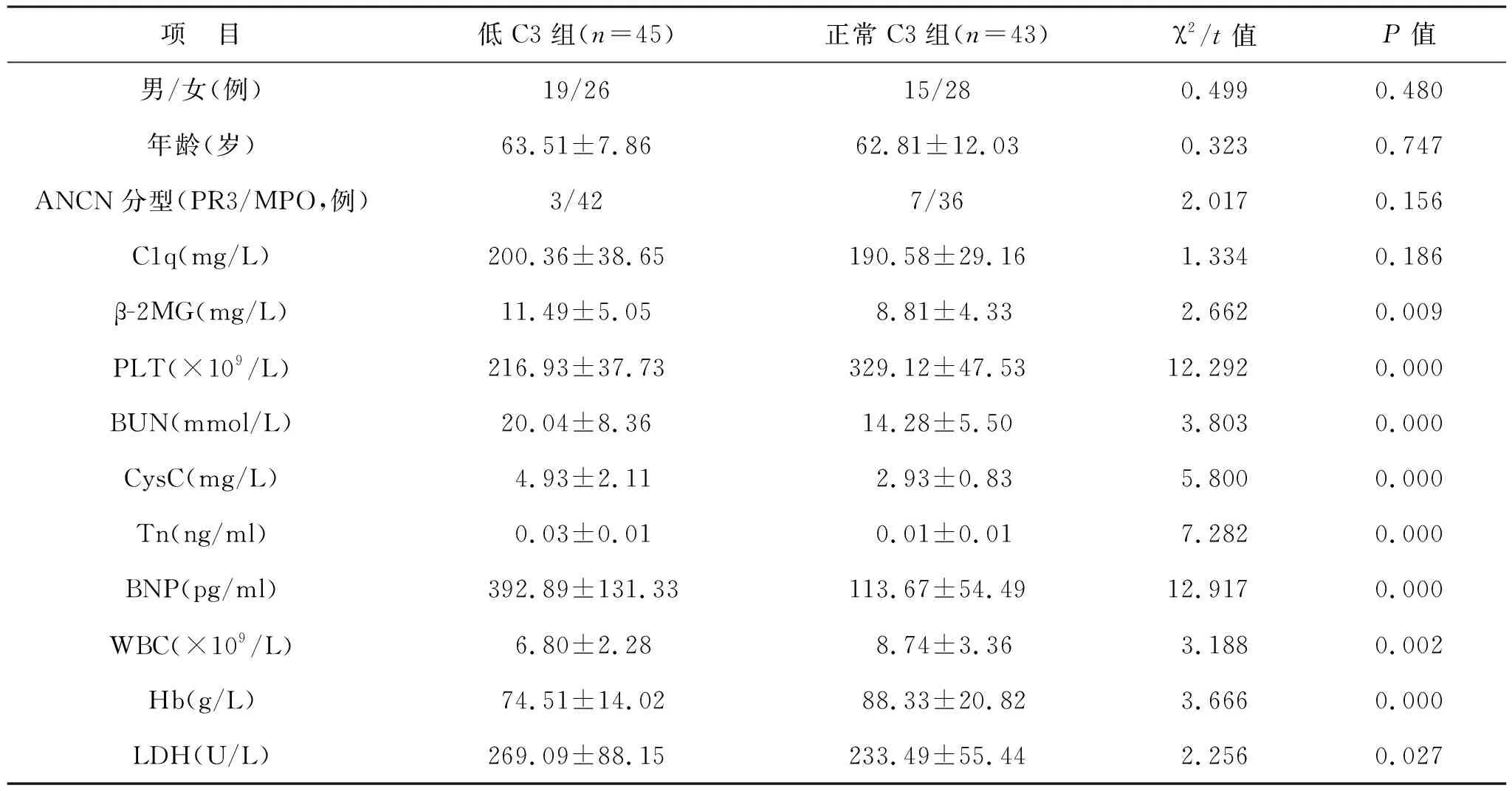
表4 不同C3水平组患者基本资料及实验室指标比较
2.5 不同C3水平组患者临床特征、病理类型及预后比较 低 C3 组和正常C3组相比,两组患者各项临床特征的发生率以及病理类型比较均无统计学差异(均P>0.05),低 C3 组ESRD的发生率明显高于正常C1q组,差异具有统计学意义(P<0.05)。见表5。
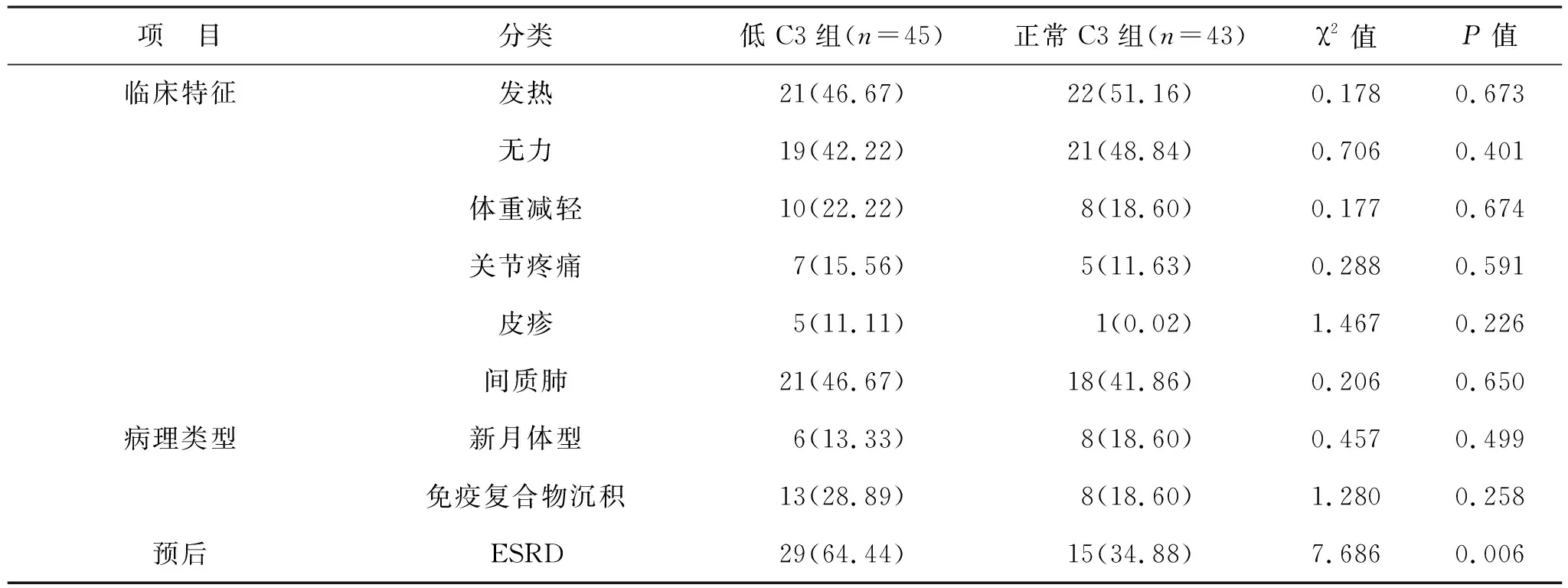
表5 不同C3水平组患者临床特征、病理类型及预后比较[例(%)]
3 讨 论
在机体的免疫系统中,血清补体能够一定程度上介导免疫应答及炎性反应,其主要是参与获得性免疫与非特异性免疫[13]。补体系统包含30多种可溶性蛋白和膜结合蛋白,血清补体水平在健康人群体内保持着非常稳定的水平,一旦机体受到感染或损伤,其表达水平就会发生异常[14]。大量研究显示,在ANCA结合激活中性粒细胞的扩增环中,血清补体发挥着不可忽视的作用,由于呼吸爆发、脱颗粒以及NETs的形成,血管内皮发生损伤,进而激活补体经典途径和替代途径,大量白细胞内流,炎症反应进一步加重[15]。血清补体C1q在补体的经典激活途径中发挥着重要作用,能够识别IgG与IgM的免疫复合物,通过调控巨噬细胞,来达到清除凋亡细胞和循环免疫复合物的作用,进而维持机体免疫平衡。近年来临床上通过对C1q表达水平进行测定,进而评估患者肾功能状况[16-18]。C3能够比较直观的反映机体血清补体系统的功能,通过检测其水平变化能够更加准确的评估机体免疫功能状况,可以作为反映肝细胞损伤的重要临床指标,低水平的C3提示机体免疫功能异常、肝细胞可能受损[19-21]。
本研究结果显示,与健康人群相比,AAV患者体内血清补体C1q、C3表达水平显著降低,AAV患者机体由于免疫功能下降,炎症反应增加,进而使得血清补体表达水平异常[22-23]。虽然研究中低水平C1q病例数较少,但研究发现低 C1q 组β-2MG水平显著高于正常C1q组,IgM、RBC、Hb以及LDH水平显著低于正常C1q组,两组患者临床特征的发生率以及病理类型均无统计学差异,提示C1q水平与AAV患者临床症状、病理类型无显著关联。低 C3组患者β-2MG、BUN、CysC、Tn、BNP以及LDH水平显著高于正常C3组,PLT、WBC以及Hb水平显著低于正常C3组,两组患者临床特征的发生率以及病理类型均无统计学差异,提示C1q水平与AAV患者临床症状、病理类型无显著关联,但低水平C3患者肾功能各项指标异常,肾损伤更为严重,这可能是由于机体大量消耗血清补体C3,机体对免疫复合物的清除率降低,进而导致肾损伤加重[24-25]。预后结果显示,低 C1q 组与正常C1q组患者、低 C3 组和正常C3组患者ESRD的发生率均存在显著统计学差异,推测低水平C1q、低水平C3可能与AAV患者临床预后存在一定程度的关联。
综上所述,AAV患者体内血清补体 C1q、C3 水平明显低于健康人群,低 C1q、C3水平的AAV患者临床预后明显更差,同时发现低C3水平AAV患者肾功能受损严重,在临床实践中要密切注意患者血清补体 C1q、C3 水平,早期对患者采取积极有效的措施进行干预,改善预后。本研究存在一定的局限性,样本量相对较少,后续可加大样本研究量,进一步对患者预后不良的危险因素进行分析探究。

