异鼠李素对H2O2诱导的肠上皮细胞氧化应激损伤的保护作用
王德宇,杨东亮,常 刘
(大连市第四人民医院烧伤创面科,辽宁 大连 116000)
肠上皮由单层肠上皮细胞组成,可选择性吸收水和营养物质,是抵御毒素和肠外病原体的第一道屏障[1]。当肠上皮细胞通透性增加时,肠腔中的抗原和内毒素进入循环系统,导致肠道及全身性疾病的发生,如炎症性肠病、脓毒症[2-3]等。氧化应激使体内氧化-抗氧化失衡,产生过量活性氧(Reactive oxygen spiecies,ROS),增加肠道通透性和肠道上皮细胞损伤,导致肠上皮屏障功能障碍。抑制氧化应激有助于恢复肠上皮细胞功能,阻碍肠道相关疾病的发展[4]。
黄芪属多年生草本植物,是常用中药材之一,具有增强机体免疫功能、抗菌、抗氧化剂等药理活性[5]。据研究报道,黄芪可改善糖尿病小鼠肾脏的氧化损伤[6],其对全身炎症反应综合征患者肠屏障功能具有保护作用[7]。异鼠李素(Isorhamnetin,ISO)属黄酮类化合物,是黄芪的有效成分之一,可有效防治氧化应激相关疾病的进展[8-9]。目前,ISO对氧化应激状态下肠上皮细胞的影响及分子机制尚不十分明确。基于此,本研究旨在评价ISO对H2O2诱导的大鼠肠上皮细胞IEC-6氧化损伤的影响,探讨ISO保护肠上皮细胞的可能机制,以期为肠屏障功能障碍相关疾病的防治提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞:大鼠肠上皮细胞IEC-6购自赛百慷(上海)生物技术股份有限公司。
1.1.2 主要实验试剂:DMEM培养基(武汉赛维尔生物科技有限公司);ISO(阿拉丁科技有限公司);N-乙酰半胱氨酸(N-Acetyl-L-cysteine,NAC)(阿拉丁科技有限公司);甲基噻唑蓝(MTT)、细胞凋亡检测试剂盒、活性氧(ROS)检测试剂盒、丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)测定试剂盒、全蛋白提取试剂盒、核蛋白和浆蛋白提取试剂盒、兔抗大鼠Nrf2一抗(WL02135)(1∶500)、兔抗大鼠HO-1一抗(WL02400)(1∶500)、兔抗大鼠p-Akt一抗(WLP001a)(1∶500)、兔抗大鼠Akt一抗(WL0003b)(1∶500)、羊抗兔IgG-HRP二抗(WLA023)(1∶5000)(沈阳万类生物科技有限公司)。
1.2 实验方法
1.2.1 细胞分组:IEC-6细胞接种至含10%FBS的DMEM培养基中,待细胞生长状态良好时,用不同浓度ISO(0、10、20、40、80、100、200 μmol/L)处理细胞24 h,筛选3个对细胞生长无抑制或毒性的药物浓度。随后将细胞随机分为正常对照组:正常培养细胞42 h;H2O2组:正常培养细胞24 h后,500 μmol/L H2O2处理细胞18 h;NAC组:10 μmol/L NAC预处理细胞1 h后,500 μmol/L H2O2处理细胞18 h;异鼠李素低剂量组:20 μmol/L异鼠李素预处理细胞24 h后,500 μmol/L H2O2处理细胞18 h;异鼠李素中剂量组:40 μmol/L异鼠李素预处理细胞24 h后,500 μmol/L H2O2处理细胞18 h;异鼠李素高剂量组:100 μmol/L异鼠李素预处理细胞24 h后,500 μmol/L H2O2处理细胞18 h。
1.2.2 MTT法检测细胞活力:将细胞以4×103个/孔的密度接种于96孔板中,细胞贴壁后,按照实验分组进行加药处理。药物达到相应处理时间后,弃去各组细胞培养基,每孔加入20 μl MTT染色液,置于37 ℃、5% CO2培养箱中孵育4 h。4 h后吸去上清,加入150 μl Formanzan溶解液。待Formanzan全部溶解后,在酶标仪上测定其在570 nm处的OD值,进行数据分析。
1.2.3 流式细胞术检测细胞凋亡水平:将细胞以5×105个/孔的密度接种于6孔板中,待细胞贴壁后,加入不同药物处理细胞。细胞处理相应时间后,弃去培养基,用PBS洗涤细胞2次。收集各组细胞制成细胞悬液,150 g离心5 min后,用500 μl Binding Buffer重悬细胞,然后依次加入5 μl AnnexinV-FITC及10 μl PropidiumIodide混匀。室温避光孵育15 min后,流式细胞仪检测各组细胞凋亡水平。
1.2.4 流式细胞术检测细胞中ROS水平:将细胞以5×105个/孔的密度接种于6孔板中,用药物处理相应时间后,更换为含DCFE-DA探针的培养基,37 ℃孵育20 min。用无血清培养基洗涤细胞后,收集各组细胞制成细胞悬液,150 g离心5 min后,用PBS重悬细胞进行流式检测。
1.2.5 试剂盒检测细胞中MDA、SOD水平:各组IEC-6细胞进行药物预处理并用H2O2造模后,消化并收集细胞,提取细胞中蛋白,按照MDA、SOD试剂盒说明书检测细胞中MDA含量及SOD活力。
1.2.6 Western blot检测细胞中Nrf2、HO-1、p-Akt/Akt水平:细胞达到处理时间点后,弃去培养基,预冷PBS漂洗细胞3次,加入适当体积的蛋白裂解液或核蛋白和浆蛋白提取试剂盒中的抽提试剂提取总蛋白和核蛋白。BCA法测定蛋白浓度并定量,SDS-PAGE凝胶电泳分离蛋白并转印至PVDF膜。将转印好的PVDF膜用5%的脱脂奶粉室温封闭1 h后,分别加入Nrf2(1∶500)、HO-1(1∶500)、p-Akt(1∶500)、Akt(1∶500)一抗,4 ℃条件下孵育过夜。孵育一抗后的PVDF膜用TBST缓冲液洗膜4次,每次5 min。用HRP标记的山羊抗兔二抗(1∶5000)37 ℃孵育45 min后,TBST缓冲液洗膜6次,每次5 min。最后加入ECL化学发光液显色,用凝胶图像处理系统(Gel-Pro-Analyzer)软件分析目的条带的灰度值。以Histone H3作为核蛋白Nrf2内参,β-actin作为HO-1、p-Akt、Akt蛋白内参,计算各目的蛋白的相对表达量。
1.3 统计学方法 采用SPSS 20.0统计学软件进行统计分析。计量资料经正态性检验符合正态分布,数据以均数±标准差表示,各组间数据比较采用单因素方差分析,组间两两比较采用Tukey检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 异鼠李素对H2O2诱导的IEC-6细胞活性的影响 异鼠李素对IEC-6细胞毒性作用如图1A所示,0~100 μmol/L的异鼠李素对IEC-6细胞生长无明显抑制作用,各组吸光度与正常组相比差异无统计学意义(P>0.05)。200 μmol/L异鼠李素显著降低了IEC-6细胞的吸光度值,产生细胞毒性(P<0.05)。异鼠李素对H2O2诱导的IEC-6细胞活性的影响如图1B所示,20~100 μmol/L 异鼠李素对细胞活性的影响呈剂量依赖性,其中NAC及100 μmol/L 异鼠李素对H2O2诱导的IEC-6细胞损伤有保护作用,其吸光度与H2O2组相比差异具有统计学意义(P<0.05)。
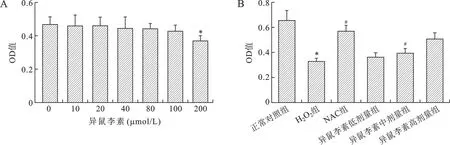
A:异鼠李素对正常IEC-6细胞的毒性作用;B:不同浓度异鼠李素对H2O2诱导的IEC-6细胞活性影响。与正常对照组比较,*P<0.05;与H2O2组比较,#P<0.05图1 异鼠李素对H2O2诱导的细胞活力的影响
2.2 异鼠李素对H2O2诱导的IEC-6细胞凋亡的影响 异鼠李素对各组细胞凋亡水平的影响如图2所示。与空白组相比,H2O2组细胞凋亡率显著升高(P<0.05)。与H2O2组相比,NAC及异鼠李素中、高剂量组细胞的凋亡率显著降低(P<0.05)。

注:与正常对照组比较,*P<0.05;与H2O2组比较,#P<0.05图2 异鼠李素对H2O2诱导的细胞凋亡的影响
2.3 异鼠李素对H2O2诱导的IEC-6细胞ROS水平的影响 以DCFH-DA为荧光探针,用流式细胞仪检测IEC-6细胞中ROS的平均荧光强度。如图3所示,与正常对照组相比,H2O2使IEC-6细胞产生过量ROS(P<0.05)。NAC组及异鼠李素低、中、高剂量组IEC-6细胞中ROS的生成显著降低(P<0.05)。

注:与正常对照组比较,*P<0.05;与H2O2组比较,#P<0.05图3 异鼠李素对H2O2诱导的细胞ROS水平的影响
2.4 异鼠李素对H2O2诱导的IEC-6细胞MDA、SOD水平的影响 进一步检测细胞中MDA含量及SOD活力以评价异鼠李素对IEC-6细胞抗氧化能力的影响。如图4A所示,H2O2组细胞中MDA含量较正常对照组显著升高(P<0.05),NAC组及异鼠李素高剂量组细胞中MDA含量显著降低(P<0.05)。图4B显示,与正常组相比,H2O2组细胞中SOD活力明显下降(P<0.05),NAC组及异鼠李素高剂量组细胞中SOD的活力较模型组显著增加(P<0.05)。
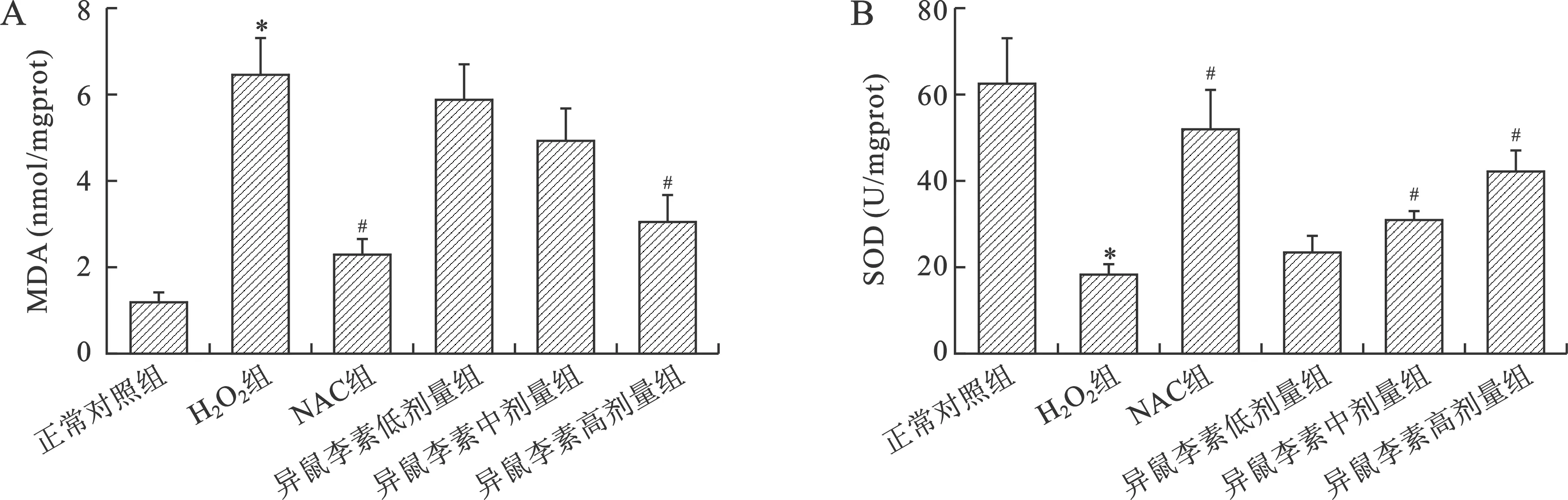
A:异鼠李素对细胞中MDA含量的影响;B:异鼠李素对细胞中SOD活性的影响。与正常对照组比较,*P<0.05;与H2O2组比较,#P<0.05图4 异鼠李素对H2O2诱导的细胞MDA、SOD水平的影响
2.5 异鼠李素对H2O2诱导的IEC-6细胞抗氧化信号通路的影响 Western blot检测异鼠李素对IEC-6细胞中抗氧化信号通路相关指标蛋白表达的影响。由图5可知,异鼠李素低、中、高剂量组细胞核中Nrf2及细胞中HO-1的表达逐渐增加,说明异鼠李素的抗氧化能力不断增强。其中,与H2O2组相比,异鼠李素中、高剂量组细胞核中Nrf2及细胞中HO-1的表达显著升高(P<0.05)。此外,与H2O2组相比,NAC组及异鼠李素中、高剂量组细胞中p-Akt/Akt的表达显著增加(P<0.05)。
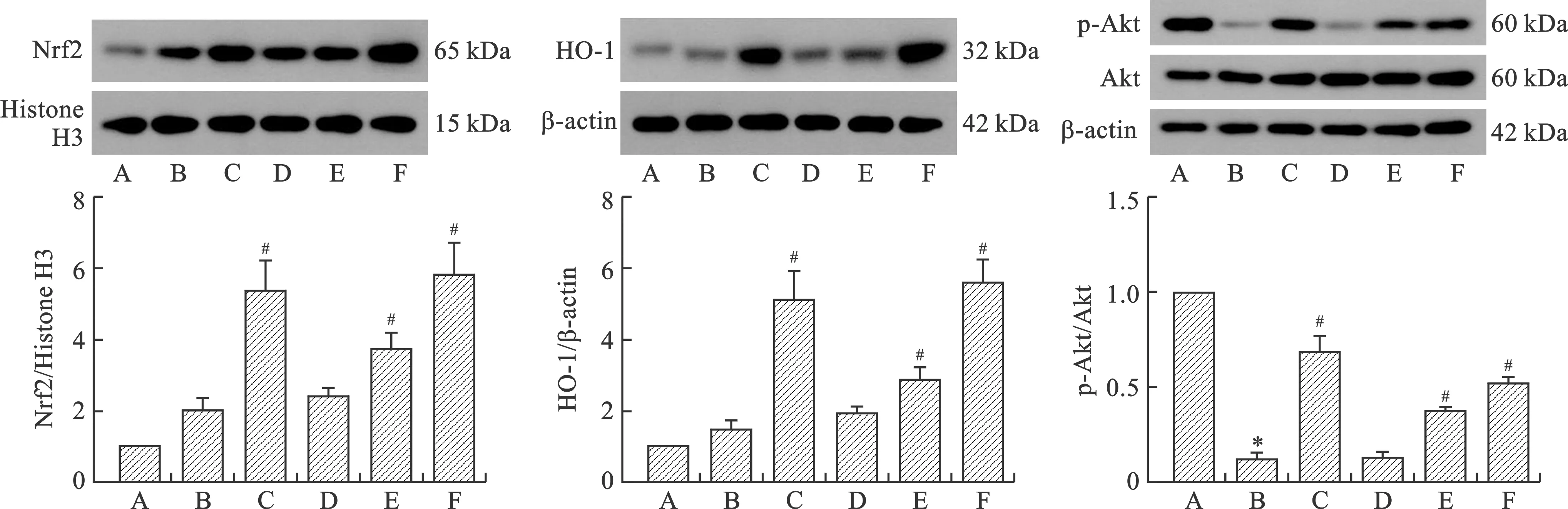
A:正常对照组;B:H2O2组;C:NAC组;D:异鼠李素低剂量组;E:异鼠李素中剂量组;F:异鼠李素高剂量组。与正常对照组比较,*P<0.05;与H2O2组比较,#P<0.05图5 异鼠李素对H2O2诱导的细胞抗氧化信号通路的影响
3 讨 论
肠道上皮功能障碍在肠道及全身性疾病的发病进程中起重要作用。氧化应激是引起肠上皮细胞损伤及功能障碍的关键机制。H2O2作为ROS的主要成分之一,广泛用于建立细胞氧化应激模型[10]。NAC可增强抗氧化防御体系,是常用的抗氧化剂。因此,本研究使用H2O2处理IEC-6细胞,模拟氧化应激条件下的肠上皮细胞损伤,并以NAC为阳性对照,系统评价异鼠李素的抗氧化功效及作用机制。
肠上皮细胞免受氧化应激损伤是缓解肠上皮功能障碍的关键因素。异鼠李素在氧化应激参与的心血管疾病[11]、糖尿病[9]及缺血再灌注脑损伤等多种疾病中表现出抗氧化活性,具有较高的开发和应用价值。研究表明,异鼠李素预处理可显著增强视网膜细胞活力并抑制H2O2诱导的细胞凋亡水平[12]。此外,异鼠李素预处理可保护人脐静脉内皮细胞免受H2O2损伤[13]。本研究结果显示,H2O2处理导致IEC-6细胞活力显著降低。异鼠李素可显著提高氧化应激状态下IEC-6细胞活性,且作用呈剂量依赖性。同时,异鼠李素能够降低H2O2诱导的IEC-6细胞的凋亡水平。由此可知,异鼠李素对氧化应激状态下的IEC-6细胞具有保护作用。
ROS过量产生引起氧化应激并导致肠上皮屏障功能障碍[14]。丙二醛(MDA)由多不饱和脂肪酸的脂质过氧化产生,是过氧化最重要的产物之一,用于测定生物体中的氧化应激水平[15]。超氧化物歧化酶(SOD)是一种重要的抗氧化物酶,通过清除超氧阴离子使细胞免受ROS损伤[16]。据报道,异鼠李素预处理显著降低暴露于H2O2的H9C2细胞中ROS的生成及MDA含量,同时增加SOD活性[17]。另据报道,异鼠李素可降低H2O2诱导的角质细胞中MDA的含量并提高SOD活性[18]。本研究结果显示,异鼠李素预处理显著降低了IEC-6细胞中ROS及MDA的水平,增加了细胞中SOD活性。以上结果提示,异鼠李素可增强IEC-6细胞的抗氧化能力,缓解H2O2引起的IEC-6细胞的氧化应激损伤。
Nrf2/ARE是机体抗氧化的重要信号通路,通过促进下游抗氧化酶如HO-1等的表达保护细胞免受氧化应激,维持细胞中氧化还原平衡[19]。正常生理状态下,Nrf2与Keap1结合以无活性复合物的形式存在于细胞质中。当细胞受到刺激时,Nrf2与Keap1解离并移位至细胞核中,与抗氧化反应元件(ARE)结合以激活抗氧化酶的转录[20]。磷脂酰肌醇3-激酶(PI3K)/Akt是Nrf2的上游信号分子,在抵抗氧化应激的细胞防御系统中起主导作用[21]。PI3K/Akt通过激活Nrf2/HO-1信号通路发挥细胞保护作用。据报道,异鼠李素通过激活PI3K/Akt信号通路使视网膜上皮细胞免受氧化应激损伤[11]。此外,在H2O2诱导C2C12细胞氧化应激模型中,异鼠李素预处理可激活Nrf2/HO-1信号通路,增强细胞的抗氧化能力。Western blot结果显示,异鼠李素处理显著提高了Akt蛋白的磷酸化水平,增加了细胞核中Nrf2水平及下游抗氧化物酶HO-1的表达,提示PI3K/Akt信号通路与异鼠李素诱导的Nrf2/HO-1的激活有关。
综上所述,本研究结果表明,异鼠李素可保护IEC-6细胞免受H2O2诱导的氧化应激损伤。此外,异鼠李素可能通过激活PI3K/Akt介导的Nrf2/HO-1抗氧化信号通路缓解H2O2诱导的肠上皮细胞功能障碍。

