儿茶素单体EGC对胰脂肪酶的抑制作用及其机理研究
满子意,凤怡,吴祥庭
温州大学生命与环境科学学院,浙江 温州 325035
胰脂肪酶是胰腺合成和分泌的重要脂解 酶,能将三酰基甘油酯水解成单酰基甘油酯和游离脂肪酸,然后被机体重新吸收利用并最终合成脂肪[1],过多的脂肪堆积是导致肥胖、高血脂症、脂肪肝等多种疾病的关键原因[2]。而抑制胰脂肪酶活性,延缓三酰基甘油酯的水解过程,是预防和治疗肥胖、高血脂症及其并发症的重要方法[3]。目前,市场上用于治疗肥胖和高血脂症的临床药物以奥利司他和辛伐他汀为主[4],虽然这类药物可以有效控制血脂的上升,但长期服用会出现恶心、头痛、胀气、腹泻等副作用以及肝肾损伤等问题[5]。越来越多的证据表明,天然植物提取物对胰脂肪酶具有较好的抑制效果,且副作用较小[6-8],因此,从天然植物资源中找到安全、有效的胰脂肪酶抑制剂一直是食品、生物及医药领域的研究热点。
表没食子儿茶素(Epigallocatechin,EGC)作为茶叶中的一种天然儿茶素单体,是茶叶中含量较丰富、生物活性较高的茶多酚之一,被应用于食品加工、医药保健领域[9]。现代药理学研究表明,植物多酚具有抗氧化、调节血糖和血脂水平的作用,这归因于其多个-OH和环状结构[10]。陈旭等[11]研究发现,山楂叶多酚在质量浓度为 2.5 g·L-1时对胰脂肪酶的抑制率可达46.8%。李锋等[12]对高血脂大鼠进行连续饲喂EGC,发现EGC能极显著降低高脂模型大鼠血清中的甘油三酯含量,在一定程度上可以降低低密度脂蛋白胆固醇含量,说明EGC具有一定的降脂作用。王诗卉等[13]研究了茶叶儿茶素抑制剂对胰脂肪酶构效关系的影响,发现胰脂肪酶二级结构的变化与 EGCG浓度呈正相关,而三级结构的变化与 EGCG浓度没有显著的相关性。然而目前有关儿茶素单体EGC的降血脂作用机制尚未完全清楚,并且关于EGC在体外抑制胰脂肪酶的研究也鲜见报道。基于此,本研究从EGC与胰脂肪酶化学结构的角度分析了二者之间的相互作用模式及结构变化,并对EGC抑制胰脂肪酶的效果和类型进行分析,旨在阐释EGC与胰脂肪酶相互作用产生抑制效果的分子机制,为茶叶EGC在降血脂中的应用提供技术和理论依据。
1 材料与方法
1.1 试验材料
干茶样品由绍兴御茶村茶叶有限公司提供,胰脂肪酶(来源:猪胰腺;15~35 U·g-1)购自上海阿拉丁试剂有限公司,二甲基亚砜(NMR级)购自宁波萃英化学技术有限公司,溴化钾(光谱纯)购自上海麦克林生化科技有限公司,AB-8大孔树脂购自上海蓝季科技发展有限公司,酚酞购自上海麦克林生化科技有限公司;其他化学试剂均为市售国产分析纯。
1.2 仪器
MuNanoscope3a型扫描电子显微镜,美国Digitalinstrument公司;NicoletiN 10 MX型傅里叶红外光谱仪,美国Thermo Scientific公司;AVANCE3 AV500型核磁共振氢谱仪,德国Bruker公司;F-7000型荧光分光光度计,日本日立公司;Rotavapor R-210型旋转蒸发仪,瑞士Buchi公司。
1.3 EGC的分离纯化
参考魏志文[14]和顾峰[15]的方法,并进行适当修改提取纯化EGC单体。茶多酚粗品的制备:称取15 g干茶样品,置于1 L烧杯中,加入 450 mL超纯水,100℃水浴浸提 60 min(每隔20 min搅拌1次),过滤;向滤渣中再加入450 mL超纯水,100℃水浴浸提60 min,过滤。合并两次滤液,抽滤,弃滤渣,将滤液浓缩(旋转蒸发温度为50℃,压强为0.1 mPa)得到约150 mL的浓缩液,浓缩液用等体积三氯甲烷萃取3次,脱除咖啡碱和色素,回收三氯甲烷层,水层用等体积的乙酸乙酯再次萃取3次,合并酯层溶液,溶液经旋转浓缩(50℃,0.4 mPa)、减压干燥后得茶多酚粗品。
大孔树脂柱的制备与装柱:用超纯水多次淘洗大孔树脂,直到洗出液不再有白色浊液后向树脂中加入95%的乙醇溶液继续清洗,待洗出液澄清后将树脂浸泡在 95%的乙醇溶液中24 h待用。用充分溶胀后的大孔树脂装柱,得到2.5 cm×38 cm的柱体,装柱后用95%的乙醇以5 mL·min-1的流速平衡柱体24 h,平衡后上样。
EGC单体的纯化:称取制备好的茶多酚粗品2 g,用15 mL 95%乙醇溶解,再用0.45 μm有机滤膜过滤后上柱,用95%的乙醇溶液保持5 mL·min-1的流速洗脱,收集树脂柱前 3 BV流失液(BV为树脂床体积,1 BV即表示1倍树脂床体积,约2 500 mL),将流失液旋转减压浓缩(50℃,0.4 mPa)、真空干燥,于-20℃保存,得EGC粗品。EGC粗品用少量乙酸乙酯溶解后过滤,后向滤液中加入二氯甲烷,会产生大量沉淀,继续加二氯甲烷直到不产生沉淀为止。将溶液静置 30~60 min,5 000 r·min-1离心10 min,将滤渣干燥后冷冻保存,即纯化后的EGC。
1.4 EGC的结构表征
1.4.1 扫描电子显微镜(SEM)观察
取纯化的EGC单体,在25℃下真空干燥12 h。取真空干燥后的样品,均匀分散在样品台上,吹去未粘住的样品,并喷金3 min。喷镀完成后用扫描电子显微镜观察形貌[16]。参数设置:加速电压 HV=1.00 kV;工作距离WD=6.9 mm;探头类型ETD。
1.4.2 傅里叶红外光谱(FTIR)检测
将1 mg样品与300 mg KBr混合后研磨并压制成薄片,并使用傅里叶红外光谱仪进行测试。扫描范围为 400~4 000 cm-1,共扫描 64次[17]。
1.4.3 核磁共振氢谱(1H-NMR)
称取 12 mg EGC样品并转移到 2 mL eppendorf管中,然后加入 0.5 mL NMR级DMSO溶剂,通过超声溶解化合物。最后将澄清的溶液转移到5 mm NMR管中,并使用核磁共振氢谱仪获得数据[18]。
1.5 EGC对胰脂肪酶抑制效果的测定
参照 GB/T 23535—2009《脂肪酶制剂》和王菲菲[19]的方法并适当修改。向两个编号分别为A和B的100 mL的锥形瓶中分别加入4 mL底物溶液(PVA乳化液)和 5 mL磷酸盐缓冲液(PBS,0.2 mol·L-1、pH=7.5),然后向A瓶中加入15 mL 95%的乙醇溶液,将A、B两瓶在40℃水浴锅中预热5 min,随后向两瓶中分别加入1 mL 10 mg·mL-1的胰脂肪酶溶液后立即混匀计时,准确反应 15 min后向 B瓶中加入15 mL 95%的乙醇溶液终止反应,再向 A、B瓶中分别加入 2~3滴酚酞溶液,用0.05 mol·L-1的 NaOH溶液滴定计算游离脂肪酸含量,按下式计算空白组胰脂肪酶活性。

式中:VA为A瓶消耗0.05 mol·L-1NaOH溶液的体积;VB为 B 瓶消耗 0.05 mol·L-1NaOH溶液的体积;50表示1 mL 0.05 mol·L-1的NaOH溶液相当于脂肪酸50 μmol;15表示反应时间15 min。
分别取 0.6、0.8、1.0、1.2、1.4、1.6 mg·mL-1EGC溶液或奥利司他溶液1 mL加入到A、B锥形瓶中,重复以上操作,测定并计算各计量组胰脂肪酶活性。按下式计算各组胰脂肪酶抑制率,并确定其半抑制浓度(IC50)值。

式中:Uck表示空白组酶活性,Us表示样品组酶活性。
1.6 EGC对胰脂肪酶的抑制动力学研究
根据范金波等[20]的方法稍作修改,测定方法同1.5章节。将1 mL不同浓度的EGC溶液(0.6、0.8、1.0、1.2、1.4 mg·mL-1)与 4 mL PVA 乳化液(6、8、10、12、14 mg·mL-1)混合,然后在 40℃下培养 5 min后加入 10 mg·mL-1的胰脂肪酶溶液准确反应15 min。以底物浓度的倒数(1/[S])为横坐标,反应速率(1/V)为纵坐标,绘制不同质量浓度下 EGC的Lineweaver-Burk图,动力学 Cornish-Bowden方程如下用于确定抑制模式。

式中,[S]表示 PVA 乳化液浓度(mg·mL-1),Kic为竞争性抑制常数,Kiu为非竞争性抑制常数,Km为米氏常数,V为酶促反应速率mol·(L·min)-1,[C]表示 EGC 浓度(mg·mL-1)。
1.7 EGC对胰脂肪酶的荧光猝灭作用研究
F-7000荧光光度计(日本日立)用于测试样品的荧光光谱。采用 PBS(0.2 mol·L-1,pH=7.5)配置胰脂肪酶溶液(0.5 mg·mL-1)和不同质量浓度的EGC溶液(0.6、0.8、1.0、1.2 mg·mL-1)。EGC溶液分别与胰脂肪酶溶液按(V∶V=1∶1)充分混匀,将各反应组溶液置于 40℃孵育 15 min,孵育后测定其荧光吸光度。荧光激发波长为 280 nm,扫描范围为290~450 nm,发射缝均为 5 nm[21]。
1.8 分子对接
使用 AutodockVina程序进行胰脂肪酶和儿茶素单体EGC的半柔性分子对接。胰脂肪酶的结构(PDB ID:1ETH)从PDB蛋白质数据库中获得[22]。对接前先去除蛋白质晶体结构中的杂原子和水分子,在pH=7.4的生理条件下补加氢原子,然后进行全蛋白对接[23-24]。根据获得的结果,选择结合亲和力打分最高的对接构象进行相互作用的讨论,使用ChimeraX和 LigPlus查看相互作用的三维和二维图像。
2 结果与分析
2.1 EGC的结构表征及与关键胰脂肪酶氨基酸残基相互作用模式
用扫描电子显微镜、红外光谱仪、1H-NMR等方法表征制备的EGC单体的化学结构。图1展示了EGC单体的微观结构和形貌。SEM图像表明EGC单体分布不规则,主要为管状结构,表面光滑,与其同源物质ECG显微形貌相似[25]。

图1 扫描电镜(SEM)下的EGC晶体形貌Fig. 1 The EGC crystal morphology under SEM
图2是EGC的红外光谱结果,在3 406 cm-1附近的吸收峰主要是-OH伸缩振动产生,C-H伸缩振动的特征吸收峰在 2 837 cm-1附近,1 500 cm-1附近的几个吸收峰是苯的 C=C伸缩振动峰,1 147 cm-1和 1 039 cm-1为 C-O伸缩振动峰[26]。

图2 EGC的红外光谱结果Fig. 2 FTIR results of EGC
图3是 EGC的1H-NMR结果,EGC的1H-NMR信号中含有较多活泼氢,因此很难识别自旋体系。δH7.96、δH8.90、δH9.11 和 δH4.65处的信号属于 EGC分子上的-OH,容易产生O-H···O 型氢键[27]。EGC 分子与其他多酚类化合物类似,为环状结构,带羟基、酚羟基等活性基团,推测EGC中的这些活性部位更容易通过氢键或疏水相互作用与酶中的关键氨基酸残基发生相互作用[28]。胰脂肪酶的本质是由多个氨基酸残基组成的单链糖蛋白,共分为两个区域,一个是发挥催化功能的N端结构,另一个是可结合辅助因子的C端区域[29]。研究表明,胰脂肪酶活性中心形成了1个天冬氨酸-组氨酸-丝氨酸的三联结构,经化学修饰后丝氨酸可以降低酶的活性,说明丝氨酸是胰脂肪酶发挥催化作用的关键氨基酸[30]。丝氨酸中存在羟基、氨基、羧基等活性官能团,可以与EGC分子中的羟基、酚羟基形成多个不同氢键,结合成更稳定的复合物影响酶的活性。另外苯丙氨酸、色氨酸、亮氨酸等疏水性氨基酸在胰脂肪酶结构中也发挥了重要作用,EGC还可与这些氨基酸形成氢键、范德华力、疏水相互作用等多种作用模式,从而改变了酶的化学结构和空间构象,导致酶活性的改变[30]。
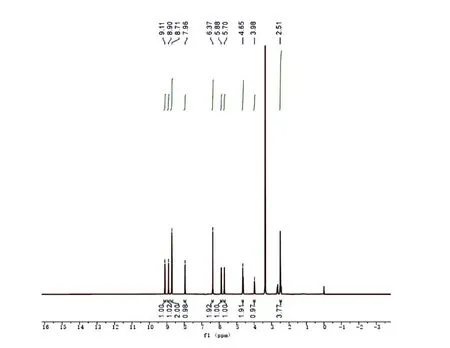
图3 EGC的核磁共振氢谱结果Fig. 3 1H-NMR results of EGC
2.2 EGC对胰脂肪酶的抑制效果
人类消化系统中碳水化合物主要通过α-淀粉酶和α-葡萄糖苷酶水解为葡萄糖[31],而脂肪的消化主要依靠胰脂肪酶水解为游离脂肪酸和单酰基甘油酯,它能够将人体摄入的三酰基甘油酯水解掉 40%~70%[32-33]。因此胰脂肪酶是脂肪消化的先决条件,其活性高低可以影响脂肪的消化反应进程。奥利司他等胰脂肪酶抑制剂是临床用于辅助治疗高血脂症、肥胖症的有效药物,可通过阻止三酰基甘油水解,减少肠腔黏膜对膳食中脂肪的吸收,促使脂肪排出体外[34]。如图4所示,不同浓度的EGC溶液对胰脂肪酶具有一定的抑制作用,且随着EGC浓度的增加而增加。但抑制效果明显弱于对照品奥利司他对胰脂肪酶的抑制效果,且EGC抑制胰脂肪酶的 IC50值为(1.620±0.085) mg·mL-1,高于奥利司他(1.013±0.072) mg·mL-1。但 EGC 是从天然植物中分离出的化合物,具有绿色、安全、副作用小的优点,相比奥利司他更适合长期用于辅助治疗高血脂症以及肥胖症。且相比于其他天然产物中提取到的胰脂肪酶抑制剂,褚盼盼等[35]研究的苦荞麦多糖对胰脂肪酶抑制作用的 IC50为 28.23 mg·mL-1、张静等[36]研究的黑果枸杞花色苷提取物对胰脂肪酶抑制作用的 IC50为(2.84±0.45) mg·mL-1、安欢等[37]研究的苦瓜多糖对胰脂肪酶抑制作用的 IC50为 29.86 mg·mL-1,EGC表现出较强的胰脂肪酶抑制作用。相比其他儿茶素单体,EGC对胰脂肪酶的抑制效果低于其同源物质EGCG,赵瑜等[38]、杨龙佳等[39]、Sergent等[40]、Grove等[41]分别报道了 EGCG以(0.55±0.02) mg·mL-1、1.32 mg·mL-1、0.8 μmol·L-1、7.5 μmol·L-1的IC50值抑制胰脂肪活性。此外Rahim等[42]通过研究几种黄酮和非黄酮多酚体外抑制胰脂肪酶活性的模式发现,只有没食子酸、EGC和EGCG显示出较高的脂肪酶抑制潜力(IC50值分别为 387.2、237.3 μmol·L-1和 391.2 μmol·L-1);没食子酸乙酯和没食子醇葡萄糖仅显示出一定的抑制效果;而未酯化的黄烷-3-醇,如(+)-儿茶素、(-)-表儿茶素、(+)-没食子酸对胰脂肪酶几乎没有抑制效果。这些结果表明EGC是一种有效的胰脂肪酶抑制剂,在降血脂、抗肥胖药物和功能性食品的研究中具有潜在价值。
2.3 EGC对胰脂肪酶的抑制动力学分析结果
建立基于动力学 Cornish-Bowden方程的Lineweaver-Burk图来确定EGC抑制胰脂肪酶的抑制模式。如图5所示,随着EGC浓度的提高,EGC对胰脂肪酶的酶促反应速率直线的斜率逐渐增大,与 Y轴的交点(1/Vmax)上移,即最大反应速率(Vmax)减小。在所有EGC受试浓度下,直线在X轴上的截距(-1/Km)保持不变,即无论 EGC的浓度如何,米氏常数(Km)保持在恒定值,表明EGC对胰脂肪酶的抑制效率与底物浓度无关,EGC是胰脂肪酶的非竞争性抑制剂。非竞争性抑制仅取决于抑制剂的浓度,抑制剂与酶活性位点以外的部位结合,与底物不形成竞争关系[43-44]。因此EGC抑制胰脂肪酶的机制可能是与酶活性中心以外的关键氨基酸残基结合,形成更稳定的多元复合物或使酶的分子结构发生改变,减慢三酰基甘油酯的分解速度,从而达到控制血脂的目的。

图5 不同EGC浓度下的Lineweaver-Burk图Fig. 5 Lineweaver-Burk plots of pancrelipase inhibition by various concentrations of EGC
2.4 EGC对胰脂肪酶的荧光猝灭效应
荧光光谱实验被用来进一步研究EGC与胰脂肪酶之间的相互作用。在一定的激发波长下,色氨酸、酪氨酸以及苯丙氨酸的存在可以使得胰脂肪酶具有荧光特性[45]。其中贡献最大的是色氨酸与酪氨酸残基,在280 nm波长时内源荧光被激发,并且这两种氨基酸残基所处的微环境还会影响其荧光强度与位置[46]。图6显示了不同浓度的EGC对胰脂肪酶的荧光猝灭效应。EGC对胰脂肪酶具有荧光猝灭作用,荧光光谱在340 nm附近出现固有峰。随着EGC浓度的增大,胰脂肪酶的荧光强度逐渐下降,且最大发射波长发生轻微红移,这种浓度依赖关系是EGC和胰脂肪酶相互作用的明显证据[21]。在荧光光谱中,最大发射波长的红移也意味着蛋白质的部分结构发生改变,这可能是EGC与胰脂肪酶中的氨基酸残基发生相互作用的结果[47]。由于微环境由亲水性变为疏水性,导致蛋白质结构展开,最终产生荧光猝灭效应。因此推测EGC可能通过氢键和疏水相互作用与酶中的色氨酸、酪氨酸、苯丙氨酸等结合形成更稳定的多元复合物,导致酶构象或极性的改变,从而抑制酶的活性。

图6 不同浓度EGC对胰脂肪酶荧光特性的影响Fig. 6 The effect of EGC on the fluorescence characteristics of pancrelipase
2.5 分子对接
分子对接技术可以直观地表示配体与受体的结合位点和结合构象,有助于其相互作用机理的分析。选择结合亲和力打分最高的 9组对接构象进行相互作用分析(图7),如图所示,与 EGC相互作用的氨基酸残基为Asp206、Cys262、Asp258、Gln239、Lys233、Asn213、Asn263、Gln234、Cys238、Phe259、Ala261、Val260、Gly251、Leu214等,这些氨基酸残基是驱动胰脂肪酶与EGC结合的主要氨基酸。其中 Asp206、Asp258、Gln239、Cys262主要通过 N-H···O、O-H···O 型氢键与胰脂肪酶相互作用,其余氨基酸残基则主要通过疏水相互作用与胰脂肪酶相互作用。已有研究表明,胰脂肪酶活性中心是 1个天冬氨酸-组氨酸-丝氨酸的三联结构[30],因此可以推测EGC主要与胰脂肪酶活性中心以外的必需基团结合,如Asn263、Phe259、Gln234等,通过非竞争的方式抑制胰脂肪酶活性,这与抑制动力学的试验结果一致。与其他多酚类化合物(如黄酮类、花青素类)相似,芳香六元环上的羟基在氢键的形成上起到了关键作用[48],已有研究表明,随着羟基数目的增加,多酚类物质的生物活性越强,对胰脂肪酶的抑制效果更显著[49]。EGC通过疏水相互作用与多个氨基酸残基周围的疏水腔结合,影响其微环境的极性,导致蛋白质发生去折叠现象,改变了酶的结构,从而产生了荧光光谱实验中的荧光猝灭现象,也影响了胰脂肪酶的生物活性,进而降低其对底物的催化能力[23,49]。

图7 EGC与胰脂肪酶的分子对接Fig. 7 Molecular docking for the interaction between pancrelipase and EGC
3 讨论
茶叶具有降血脂功效已得到广泛认同,但是关于其有效成分的机制研究却进展不大。茶多酚是茶叶中儿茶素类、黄酮类、酚酸类和花色素类物质的总称,占干物质含量的15%~25%[50];其中儿茶素类化合物是最重要的组分。儿茶素类化合物可抑制多种与脂肪合成相关酶的表达及活性,并调节多种与胆固醇合成相关的酶的活性,其中研究最广泛的是EGCG,体外试验结果表明,EGCG可以通过抑制与物质消化相关的酶以及与肠道细胞刷毛缘上特定转运因子形成复合物,降低胃肠道对葡萄糖和脂类的吸收与利用,减少三酰基甘油酯水解,从而降低游离脂肪酸被机体重新吸收利用并最终合成脂肪的过程[51]。EGC作为EGCG的同源化合物,与 EGCG具有相似的化学结构和生物活性,含量仅次于EGCG,是儿茶素以及茶多酚类化合物发挥生物活性的重要化合物。
本研究通过多种光谱技术研究了EGC的化学结构,以及与胰脂肪酶的相互作用。我们证实了EGC对胰脂肪酶具有非竞争性抑制作用,IC50为(1.62±0.085) mg·mL-1,抑制作用主要是通过氢键和疏水相互作用改变酶的化学结构和空间构象与胰脂肪酶中的氨基酸残基形成复合物来实现。EGC抑制胰脂肪酶的机制是深入理解多酚类化合物作为脂肪水解酶抑制剂的关键因素。通常食物中的脂肪进入人体后会被胰脂肪酶水解为游离脂肪酸和单酰基甘油酯,这些物质经肠道吸收后会重新合成脂肪导致脂肪堆积以及血脂升高,通过抑制胰脂肪酶活性可以减少脂肪的分解从而达到降血脂的目的,因此抑制胰脂肪酶活性是研究脂肪分解代谢、降血脂机制以及开发降血脂药物的关键[52-53]。EGC分子同时显现出亲水性和疏水性,而胰脂肪酶内部非极性氨基酸的侧链区域表现出疏水性,EGC中的酚羟基能够与胰脂肪酶内部的氨基酸残基通过氢键以及疏水相互作用结合在一起,形成更稳定的复合物,改变酶的结构,降低了酶的分解速率,从而减少脂肪分解实现降脂的目的。因此本研究可以为利用EGC作为新型食品添加剂或胰脂肪酶抑制剂开发功能性食品以及降血脂、抗肥胖药物提供理论依据。但是本研究仅通过体外试验对EGC抑制胰脂肪酶的活性进行探究,暂未进行动物试验,难以反映EGC在体内的复杂作用机制。欲深入阐明EGC对脂肪代谢的作用机制,后续还需进行动物体内试验,深入了解其在体内的复杂作用。
另一方面,通常绿茶鲜叶中的儿茶素含量约为200 mg·g-1,鲜叶中儿茶素组分含量由多到少分别为 EGCG、EGC、ECG、EC、GC、C[54],由于 EGC抑制胰脂肪活性所需的有效浓度较高,通过日常饮茶难以真正达到相应浓度。但是许多研究已表明,饮茶可以达到降脂效果且儿茶素对胰脂肪酶有较好抑制效果[55-57],因此饮茶降脂功能的实现应该是通过茶汤中的多种活性成分共同发挥作用。儿茶素作为最重要的活性物质,其单体成分在降脂机制中的作用十分重要,根据儿茶素的构成和比例,EGCG和EGC可能是发挥主要作用的单体,而这两种单体都属于黄烷-3-醇类化合物且结构主链中都有一个没食子酰基部分。因此胰脂肪酶中非极性氨基酸的数量及比例、酚羟基的个数以及黄烷-3-醇的没食子酰部分都是今后研究儿茶素以及多酚类物质对胰脂肪酶活性影响的关键。

