MRI DWI及DCE对浆细胞乳腺炎和乳腺导管原位癌鉴别诊断中的应用价值
沈云云,朱建国(通信作者)
(苏州工业园区星海医院放射科 江苏 苏州 215021)
乳腺导管原位癌是指发病于乳腺导管内的原位癌,常局限于导管上皮内而不侵犯基底膜,可作为一种乳腺癌前病变[1],患者经及时对症治疗后预后结局较为理想。但浆细胞乳腺炎与乳腺导管原位癌在症状表现等方面存在一定的相似性,因此临床易发生混淆诊断、误诊漏诊等。MRI检查是鉴别诊断浆细胞乳腺炎与乳腺导管原位癌常用技术手段,但常规平扫对二者的鉴别诊断效能较差,需进行多模式MRI的联合应用以提升诊断与鉴别诊断能力[2]。本文旨在探讨MRI、DWI及DCE在浆细胞乳腺炎和乳腺导管原位癌鉴别诊断中的应用价值。报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年7月—2022年3月苏州工业园区星海医院收治的119例乳腺疾病患者的临床病历资料与影像学资料,其中66例患者高度怀疑浆细胞乳腺炎,年龄32~65岁,平均(46.2±8.1) 岁,平 均 体 质 量 指 数(body mass index,BMI)为(22.35±1.85)k g/m2;53例患者高度怀疑为乳腺导管原位癌,年龄31~65岁,平均(45.9±7.8)岁,平均BMI(22.43±1.62)kg/m2。
纳入标准:①患者及家属均知情并签署知情同意书;②为临床症状与体征及超声检查高度怀疑为浆细胞乳腺炎和乳腺导管原位癌的患者。排除标准:①乳腺既往严重外伤或手术者;②妊娠期或哺乳期女性;③检查前行放化疗者。
1.2 方法
患者双乳MRI检查均使用Simens Skyra 3.0T MRI扫描仪,乳腺专用线圈。检查前消除患者紧张情绪,训练患者呼吸,减少伪影。检查时患者取俯卧位,腹部垫高,双乳自然下垂于线圈内,双手取自然位。扫描范围从乳房下界开始,向上至腋窝,包括双侧乳房。平扫扫描序列包括轴位T1WI、脂肪抑制T2WI及DWI。扫描参数:三维快速小角度激发成像序列:TR 6 ms,TE 2.5 m s,层厚1.2 m m,矩阵320×320;STIR T2WI:TR 4 490 ms,TE 53 ms,TI 230 ms,层厚4 mm,矩阵320×320;SE-EPI DWI 序列:TR 10 400 ms,TE 53 ms,b=800 s/mm2,层厚4 mm,矩阵128×128。动态增强扫描使用检查序列:TR 4.5 ms,TE 1.7 ms,层厚1.2 mm,矩阵320×320。对比剂采用Gd-DTPA(剂量0.1 mmol/kg)经肘静脉注入,速率为3 mL/s。高压注射器注药后,一分钟扫描一期,连续扫描5期,每一期采集128层。
以手术病理或穿刺活检结果作为诊断金标准,其中手术病理通过术中病灶及切缘、边缘组织冰冻进行快速病理诊断,穿刺活检则采用超声引导下空心针或麦默通方式采集病灶组织标本进行病理诊断。
1.3 观察指标
以组织病理学检查结果作为金标准,计算DCE-MRI联合DWI检查对浆细胞乳腺炎与乳腺导管原位癌诊断的灵敏度、特异度以及准确率,并对比病灶平均ADC值、同侧胸大肌ADC值、对侧正常乳腺ADC值以及rADC1、rADC2水平,ADC值的测量应用Functool软件检测DWI图像中感兴趣区(ROI),病灶区选择病灶最大直径所在层面实性部位,正常腺体选择病变对侧相对致密纤维腺体组织,而正常胸肌选择病变对侧最厚胸大肌层面,ROI面积10~15 mm2,检测三次取平均值,其中rADC值代表相对表观扩散系数数值,即病灶ADC值与对侧正常纤维腺体ADC值(rADC1)、病灶ADC值与对侧胸大肌ADC值(rADC2)。对比浆细胞乳腺炎与乳腺导管原位癌DCE-MRI表现特点。
1.4 统计学方法
采用SPSS 19.0统计软件分析数据,符合正态分布的计量资料以均数±标准差(x-± s)表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验。诊断结果一致性分析采用Kappa一致性检验,Kappa值>0.75时表示一致性良好;Kappa值在0.4~<0.75时表示一致性一般;Kappa值<0.4时则表示一致性较差。P<0.05为差异有统计学意义。
2 结果
2.1 DCE-MRI联合DWI对浆细胞乳腺炎与乳腺导管原位癌的诊断结果
66例高度怀疑浆细胞乳腺炎患者经组织病理实验确诊57例,DCE-MRI联合DWI诊断浆细胞乳腺炎的灵敏度为94.74%(54/57),特异度为77.78%(7/9),准确率为92.42%(61/66),一致性分析结果显示Kappa值为0.471。53例高度怀疑乳腺导管原位癌患者确诊43例,DCE-MRI联合DWI诊断乳腺导管原位癌的灵敏度为93.02%(40/43),特异度为80.00%(8/10),准确率为90.57%(48/53),一致性分析结果显示Kappa值为0.703。见表1~表2。

表1 DCE-MRI联合DWI对浆细胞乳腺炎诊断结果比较单位:例
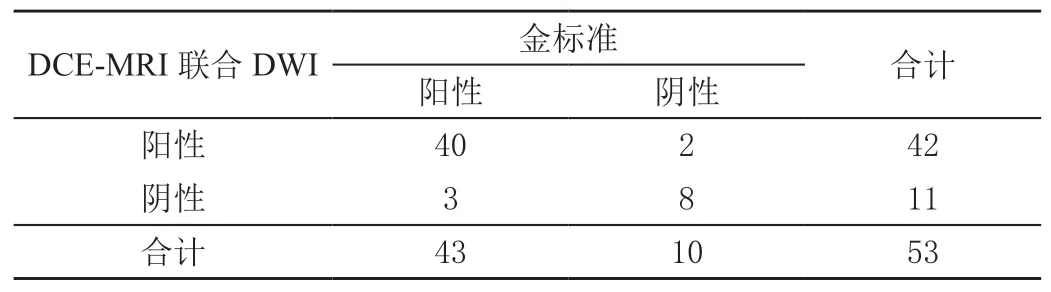
表2 DCE-MRI联合DWI对乳腺导管原位癌诊断结果比较单位:例
2.2 浆细胞乳腺炎与乳腺导管原位癌ADC值、rADC值比较
浆细胞乳腺炎患者病灶平均ADC值、rADC1、rADC2值均显著高于乳腺导管原位癌患者(P<0.01);两组同侧胸大肌ADC值、对侧正常乳腺ADC值比较无显著差异(P>0.05)。见表3。
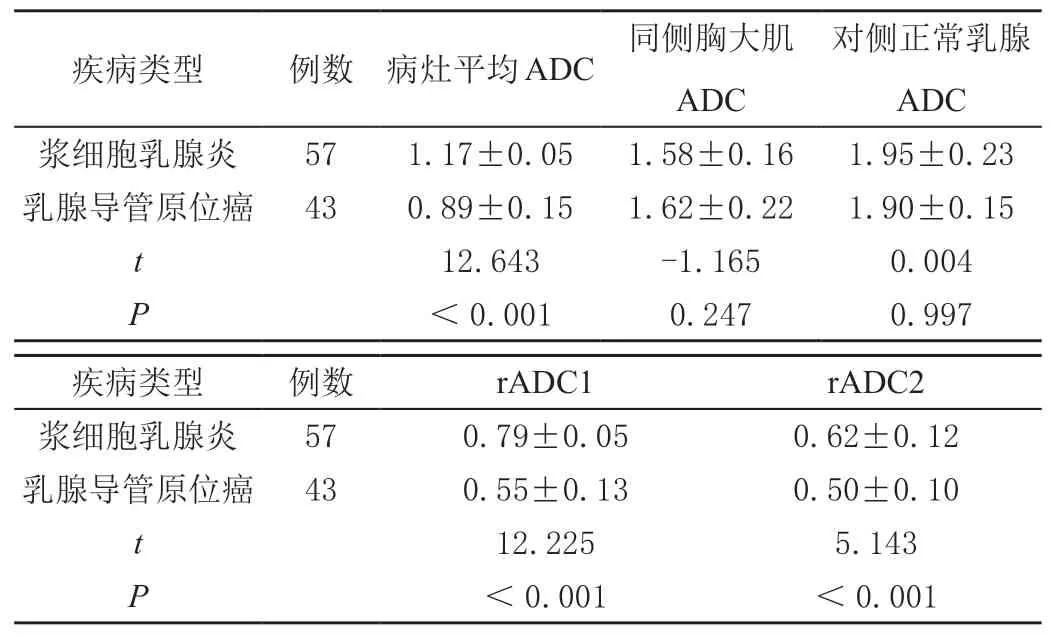
表3 浆细胞乳腺炎与乳腺导管原位癌ADC值、rADC值比较(x- ± s)
2.3 浆细胞乳腺炎与乳腺导管原位癌DCE-MRI影像特点比较
在DCE-MRI检查中浆细胞乳腺炎强化方式、TIC曲线类型以及导管形态与乳腺导管原位癌患者比较,差异均有统计学意义(P<0.05)。见表4。
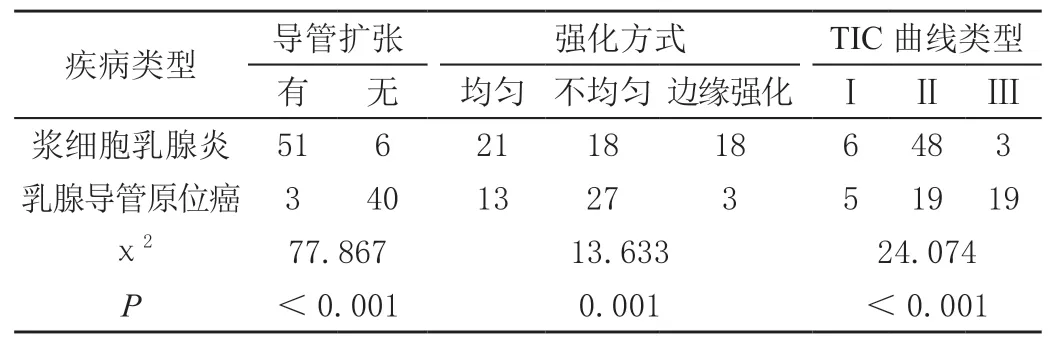
表4 浆细胞乳腺炎与乳腺导管原位癌DCE-MRI影像特点比较单位:例
3 讨论
浆细胞乳腺炎作为临床常见的非哺乳期无菌性炎性乳腺疾病,其临床表现较为复杂多样,且与浆细胞乳腺炎类型具有一定联系,其症状表现与乳腺导管原位癌存在一定重合,因此浆细胞乳腺炎与乳腺导管原位癌临床极易发生混淆、误诊、漏诊。MRI因在软组织分辨力方面具有一定的优势,因此常用于乳腺病变良恶性质的鉴别诊断中[3]。而本组研究结果显示,DCE-MRI联合DWI诊断浆细胞乳腺炎的灵敏度为94.74%,特异度为77.78%,准确率为92.42%,诊断乳腺导管原位癌灵敏度为93.02%,特异度为80.00%,准确率为90.57%。浆细胞乳腺炎患者病灶平均ADC值、rADC1、rADC2值均高于乳腺导管原位癌患者,并且在DCE-MRI检查中浆细胞乳腺炎强化方式、TIC曲线类型以及导管形态与乳腺导管原位癌患者比较中存在显著差异,表明DCE-MRI联合DWI对浆细胞乳腺炎以及乳腺导管原位癌均具有较高的敏感性与特异性,并能够根据ADC、rADC水平以及增强表现进行鉴别诊断,可进一步提升浆细胞乳腺炎以及乳腺导管原位癌的临床鉴别诊断效能,并对两种乳腺疾病治疗方案的制定与预后评估具有积极作用[4]。
而通过进一步分析认为,ADC值是DWI检查中所特有的量化参数,通常用作对组织细胞水分子扩散运动的定量分析,由于恶性肿瘤在细胞排列方面不同于正常健康细胞,其排列更为紧凑、间隙更小,这便导致组织细胞内水分子运动受累越严重,因此相对于正常健康组织,恶性肿瘤细胞的ADC水平更低[5-6]。而rADC值是一种与患者自身年龄、月经周期、内分泌功能有关的指标,并且rADC1指标的敏感度、特异度更高,这也在一定程度上表明ADC值、rADC值能够进一步提升乳腺炎与乳腺癌的鉴别诊断能力[7]。既往临床研究显示DCE-MRI用于鉴别诊断良恶性病变存在重叠现象,多为良性与恶性病变在早期强化方式中存在一定的交叉现象[8-9],并且通过TIC强度曲线实现肿瘤性质的鉴别诊断,能够为乳腺病灶提供完善的定性诊断信息,而通过DCE-MRI与DWI的联合应用能够进一步提升浆细胞乳腺炎与乳腺导管原位癌的鉴别诊断能力[10],提高了检查诊断的准确性,二者联合应用诊断能够避免高估病灶性质,对浆细胞乳腺炎与乳腺导管原位癌临床诊断率提高具有重要意义。
综上所述,DCE-MRI联合DWI可有效提升MRI检查对浆细胞乳腺炎与乳腺导管原位癌的鉴别诊断能力,且敏感性、特异性均较高,具有临床应用及推广价值。

