CCL5对人肺腺癌细胞增殖、凋亡的影响及机制研究
吴颖,高蔚,张佑杨,翁婷,李晶晶
肺癌在我国的发病率有逐年上升的趋势,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%。虽然目前肺癌的早期检出率及治疗有效率明显增加,但是由于中晚期肺癌确诊后仍缺乏有效的治疗措施,5年存活率仅仅15.9%,绝大多数患者死于肿瘤的复发与原发病灶的转移[1]。因此,识别有效的潜在分子生物标记物,对肺癌的预防、早期诊断、精准治疗及改善预后很重要。
在肿瘤的转移过程中趋化因子发挥了比较重要的作用,已有多项研究[2-4]证实趋化因子一定程度上参与了乳腺癌、肾癌、胃癌等肿瘤的发生与发展,它们不仅促进了恶性肿瘤新生血管的形成,并可通过改变肿瘤微环境,对肿瘤的发生、发展及转移具有促进作用[5-7]。CCL5是CC类趋化因子的一类,可通过介导上皮间质软化(EMT),增强肿瘤细胞浸润与转移能力,在恶性肿瘤转移中发挥重要作用[8]。参与EMT主要蛋白包括E-钙黏附蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)等。部分肿瘤细胞的TGF-β分泌量很高,TGF-β信号通路是介导EMT发生的重要途径,而CCL5可将TGF-β作为效应器发挥作用。但是CCL5-CCR5生物轴与肺癌侵袭、转移之间具体的作用机制及生物学功能尚不清楚。本研究通过敲低CCL5基因表达,抑制NSCLC细胞内CCL5蛋白表达,观察下调CCL5对肺癌A549细胞增殖、凋亡、侵袭、迁移等生物学特征的影响,了解CCL5在肺腺癌发病过程中可能作用机制,并初步评估CCL5促进肺腺癌细胞EMT的可能发病机制,为肺癌靶向治疗提供更准确的依据。
1 材料与方法
1.1 实验材料 人支气管上皮细胞株16HBE和人非小细胞肺癌细胞株A549、H358均购自中国科学院上海细胞库;小牛血清、DMEM培养液购自美国Gibco公司;Trizol(总RNA抽提试剂)、脂质体Lipofect 3 000、实时荧光定量聚合酶链反应(quantitativereal-time PCR,qRT-PCR)试剂盒均购自美国Invitrogen公司;Transwell培养小室购自美国Millipore公司;Western blot一抗及二抗购自美国Cell Signaling Technology公司;离心机购自美国Thermo Sciemific公司;荧光显微镜购自日本奥林巴斯;流式细胞仪购自美国Beckman coulter。
1.2 方法
1.2.1 细胞培养与转染 人支气管上皮细胞株16HBE和人非小细胞肺癌细胞株A549均在37℃,含5%CO2恒温培养箱中培养,取对数生长期的细胞用于试验,取生长良好的A549细胞用于转染。贴壁后按照Lipofectamine 3 000说明书进行细胞转染,将siRNA-NC 、siRNA-CCL5转染至A549细胞中,分别作为对照组(siRNA-NC组)、实验组(siRNA-CCL5组)。转染后将2组细胞放入培养箱中继续培养待后续实验,siRNA-CCL5基因序列号:CCGGCGAGATGCTTAAGTGTGACAACTCGAGTTGTCAC-ACTTAAGCATCTCGTTTTTG。
1.2.2 RT-PCR检测CCL5mRNA表达 收集转染48 h后2组细胞,提取总RNA,测定RNA浓度及纯度,用反转录试剂盒合成CDNA,用PCR仪进行扩增,检测各组细胞CCL5mRNA表达水平并计算mRNA相对表达量。
1.2.3 CCK-8检测细胞增殖能力 取对数生长期2组A549细胞,消化、离心、悬浮,取出所需细胞的总量,以每孔4×103个细胞的密度接种在96孔板中。分别将转染质粒后24、48、72 h细胞每孔加入CCK-8(10μL)+DMEM(90μL),继续在培养箱中培养2 h,使用酶标仪测量细胞在450 nm处的吸光度(opticaldensity,OD)值,并绘制生长曲线(72 h)。
1.2.4 流式细胞术检测细胞凋亡 将转染后2组A549细胞培养48 h,应用胰酶消化,离心,加入500 μL Binding buffer 重悬细胞,加入10 μL Annexin-V-FITC轻轻混匀后,加入5 μL PI 染色,室温下避光反应10 min,1 h内使用流式细胞仪进行流式分析,细胞凋亡率为annexinV(+)/PI(+/-)细胞占总细胞比率。
1.2.5 Transwell实验检测细胞迁移、侵袭能力 迁移试验:取对数生长期2组细胞,胰酶消化,重悬,然后以4×104细胞数置于上室培养,下室加入DMEM培养基(含胎牛血清),培养48 h后擦去未迁移细胞,用甲醇固定迁移细胞,并用结晶紫染液染色,倒置显微镜下数出迁移细胞数目。侵袭试验:提前用固定浓度的Matrigel凝胶包被小室上室底部膜,其他步骤同迁移实验。
1.2.6 Western blot检测蛋白表达 转染的 A549细胞,血清饥饿24 h后,用5%血清刺激,诱导EMT,按照说明书,提取细胞总蛋白,检测细胞中E-cadherin、Vimentin蛋白的表达水平。同样方法,提取实验组和对照组细胞蛋白, 行TGF-β蛋白检测。

2 结果
2.1 CCL5在肺腺癌细胞系中的表达情况 RT-PCR检测2种肺腺癌细胞系和人正常支气管上皮细胞中CCL5的表达。CCL5mRNA在2种肺腺癌细胞系A549、H358中都有表达,且均高于人正常支气管上皮细胞16HBE中的表达,差异有统计学意义(P<0.05)。CCL5在A549细胞中表达最高,因此选择A549细胞构建CCL5敲低的细胞系。见图1。

图1 CCL5在16HBE、H358、A549不同细胞系中mRNA表达水平
2.2 siRNA-CCL5对CCL5转录水平的影响 RT-PCR结果显示,与siRNA-NC组比较,siRNA-CCL5组CCL5mRNA水平下降,差异有统计学意义(P<0.05)。见表1。

4A~4B Transwell迁移实验检测敲低CCL5后A549细胞迁移能力 4C~4D Transwell侵袭实验检测敲低CCL5后A549细胞侵袭能力图4 敲低CCL5对A549细胞迁移、侵袭的影响

表1 2组CCL5mRNA相对含量
2.3 敲低CCL5对A549细胞增殖能力的影响 转染后,实验组在24、48、72 h时OD值小于对照组,差异有统计学意义(P<0.05),说明CCL5敲低可抑制A549细胞的增殖。见图2。
2.4 敲低CCL5后 A549细胞的凋亡情况 流式细胞术检测结果显示,与siRNA-NC组比较,siRNA-CCL5组A549细胞凋亡率增加(0.78% vs 1.8%),差异有统计学意义。见图3。
2.5 敲低CCL5对 A549细胞迁移、侵袭的影响 Transwell迁移实验显示,对照组迁移平均细胞数为(252±13)个,高于实验组(105±10)个(P<0.05),见图4A,4B。侵袭实验显示对照组侵袭平均细胞数为(198±15)个,高于实验组(98±11)个(P<0.05)。见图4C,4D。上述结果提示CCL5敲低后A549细胞迁移、侵袭能力均受到抑制。

图2 CCK8法检测敲低CCL5对A549细胞增殖能力的影响

图3 敲低CCL5表达对A549细胞凋亡的影响
2.6 敲低CCL5对 A549细胞EMT相关蛋白、TGF-β的影响 Western blot 实验结果显示,和 siRNA NC 组相比, CCL5 siRNA 组Vimentin蛋白表达水平降低(P<0.05),E-cadherin 蛋白表达水平上升(P<0.05),提示敲低CCL5基因可以减少A549细胞发生EMT。CCL5 siRNA 组TGF-β信号通路中的 TGF-β蛋白表达降低, 提示CCL5可能通过TGF-β通路促进E-cadherin 蛋白表达增加。见图5。
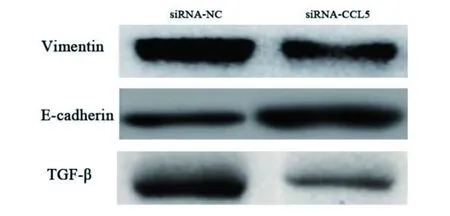
图5 Western blot方法检测敲低CCL5对Vimentin、E-cadherin、TGF-β蛋白表达的影响
3 讨论
CCL5在多种恶性肿瘤性疾病中呈现高表达并参与了肿瘤进展的数种病理学过程。其主要表达于巨噬细胞、T淋巴细胞和特定类型的肿瘤细胞,可通过与受体CCR1、CCR3、CCR5等结合活化蛋白激酶C,促进多种免疫细胞的募集[9-11]。CCL5的异常高表达可能与肿瘤的进展及预后紧密相关。Aldinucci等[12]指出在血液系统、消化系统恶性肿瘤的发病中CCL5-CCR5通路发挥重要作用; Liu等[13]研究证实巨噬细胞来源的CCL5通过p65/STAT3-CSN5-PD-L1途径促进大肠癌细胞的免疫逃逸;Song等[14]指出RNA TMEM92-AS1通过与YBX1结合介导CCL5,从而促进胃癌进展。但CCL5蛋白表达在肺癌的研究目前相关研究报道极少。
本研究结果提示CCL5在人非小细胞肺癌细胞系A549细胞、H358中表达较人支气管上皮细胞系16HBE中升高,提示其可能在肺腺癌中发挥促癌基因的作用,与肺癌的发生、发展密切相关。本研究进一步应用shRNA敲低CCL5基因表达,观察下调CCL5表达对细胞生长的影响,结果显示A549细胞增殖能力明显降低,凋亡比率增加,因此推测下调CCL5可抑制A549细胞增殖,促进凋亡,发挥抑癌作用,与An等[15]研究结果相似,该研究显示在特定类型的乳腺癌中,乳腺癌细胞能够自分泌CCL5促进肿瘤细胞的增殖,下调CCR5和CCL5表达水平,可促进乳腺癌细胞的凋亡。有研究[16]发现CCL5 mRNA在肝癌组织中呈现高表达,与肝癌的进展及预后有相关性,同期细胞实验证明巨噬细胞和成纤维细胞分泌CCL5能促进肿瘤相关细胞的增殖或募集; Yamaguchi等[17]研究显示乳腺癌患者原发病灶、血液、转移灶、转移的淋巴结中均高表达CCL5/CCR5,CCL5可能由间充质干细胞分泌,一旦降低乳腺癌细胞中CCL5表达,细胞迁移受抑制,且 CCL5表达高低与肿瘤侵袭性、分期有明显关联,上述研究提示CCL5在肝癌和乳腺癌的侵袭转移中起着关键性的作用。本研究Transwell实验显示敲低CCL5后,A549细胞的侵袭和迁移能力明显降低,可能与A549细胞增殖周期停滞导致细胞持续生长的生物学行为受到影响有关。
肿瘤的发生是一个复杂的过程,涉及多因素的相互作用。而细胞增殖和凋亡异常为肿瘤的浸润转移提供数量基础。本实验结果提示CCL5可能通过增强肿瘤细胞的侵袭、迁移、增殖能力,抑制凋亡在肺腺癌中发挥促癌基因作用。有研究[18-19]表明:趋化因子CCL5能够促进乳腺癌细胞上皮间质转化及增加肿瘤细胞侵袭、增殖的能力, CCR5高表达与乳腺癌的分期,分级相关,CCL5或许能成为治疗乳腺癌的靶点。研究[20]显示在肝癌患者中,基质细胞分泌的CCL5通过PI3K-Akt通路刺激Huh7肝细胞的迁移和侵袭,对其增殖周期和凋亡有一定的影响,均与本文研究结果一致。
肿瘤细胞的EMT是恶性肿瘤生长转移的重要环节。EMT启动后,部分上皮细胞的表型蛋白如E-cadherin表达下降,而间质细胞的表型蛋白如Vimentin表达升高,肿瘤细胞黏附能力减弱,迁移、侵袭、抗凋亡性和耐药能力增强,因此,抑制EMT是肿瘤治疗的关键环节[21]。EMT过程中多条信号通路会出现异常表达,而TGF-β信号通路最为经典。TGF-β可诱导肿瘤细胞发生 EMT 改变,促进肿瘤细胞侵袭、转移能力及发生免疫逃逸[22]。肿瘤细胞分泌的 CCL5 可增加肿瘤微环境中的间充质干细胞,诱导 EMT发生[23]。在肿瘤的转移过程中CCL5/CCR5作用轴可能与TGF-β密切相关。CCL5可通过调控TGF-β促进乳腺癌 EMT[24]。本研究结果提示CCR5低表达后,A549细胞内E-cadherin蛋白水平上调,而Vimentin蛋白下调,说明EMT过程受到抑制,且随着CCL5 敲低,TGF-β蛋白表达相应降低,提示CCL5可能通过TGF-β通路增加A549细胞EMT,促进肺癌的浸润转移。本研究仅通过肺腺癌A549细胞初步探讨了CCL5增加EMT的可能作用机制,后续的研究将在其他肺癌细胞株及移植瘤小鼠中进一步验证。
综上所述,体外敲低CCL5表达促进A549的凋亡,并抑制其增殖,侵袭和迁移能力,可能是通过TGF-β通路抑制细胞EMT过程实现的。因此,CCL5作为促癌基因在NSCLC恶性生物学行为中具有重要作用。本研究对明确肺癌全身扩散、转移的机制,进一步开发新型分子靶向药物奠定了一定理论基础。

