有机胺共沉淀法制备类球型氢氧化钴
桑子容,韩培林,罗 喆,陈 杰,吴 云,张 勇
武汉工程大学材料科学与工程学院,湖北 武汉 430205
超级电容器因具有高的功率密度、长的循环寿命和较快的充放电速率等优势,已广泛应用于混合动力、汽车、可穿戴电子设备等。作为超级电容器的重要组成部分,电极材料是影响超级电容器电容性能的主要因素[1-2]。
由于氢氧化钴具有独特的纳米结构和良好的电化学性能,且其资源相对丰富、价格低廉、环境友好、导电性较其他氢氧化物好,作为超级电容器电极材料受到了科研工作者的广泛关注[3-5]。
氢氧化钴具有多层结构、大的层间距、高的理论比电容、高的氧化还原活性及可逆性,是具有广阔应用前景的电极材料[6-7]。此外氢氧化钴在碱性二次电池添加剂及电化学多相催化方面也具备巨大的优势[8-9]。氢氧化钴的形貌结构及颗粒尺寸影响其导电性、比容量及电化学反应的催化活性[10-11],因此氢氧化钴的制备过程尤为重要。具有良好形貌的氢氧化钴可以作为制备氧化钴的前驱物。这种形貌可控的氧化钴材料广泛用于超级电容器、锂离子电池、多相催化等方面。
氢氧化钴与氢氧化镍的制备类似,主要有胺沉淀法[12]、电沉积法[6]、沉淀转化法[13]、溶胶凝胶法和热分解法[14]等。不同制备方法得到的氢氧化钴的性能也有所不同。戚洪亮等[15]用化学络合沉淀法制备球形氢氧化钴,探索了氨加入量、反应温度等条件对氢氧化钴粒径的影响,所制备的氢氧化钴平均粒径均在10 μm以上。王成均等[16]研究了氢氧化钴前驱体的制备工艺,使得制备的样品平均粒度分布控制在5~10 μm,并为各种形貌和粒径的四氧化三钴的制备摸索了条件。刘献明等[17]对采用化学共沉淀法制备的氢氧化钴进行了掺杂,粒径分布在60~70 nm之间。付海阔等[18]采用氨络合控制的沉淀结晶工艺制备了微米级的氢氧化钴。池汝安等[19]利用液相沉淀法合成了氢氧化钴前驱体,探讨了钴盐浓度、聚乙烯吡络烷酮用量和煅烧温度对其电化学性能的影响。
但是上述制备方法或使用氢氧化钠,或使用氨水,制备成本高昂,对设备要求较高,且产生较多氨氮废水,造成环境污染。因此,本文提出以有机胺为沉淀剂制备氢氧化钴,避免了上述问题。由于合成有机钴的氢氧化钴的粒度要小于10 μm,本文探讨了中间粒度4~6 μm球形氢氧化钴的最佳制备工艺。
1 实验部分
1.1 实验试剂与仪器
实验药品:氯化钴(分析纯,天津市百世化工有限公司);有机胺(分析纯,银丰化学工业有限公司)。
真空干燥箱(DHG-9203A,上海一恒科学仪器);数显恒温水浴锅(HH-6,巩义市予华仪器);多头磁力搅拌器(HJ-6,常州国华电器有限公司);电动搅拌器(JJ-1 200 W,江苏金坛医疗仪器厂);X射线衍射仪(AXS D8 ADVANCE,美国Bruker公司);扫描电子显微镜(Hitaehi S4800 SEM,日本森林雨)。
1.2 氢氧化钴的制备
按照物质的量的比为1∶2分别称取氯化钴和有机胺,将氯化钴配制成实验所需浓度的溶液。将氯化钴溶液和有机胺倒入三颈烧瓶中,将烧瓶转移入数显恒温水浴锅中。控制反应温度和搅拌速度,待反应结束后,进行过滤,最后在100℃真空干燥箱中干燥,得到氢氧化钴样品。
1.3 氢氧化钴的表征
采用扫描电子显微镜(scanning electron microscope,SEM)观察氢氧化钴的微观形貌,采用X射线衍射(X-ray diffraction,XRD)仪对样品进行结构分析,扫描范围为10°~80°,扫描速度为10(°)/min。使用激光粒度分析仪对各条件下制备的氢氧化钴进行粒度分析。
2 结果与讨论
2.1 反应物浓度
保持搅拌速度为560 r/min,反应温度为65℃,反应时间为2 h的条件,氯化钴和有机胺按照物质的量比为1∶2,在0.5、1.0、1.5、2.0、2.0 mol/L的氯化钴溶液浓度下反应。图1(a)是不同氯化钴浓度下制备的氢氧化钴的粒径变化曲线。可以看出随着氯化钴浓度的增加氢氧化钴平均粒径呈现先增大后减小的趋势。当氯化钴浓度为1.5 mol/L时,平均粒度最大。
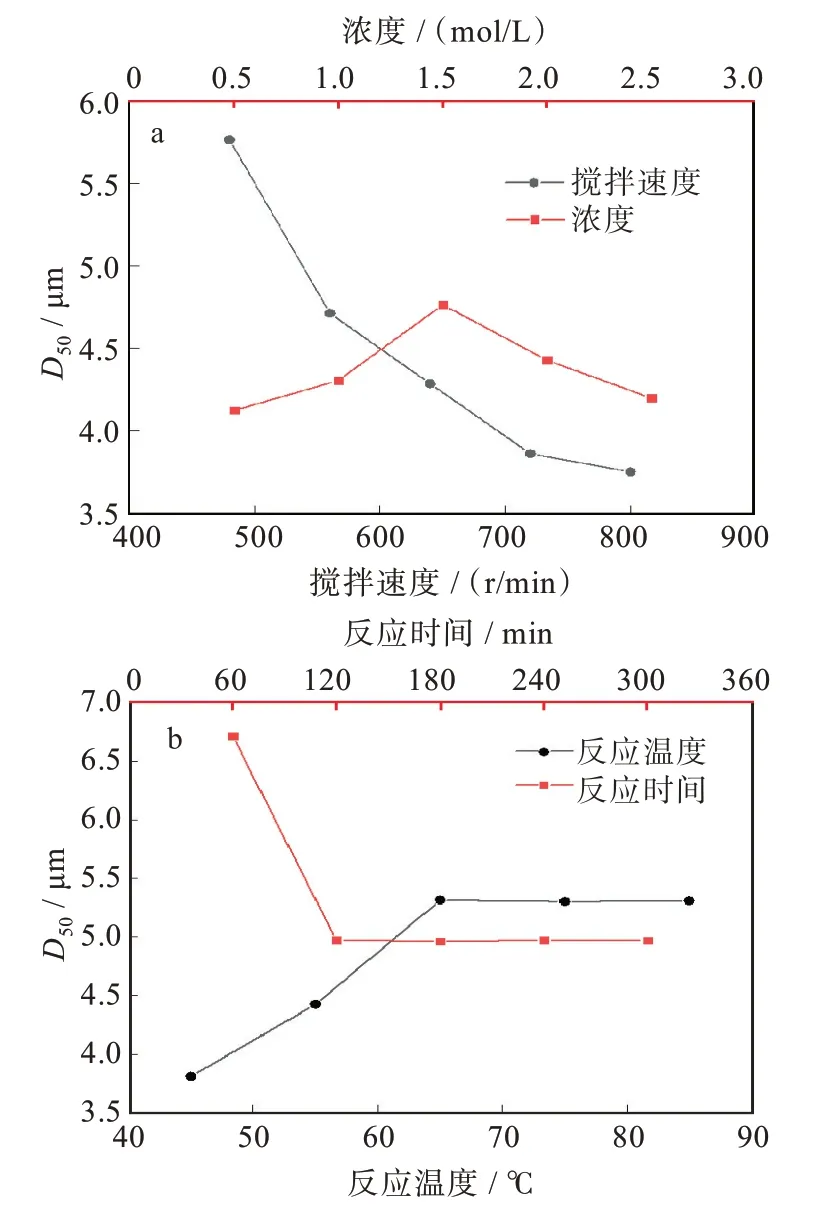
图1 不同因素对制备的氢氧化钴D50的影响:(a)搅拌速度和氯化钴浓度,(b)反应时间和反应温度Fig.1 Influences of different factors on D50 of prepared cobalt hydroxide:(a)stirring speeds and cobalt chloride concentrations,(b)reaction time and reaction temperatures
图2(a-d)是 氯 化 钴 浓 度 为0.5、1.0、1.5、2.5 mol/L条件下制备的氢氧化钴的SEM图。可以清晰地看到氯化钴浓度为1 mol/L和2.5 mol/L时所制备的氢氧化钴颗粒形貌为片状,且片状破碎化、细小化。当氯化钴浓度为1.5 mol/L时所制备的氢氧化钴颗粒球形度饱满。因此控制氯化钴浓度为1.5 mol/L。

图2 不同氯化钴浓度下制备的氢氧化钴的SEM图:(a)0.5 mol/L,(b)1.0 mol/L,(c)1.5 mol/L,(d)2.5 mol/LFig.2 SEM images of cobalt hydroxide prepared at different cobalt chloride concentrations:(a)0.5 mol/L,(b)1.0 mol/L,(c)1.5 mol/L,(d)2.5 mol/L
2.2 搅拌速度
保持其他条件不变,改变反应中搅拌速度。由图1(a)可以看出,随着搅拌速度的增大,氢氧化钴D50总体呈现减小趋势。搅拌速度越高,为体系提供的能量越多,生成的小颗粒也越多,能量转化为颗粒的表面能,有利于体系的稳定。在较小的搅拌速度下,产生的颗粒偏大,且容易产生团聚。当搅拌速度在560和640 r/min时,制备的氢氧化钴粒度分布在4~6 μm。
图3(a,b)分别是搅拌速度为560和640 r/min条件下制备的氢氧化钴SEM图。可以看出,搅拌速度为560 r/min时,氢氧化钴颗粒绝大部分呈现完整球型。当搅拌速度增大到640 r/min,大部分氢氧化钴颗粒呈破碎状伴随少部分呈现片状,不符合预期制备要求,因此选择最佳搅拌速度为560 r/min。

图3 不同搅拌速度下制备的氢氧化钴的SEM图:(a)560 r/min,(b)640 r/minFig.3 SEM images of cobalt hydroxide prepared at different stirring speeds:(a)560 r/min,(b)640 r/min
2.3 反应温度对粒度分布的影响
保持其他条件不变,改变反应温度。图1(b)反应了氢氧化钴平均粒度随反应温度的变化,可以看出氢氧化钴的粒度随温度的升高而增大,当温度到达65℃后晶体粒径变化不大。图4(a-d)是反应温度分别为55、65、75、85℃下制备的氢氧化钴的SEM图,氢氧化钴在低温下开始出现球形,随温度升高颗粒球形饱满度增强,数量增多。因此选择65℃为最佳反应温度。

图4 不同反应温度下制备的氢氧化钴SEM图:(a)55℃,(b)65℃,(c)75℃,(d)85℃Fig.4 SEM images of cobalt hydroxide prepared at different reaction temperatures:(a)55℃,(b)65℃,(c)75℃,(d)85℃
2.4 反应时间
保持其他条件不变,控制反应时间。反应时间为0表示有机胺和氯化钴同时加完的时刻,即反应初始时刻。从图1(b)中可以看出随着反应时间的增加,氢氧化钴的粒度在减小。搅拌对氢氧化钴的粒度有影响,猜测初始的晶体是团聚体,随着反应时间的增加逐渐被打散。图5(a-c)分别为反应0、1、2 h时制备的氢氧化钴的SEM图。
从图5(a)可以看到在反应初始时氢氧化钴形成团聚体,随时间增加,开始分散形成小颗粒,从图5(b)可以看到大部分团聚体已经被分散开,从图5(c)可以看出团聚体已经完全分散。SEM图表明在反应初始即形成了团聚体,所以初始粒径最大。反应1 h后颗粒被分散,2 h后分散完全,此后粒度变化度不大,整个晶体生长过程符合晶体生长规律。综上选择最佳的反应时间为2 h。

图5 不同反应时间下制备的氢氧化钴的SEM图:(a)0 h,(b)1 h,(c)2 hFig.5 SEM images of cobalt hydroxide prepared at different reaction times:(a)0 h,(b)1 h,(c)2 h
2.5 最佳条件下制备的氢氧化钴样品的表征
由以上实验得出制备类球型氢氧化钴的最佳条件为:氯化钴浓度为2 mol/L,反应温度为65℃,搅拌速度为560 r/min,反应时间为2 h。对在此条件下制备出的氢氧化钴进行了表征。
图6(a)为制备的氢氧化钴样品的SEM图,可以清晰看出氢氧化钴颗粒外观呈球状或类球状。图6(b)为制备的氢氧化钴样品的粒径分布图,可以看出在最佳条件下制备的氢氧化钴粒度区间小且分布较为集中,总体呈正态分布。累计分布达到10%对应的粒径为2.040 μm,累计分布达到90%对应的粒径为8.046 μm,平均粒径为5.046 μm,符合预期4~6 μm球形氢氧化钴的制备要求。图6(c)为制备的氢氧化钴样品的XRD图。可以看出,样品主峰峰型完整,衍射峰强度较高,结晶度较好。在衍射角2θ为19.2°、32.5°、38.1°、51.2°、57.9°、61.8°处的衍射峰位置分别对应于Co(OH)2的(001)、(100)、(101)、(102)、(110)、(111)晶面,与PDF#45-0031卡片中衍射峰位置一致。
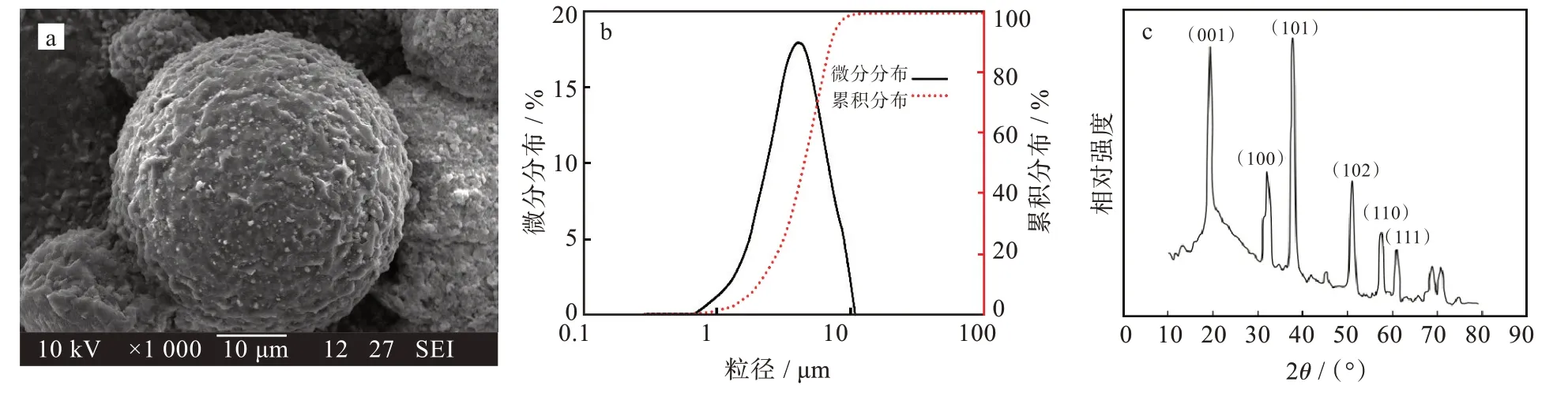
图6 最佳条件下球型氢氧化钴样品表征:(a)SEM图,(b)粒径分布曲线,(c)XRD图Fig.6 Characterization of spherical cobalt hydroxide sample under optimal conditions:(a)SEM image,(b)particle size distribution curves,(c)XRD pattern
3 结论
以氯化钴为钴源、有机胺为沉淀剂,成功制备了氢氧化钴,粒度较为适中。实验发现,低浓度或高浓度的制备条件或导致产物呈现片状或球状不完全;随着反应时间的延长、搅拌加快,团聚消失,这对制备是有利的;温度对制备的影响表现为温度升高,氢氧化钴球形度更加完备。氯化钴浓度为1.5 mol/L,搅拌速度为560 r/min,反应温度为65℃,反应时间为2 h时,所制备产物粒径与形貌最佳,平均粒径D50为5.046 μm,粒径整体分布在2.040~8.046 μm。SEM显示整体形貌为类球形。

