温度对碱作用下卵白蛋白-葡萄糖体系色泽、理化特性及抗氧化活性的影响
谭继恩,姚 瑶,吴 娜,徐明生,赵 燕,刘会平,涂勇刚,*
(1.江西农业大学 江西省农产品加工与质量控制工程实验室,江西省天然产物与功能食品重点实验室,江西 南昌 330045;2.天津科技大学食品工程与生物技术学院,天津 300457)
蛋清是食品工业的重要营养资源和宝贵成分,其主要由水(88%)和蛋白质(11%)组成。卵白蛋白是蛋清主要蛋白质,约占蛋清总蛋白质的54%[1]。卵白蛋白在蛋清的功能特性如凝胶性、起泡性及乳化性中起重要作用[2]。卵白蛋白由385 个氨基酸组成,分子质量约为45 kDa,等电点(pI)为4.5[3]。卵白蛋白是一种单聚糖蛋白,在其第292位的天冬酰胺(Asn)结合了一个单一碳水化合物[4]。在卵白蛋白核心内部有4 个游离硫醇基团,在第73位和第120位的半胱氨酸(Cys)之间存在1 个二硫键。
前期实验室发现当腌制过程中温差较大时,或在低温贮藏过程中皮蛋蛋白会出现返色现象,这说明温度对皮蛋蛋白色泽具有重大影响。且在前期研究中,实验构建了由蛋清和NaOH组成的模型,发现美拉德反应抑制剂的添加可以抑制模型色泽的形成;并基于此模型对禽蛋蛋清和脱糖蛋清进行碱诱导处理,发现蛋清在脱糖前后的色泽存在显著差异。基于以上研究结果,认为皮蛋蛋白色泽主要是由强碱诱导的美拉德反应导致,此推测与皮蛋色泽相关的报道一致[5-7]。由于卵白蛋白是蛋清中含量最多的蛋白质,且前期实验室对蛋清凝胶的研究表明卵白蛋白对强碱诱导的蛋清凝胶的形成具有很大的贡献作用[8]。基于此,认为卵白蛋白在皮蛋腌制过程中对皮蛋蛋白色泽的形成也可能起很大作用,为了探讨皮蛋蛋白色泽是否主要由卵白蛋白在碱作用下与糖发生美拉德反应造成,通过构建卵白蛋白-葡萄糖的体外模型探讨温度对其色泽等的影响。蛋清除了含有大量蛋白质,还含有一定量还原糖,其还原糖质量分数为0.4%[9]。蛋清中卵白蛋白-还原糖质量比大致为15∶1,因此本实验构建的模型中卵白蛋白-葡萄糖质量比为15∶1。
美拉德反应,又称非酶褐变反应,是指在食品热处理或储存过程中含羰基化合物(如还原糖)与含氨基化合物(如氨基酸、肽、蛋白质等)通过缩合、聚合而生成类黑精的反应[10]。在美拉德反应期间会产生很多不同种类的早期、中间及晚期产物,它们统称为美拉德反应产物(Maillard reaction products,MRPs)。美拉德反应受许多因素影响,如温度、pH值、水分活度、反应物的类型及反应时间等[11]。许多研究表明MRPs具有抗氧化活性,其展现抗氧化活性的机制包括破坏自由基链、螯合过渡金属,分解过氧化氢和清除活性氧等[10,12]。因此本研究测定卵白蛋白-葡萄糖体系在碱作用后的抗氧化活性,以期开发一种应用在食品工业中的天然抗氧化剂。
几十年来,对美拉德反应的研究都集中在热诱导和微波诱导,而对碱诱导美拉德反应的研究甚少。本实验将卵白蛋白-葡萄糖混合液与2 g/100 mL NaOH溶液混合后放置在不同温度(4、25、37 ℃)孵育不同时间(1、3、5、7 d)。由于皮蛋的低温贮藏温度为4 ℃,腌制温度为25 ℃,且蛋清蛋白在过高的温度下会发生热变性,因此选择4、25、37 ℃作为考察温度。通过颜色、褐变强度、荧光强度和pH值等的变化评估体系理化特性的变化,通过还原力,2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除活性及Fe2+螯合活性评估体系抗氧化活性的变化。本研究将对皮蛋蛋白色泽形成规律有更深入的了解,丰富美拉德反应的理论体系,且有助于开发一种应用在食品工业中的天然抗氧化剂。
1 材料与方法
1.1 材料与试剂
卵白蛋白、ABTS 美国Sigma公司;葡萄糖、氢氧化钠(均为分析纯) 国药集团化学试剂有限公司;溴化钾(光谱纯) 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
色差仪 美国亨特工程公司;Nicolet iS5傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 赛默飞世尔科技公司;垂直电泳仪 美国伯乐公司;氨基酸自动分析仪 日本日立有限公司;多功能酶标仪 美谷分子仪器(上海)有限公司;UV-5200PC紫外-可见光分光光度计 元析仪器(上海)有限公司;970CRT荧光分光光度计 上海精密仪器仪表有限公司。
1.3 方法
1.3.1 反应液的制备
将卵白蛋白与葡萄糖用超纯水配制成蛋白质量浓度6 g/100 mL、糖质量浓度0.4 g/100 mL的混合溶液。将混合溶液与质量浓度2 g/100 mL NaOH溶液以2∶1的比例混合,迅速搅拌均匀后放置在不同温度(4、25、37 ℃)孵育不同时间(1、3、5、7 d)。卵白蛋白-葡萄糖混合液用作对照。
1.3.2 颜色的测定
使用色差仪测定在不同温度孵育的卵白蛋白-葡萄糖体系随孵育时间的颜色变化。在测定前用白板和黑板对色差仪进行校正。取反应后的样品液于比色皿中进行颜色的测定。色差仪可以提供3 个颜色参数:L*(亮度参数,其值0~100表示从黑色到白色,值越高越白)、a*(红绿参数,其值-100~100表示从绿色到红色,正值表示红色,负值表示绿色)、b*(黄蓝参数,其值-100~100表示从蓝色到黄色,正值表示黄色,负值表示蓝色)[13]。
1.3.3 紫外吸光度的测定
参考Tan Ji’en等[14]的方法略作修改,将样品液稀释25 倍后,用紫外-可见光分光光度计测定稀释液在294 nm波长处的吸光度。
1.3.4 褐变程度的测定
参考Tan Ji’en等[14]的方法略作修改,取1.5 mL样品液于石英比色皿中,用紫外-可见光分光光度计测定样品液在420 nm波长处的吸光度。
1.3.5 荧光强度的测定
参考Tan Ji’en等[14]的方法略作修改,将样品液稀释25 倍后,用荧光分光光度计测定稀释液在激发波长为347 nm,发射波长为415 nm处的荧光强度。
1.3.6 pH值的测定
使用前对pH计进行校正,用校正好的pH计测定样品液的pH值。
1.3.7 FTIR分析
参考Sheng Long等[15]的方法略作修改,测定卵白蛋白-葡萄糖体系的FTIR。将不同反应时间的卵白蛋白-葡萄糖体系混合液在-80 ℃冷冻完全,然后在真空冷冻干燥机中冷冻干燥。将干燥好的样品与KBr以质量比1∶100混合,充分研磨后用压片机压成厚度小于0.5 mm的透明薄片。用FTIR对薄片进行扫描(分辨率4.0 cm-1、扫描次数32、波数范围4 000~400 cm-1)。用OMNIC 6.0数据收集软件对收集的原始谱图做进一步分析。
1.3.8 氨基酸分析
参考Zhong Lei等[16]的方法略作修改,对卵白蛋白-葡萄糖体系的氨基酸含量进行分析。在冻干的粉末中加入6 mol/L HCl溶液,于110 ℃的水解炉中水解22 h。取出水解样品,冷却至室温后,将水解液过滤至50 mL容量瓶中,用超纯水定容。取1.0 mL滤液至15 mL试管中,用试管浓缩仪在40~50 ℃的加热环境下减压干燥,干燥后残留物用1~2 mL超纯水溶解,再减压干燥,最后蒸干。往干燥后试管中加入1~2 mL柠檬酸钠缓冲溶液(pH 2.2)溶解残留物,振荡混匀后用0.22 μm的滤膜过滤溶液,而后用自动氨基酸分析仪进行分析。
1.3.9 抗氧化活性的测定
1.3.9.1 抗氧化活性成分的制备
将在不同温度孵育不同时间的卵白蛋白-葡萄糖溶液于-80 ℃冷冻完全后进行冷冻干燥,将干燥后的样品置于干燥器中进行保存以进行抗氧化活性的测定。
1.3.9.2 还原力的测定
参考Tan Ji’en等[14]的方法并略作修改。取1.0 mL 8 mg/mL样品液,加入1.0 mL磷酸缓冲液(0.2 mol/L、pH 6.6)和1.0 mL铁氰化钾溶液(质量浓度1 g/100 mL)。而后把上述反应液于50 ℃的水浴锅中水浴20 min,取出冷却至室温后,加入1.0 mL 10 g/100 mL三氯乙酸溶液,混匀后3 000 r/min离心10 min。取1.0 mL上清液加入1.0 mL蒸馏水和200 μL氯化铁溶液,混匀后用酶标仪测定其在700 nm波长处的吸光度。
1.3.9.3 ABTS阳离子自由基清除活性的测定
ABTS阳离子自由基的制备:将7 mmol/L ABTS储备溶液和2.45 mmol/L过硫酸钾溶液混合,在室温下于黑暗中放置16 h[17]。取1.0 mL 0.2 mg/mL的样品液,加入1.0 mL ABTS阳离子自由基工作液,混匀后于黑暗中放置6 min,而后用酶标仪测定其在734 nm波长处的吸光度。样品ABTS阳离子自由基清除活性计算公式如下:

式中:As为样品在734 nm波长处的吸光度;A0为空白在734 nm波长处的吸光度(即样品液被超纯水取代)。
1.3.9.4 Fe2+螯合活性的测定
参考Tan Ji’en等[14]的方法略作修改。将1.0 mL 2 mg/mL样品液与1.85 mL超纯水混合,而后加入0.05 mL 0.2 mol/L FeCl2溶液,于室温放置30 s后,即刻加入0.1 mL 5 mmol/L菲啰嗪溶液。混匀后于室温放置10 min,而后3 000 r/min离心5 min,最后用酶标仪测定其在562 nm波长处的吸光度。用超纯水代替样品溶液作为空白。样品的Fe2+螯合活性计算公式如下:
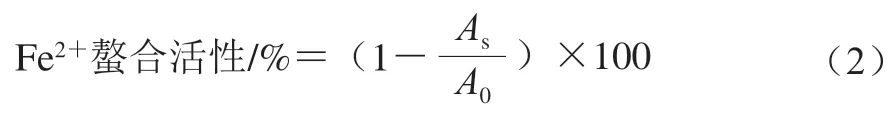
式中:As为样品溶液的吸光度;A0为空白的吸光度。
1.4 数据统计与分析
2 结果与分析
2.1 碱作用下卵白蛋白-葡萄糖体系颜色变化
食物颜色反映的是与原料相关的有色天然产物或加工过程中产生的有色化合物[18]。卵白蛋白-葡萄糖体系在不同温度孵育不同时间的颜色变化见图1a。在4 ℃孵育时,卵白蛋白-葡萄糖体系的颜色没有出现明显变化;在25 ℃孵育时,其颜色随着孵育时间延长而逐渐加深;在37 ℃孵育时,其颜色在3 d内迅速加深,而后随着孵育时间延长其颜色逐渐由黄色转变成棕色。卵白蛋白-葡萄糖体系颜色的变化初步表明卵白蛋白与葡萄糖在碱作用下可能发生了美拉德反应。

图1 不同温度孵育的卵白蛋白-葡萄糖体系颜色随着孵育时间的变化Fig. 1 Changes in color of ovalbumin-glucose system incubated at different temperatures for different periods
图1b~d展示了卵白蛋白-葡萄糖体系在不同温度孵育不同时间的颜色参数变化。在4 ℃和25 ℃孵育时,卵白蛋白-葡萄糖体系的L*值在孵育5 d内随孵育时间的延长而逐渐下降(P<0.05),当孵育7 d又轻微上升(P<0.05);而在37 ℃孵育时,其L*值在孵育3 d内逐渐下降(P<0.05),然后随着孵育时间的继续延长而逐渐上升(P<0.05)。L*值下降可能是由于棕色色素的形成所致[13],这与前面的颜色变化结果相对应。在不同温度孵育的卵白蛋白-葡萄糖体系的a*值均为负值,这表明体系反映出更多绿色特征。在4 ℃孵育时,体系的b*值随着孵育时间延长而轻微下降;在25 ℃和37 ℃孵育时,在整个孵育期间其b*值呈先上升后下降的趋势。且在3 个不同温度下体系的b*值均为负值,表明体系在整个孵育期间都展示出黄色特征。这3 个颜色参数在孵育期间的变化可能是由于卵白蛋白与葡萄糖在孵育期间发生了美拉德反应,从而生成了各种各样的中间和最终产物所致[19]。
2.2 碱作用下卵白蛋白-葡萄糖体系紫外吸光度的变化
美拉德反应过程中形成的中间产物通常在294 nm波长处有最大吸收峰[20]。不同温度孵育的卵白蛋白-葡萄糖体系在294 nm吸光度随孵育时间的变化如图2所示。与未加碱的卵白蛋白-葡萄糖混合物相比,卵白蛋白-葡萄糖体系在4 ℃孵育时,其在294 nm波长处的吸光度随着孵育时间延长而不断上升(P<0.05);在25 ℃孵育时,其在294 nm波长处的吸光度在前5 d内随着孵育时间延长而逐渐上升(P<0.05),到第7天时趋于平稳(P>0.05);在37 ℃孵育时,其在294 nm波长处吸光度在整个孵育期间呈现先上升后下降(P<0.05)的变化趋势,在第5天达到最大值。在294 nm波长处吸光度的增加表明卵白蛋白-葡萄糖体系在孵育过程中形成了美拉德反应中间产物。先前的研究表明,随着反应时间的延长,一些美拉德反应中间产物会进一步发生聚合反应生成棕色物质,从而导致中间产物含量的减少[21-22]。这可能就是卵白蛋白-葡萄糖体系在37 ℃孵育后期其在294 nm波长处吸光度下降的原因。孵育温度越高,卵白蛋白-葡萄糖体系在294 nm波长处的吸光度也越高,这可能是因为在不同温度下美拉德反应的反应速率不同,在更高温度下,中间产物的形成速率更快。这与Jin Wengang等[20]对扇贝性腺水解产物-核糖体系的研究观察到的结果一致,发现其在294 nm波长处吸光度随反应温度升高而升高。
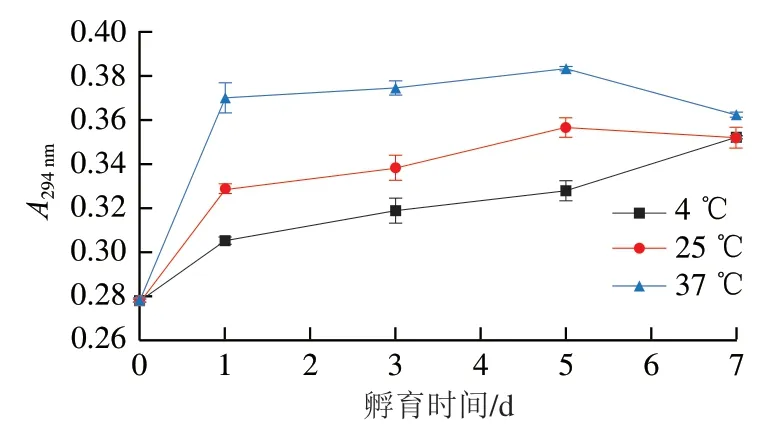
图2 不同温度孵育的卵白蛋白-葡萄糖体系在294 nm波长处吸光度随着孵育时间的变化Fig. 2 Changes in absorbance at 294 nm of ovalbumin-glucose system incubated at different temperatures for different periods
2.3 碱作用下卵白蛋白-葡萄糖体系褐变程度变化
美拉德反应的后期阶段非常复杂,在这个阶段会产生各种各样的含氮或不含氮的棕色聚合物,这些聚合物在420 nm波长处有最大吸收峰,因此可用420 nm波长处的吸光度指示棕色聚合物的生成[23]。如图3所示,在3 个不同温度下孵育的卵白蛋白-葡萄糖体系在420 nm波长处吸光度均随孵育时间延长而呈上升趋势(P<0.05),只是在4 ℃孵育时,其吸光度只是轻微上升,而在25 ℃和37 ℃孵育时,其上升趋势更为显著。且孵育温度越高,体系在420 nm波长处吸光度越大。与卵白蛋白-葡萄糖混合物在420 nm波长处吸光度相比,孵育后卵白蛋白-葡萄糖体系在420 nm波长处吸光度的增加说明孵育期间卵白蛋白与葡萄糖发生了美拉德反应,生成了棕色聚合物。孵育温度更高,体系在420 nm波长处的吸光度越高是因为温度越高,美拉德反应速率越快,导致生成更多的棕色聚合物。这结果与体系在294 nm波长处吸光度结果一致,都是孵育温度越高,体系吸光度也相对越高。

图3 不同温度孵育的卵白蛋白-葡萄糖体系在420 nm波长处吸光度随着孵育时间的变化Fig. 3 Changes in absorbance at 420 nm of ovalbumin-glucose system incubated at different temperatures for different periods
2.4 碱作用下卵白蛋白-葡萄糖体系荧光强度的变化
在美拉德反应中间阶段除生成具有紫外吸收的物质,还生成具有荧光吸收的物质,这些具有荧光吸收的物质通常被认为是棕色化合物的前体[24]。具有荧光吸收的中间产物与具有紫外吸收的中间产物并不相同,它们具有不同的动力学,具有荧光吸收的中间产物相对来说更具有反应性,更容易转变为棕色聚合物[25]。如图4所示,在3 个不同孵育温度下,卵白蛋白-葡萄糖体系的荧光强度都随孵育时间延长而不断增加(P<0.05)。但是与其在294 nm和420 nm波长处吸光度不同的是,在37 ℃孵育的卵白蛋白-葡萄糖体系荧光强度是3 个温度中最低的,最高在25 ℃,其次在4 ℃。荧光强度的增加表明卵白蛋白与葡萄糖在孵育期间发生了美拉德反应,生成了具有荧光吸收的物质。而在37 ℃孵育的卵白蛋白-葡萄糖体系的荧光强度最低可能是因为美拉德反应在高温下具有更高的反应速率,导致在37 ℃条件下生成的荧光物质更快地转变成了棕色化合物。在37 ℃孵育卵白蛋白-葡萄糖体系的荧光强度最低,而其在294 nm波长处吸光度却最高,这可能是因为具有荧光吸收的中间产物比具有紫外吸收的中间产物更具反应性所致。

图4 不同温度孵育的卵白蛋白-葡萄糖体系荧光强度随着孵育时间的变化Fig. 4 Changes in fluorescence intensity of ovalbumin-glucose system incubated at different temperatures for different periods
2.5 碱作用下卵白蛋白-葡萄糖体系pH值变化
在不同温度孵育的卵白蛋白-葡萄糖体系的pH值随着孵育时间的变化见图5。第0天为对照组即卵白蛋白-葡萄糖混合物的pH值,加入2 g/100 mL NaOH溶液后,体系的pH值迅速上升(P<0.05),而后随着孵育时间的继续延长,在不同温度孵育的卵白蛋白-葡萄糖体系的pH值都呈现逐渐下降的趋势(P<0.05),且在更高的孵育温度下,其pH值下降得更迅速。与结果相似的是,有研究者发现卵白蛋白-葡萄糖体系在微波条件下处理时,其pH值也是随着处理时间的延长而呈现出逐渐下降的趋势[26]。在孵育过程中体系pH值的下降可能是由于卵白蛋白与葡萄糖在孵育过程中发生了美拉德反应,生成了一些酸性物质所致。有研究者在发生美拉德反应后的体系中发现了酸性物质(如甲酸、乙酸、甲基乙二醛、乙二醛)的存在,这些酸性物质的存在会降低体系的pH值[20,24]。且当葡萄糖与卵白蛋白反应时,会消耗卵白蛋白中的氨基酸,这也会降低体系的pH值。而在更高孵育温度下体系的pH值更低是因为美拉德反应在更高温度下具有更高的反应速率,因此会生成更多的酸性物质,同时也会消耗更多的氨基酸,从而使体系的pH值下降得更快。这与在294 nm以及420 nm波长处的吸光度结果一致,在更高温度下体系在294 nm和420 nm波长处的吸光度越高,说明在更高温度下产生了更多的中间和最终产物,而在更高温度下pH值下降越快是因为产生了更多的酸性物质。
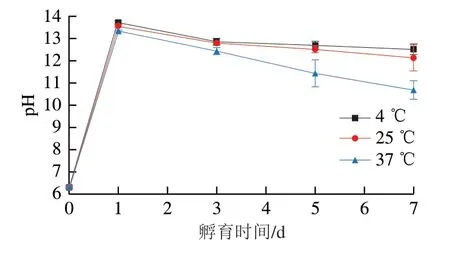
图5 不同温度孵育的卵白蛋白-葡萄糖体系pH值随着孵育时间的变化Fig. 5 Changes in pH of ovalbumin-glucose system incubated at different temperatures for different periods
2.6 碱作用下卵白蛋白-葡萄糖体系FTIR光谱的变化
蛋白质在红外区域有几个特征吸收带,其中酰胺I带(1 700~1 600 cm-1)和II带(1 600~1 500 cm-1)是研究蛋白质二级结构最具价值的吸收带[27]。当蛋白质发生反应后,其分子水平上的官能团会发生修饰,这在红外光谱上表现为新条带的出现或旧条带的消失,以及峰强度和位置的变化。
图6展示了卵白蛋白以及在不同温度孵育不同时间的卵白蛋白-葡萄糖体系的红外图谱。在3 个不同温度孵育的卵白蛋白-葡萄糖体系在1 655 cm-1和1 540 cm-1两处吸收峰的强度都比卵白蛋白在此两处的吸收峰强度更低,且随着孵育时间的延长,其强度呈不断下降的趋势。这表明酰胺I带和II带发生了修饰,可能是因为在孵育过程中卵白蛋白与葡萄糖发生了美拉德反应,消耗了卵白蛋白的氨基所致。Su Junfeng等[28]研究得到相似的结果,实验发现在羧甲基纤维素和大豆蛋白发生美拉德反应期间,酰胺I带和II带处的吸收峰强度随着反应时间的延长而逐渐下降。除了酰胺I带和II带峰强度的下降,在1 453 cm-1和1 239 cm-1两处的峰强度也在孵育后呈现逐渐下降的趋势,进一步说明卵白蛋白与葡萄糖在孵育期间发生了美拉德反应。且卵白蛋白-葡萄糖体系孵育后,在884 cm-1处出现了一个新的吸收峰,这个新吸收峰可能是由于卵白蛋白与葡萄糖在碱作用下生成的MRPs(如Amadori化合物、席夫碱或吡嗪)引起的。Liu Qian等[29]报道形成MRPs(Amadori化合物、席夫碱和吡嗪)的键在1 800~800 cm-1处具有吸收峰。其他一些学者也观察到相似的现象,即反应体系发生美拉德反应后会在红外图谱中出现新的吸收峰[15-16]。FTIR表明不同温度下孵育的卵白蛋白-葡萄糖体系发生了美拉德反应,葡萄糖成功与卵白蛋白缀合。

图6 不同温度孵育的卵白蛋白-葡萄糖体系FTIRFig. 6 FTIR spectra of ovalbumin-glucose system incubated at different temperatures for different periods
2.7 氨基酸分析
如表1所示,与卵白蛋白的总氨基酸含量相比,在不同温度孵育后的卵白蛋白-葡萄糖体系的总氨基酸含量都呈现出明显的下降趋势,这可能是由于孵育期间卵白蛋白的氨基与葡萄糖的羰基发生了美拉德反应,消耗了一部分卵白蛋白中的氨基酸所致[30]。除了总氨基酸含量在孵育后呈下降外,各种氨基酸含量在孵育后也呈现出下降趋势。与其他氨基酸相比,丝氨酸(Ser)、组氨酸(His)和Cys展现出较明显的下降趋势,在孵育后分别下降约50%、70%和100%。这表明3种氨基酸的反应性高,是卵白蛋白与葡萄糖在碱处理下发生美拉德反应的主要氨基酸。尤其是Cys,在孵育后其含量下降到0%左右,说明它基本都参与了美拉德反应,与葡萄糖形成了共轭物,因此其含量下降很快,这也说明Cys的反应性比其他氨基酸都高,是碱处理下卵白蛋白与葡萄糖发生美拉德反应的主要结合位点[31]。这与Zhong Lei等[16]研究的结果相似,他们发现在燕麦蛋白分离物与平菇β-葡聚糖混合孵育后Cys的含量下降最多。Chen Zhangyi等[8]发现在碱处理过程中,蛋清中的巯基含量随着处理时间的延长不断上升,而二硫键含量随着处理时间的延长不断下降,这说明碱会破坏蛋清中的二硫键而使巯基暴露出来。因此当卵白蛋白-葡萄糖体系在碱处理过程中,卵白蛋白第73位和第120位的Cys之间存在的二硫键可能会被碱破坏,从而使Cys暴露出来,使其更易与葡萄糖发生反应,这可能就是碱处理过程中卵白蛋白中Cys具有最高反应性的原因。
在更高温度下,体系氨基酸含量下降得更加迅速。这与颜色、紫外吸光度、褐变程度等的结果相似,都是在更高温度下显示出更显著的变化。这进一步说明温度越高,美拉德反应的反应性越高,因此在更高温度下卵白蛋白中的氨基酸与葡萄糖发生反应的速率越快,导致其氨基酸含量下降得更快。

表1 卵白蛋白及不同温度孵育的卵白蛋白-葡萄糖体系的氨基酸含量Table 1 Amino acid contents of ovalbumin and ovalbumin-glucose system incubated at different temperatures for different periods%
2.8 抗氧化活性
2.8.1 还原力
如图7所示,与卵白蛋白-葡萄糖混合物还原力相比,在不同温度孵育后,卵白蛋白-葡萄糖体系的还原力都有了很大的提升(P<0.05)。但随着孵育时间的进一步延长,不同温度孵育的卵白蛋白-葡萄糖体系还原力都呈逐渐下降趋势(P<0.05)。孵育温度越高,卵白蛋白-葡萄糖体系还原力也相对较高,而且其随孵育时间的延长下降得也越快。与本实验结果相似的是,有研究者发现卵白蛋白与葡萄糖在120 ℃湿热处理20 min后,其还原力也有了显著的提升[32]。卵白蛋白-葡萄糖体系在孵育后其还原力显著上升可能是由于卵白蛋白与葡萄糖在孵育期间发生了美拉德反应,生成了中间产物还原酮等。Amarowicz[33]报道,还原酮等中间产物因其具有捐赠氢原子来打断自由基链的能力而展现出较高的还原力。当美拉德反应从中间阶段进入后期阶段时,在中间阶段形成的中间产物还原酮等会进一步反应生成复杂的最终产物,从而失去还原力[33]。这可能就是卵白蛋白-葡萄糖体系还原力在孵育时间进一步延长后而不断下降的原因。
根据Arrhenius原理,温度升高会提高分子的动能和碰撞速率,从而使反应速率增加[34]。因此在更高的孵育温度下,卵白蛋白与葡萄糖发生美拉德反应的速率更快,从而能生成更多的还原酮等具有还原力的中间产物,这就是卵白蛋白-葡萄糖体系在更高温度下具有更高还原力的原因。至于在更高孵育温度下其还原力下降得更快,也是因为在更高温度下前期生成的还原酮等中间产物转变成最终产物的速率更快,从而使其还原力下降得更快。
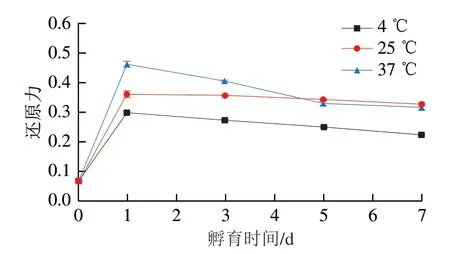
图7 不同温度孵育的卵白蛋白-葡萄糖体系还原力随孵育时间的变化Fig. 7 Changes in reducing power of ovalbumin-glucose system incubated at different temperatures for different periods
2.8.2 ABTS阳离子自由基清除活性
如图8所示,与卵白蛋白-葡萄糖混合物相比,在不同温度孵育的卵白蛋白-葡萄糖体系的ABTS阳离子自由基清除活性均在孵育1 d后显著增加(P<0.05)。而后在4 ℃和25 ℃孵育时,随着孵育时间的进一步延长,其ABTS阳离子自由基清除活性未出现明显变化(P>0.05);在37 ℃孵育时,其ABTS阳离子自由基清除活性随着孵育时间的进一步延长而出现轻微下降(P<0.05)。与本实验结果相似,有研究者发现卵白蛋白与葡萄糖在120 ℃湿热处理20 min后,其ABTS阳离子自由基清除活性也有了显著提升[32]。有学者报道有些美拉德反应中间产物和最终产物可以作为氢原子供体,从而展现出ABTS阳离子自由基清除活性[35-36]。因此孵育后卵白蛋白-葡萄糖体系的ABTS阳离子自由基清除活性增加可能是因为卵白蛋白与葡萄糖在孵育期间发生了美拉德反应,生成了可以作为氢供体的中间产物和最终产物。当美拉德反应从中间阶段进入最终阶段时,中间产物会进一步反应生成最终产物,从而可能失去其ABTS阳离子自由基清除活性[33]。在3 个温度下,只有在37 ℃孵育的卵白蛋白-葡萄糖体系的ABTS阳离子自由基清除活性下降是因为美拉德反应在更高的温度下反应速率更快,因此可能在37 ℃时具有ABTS阳离子自由基清除活性的中间产物有一部分已转化为最终产物,而在4 ℃和25 ℃时具有ABTS阳离子自由基清除活性的中间产物还没有转化为最终产物。而体系还原力与ABTS阳离子自由基清除活性随孵育时间的变化趋势不同可能是因为在不同的测定方法中起作用的物质不同。这说明MRPs的抗氧化活性很复杂。

图8 不同温度孵育的卵白蛋白-葡萄糖体系ABTS阳离子自由基清除活性随孵育时间的变化Fig. 8 Changes in ABTS radical cation scavenging activity of ovalbumin-glucose system incubated at different temperatures for different periods
2.8.3 Fe2+螯合活性
由图9可知,卵白蛋白-葡萄糖混合物的Fe2+螯合活性只有1.8%左右,当其在碱作用下在不同温度下孵育1 d后,其Fe2+螯合活性有显著提高(P<0.05)。在4 ℃孵育时,随着孵育时间的进一步延长其Fe2+螯合活性变化不大,只有在孵育7 d后才出现轻微下降(P<0.05)。然而在25 ℃和37 ℃孵育时,其Fe2+螯合活性随着孵育时间的进一步延长呈不断下降的趋势(P<0.05)。有研究者报道MRPs是有效的金属螯合剂,因为它们中的羟基和吡咯基团具有螯合金属的作用[37-38]。卵白蛋白-葡萄糖体系在孵育后其Fe2+螯合活性显著提高可能是因为在孵育过程中卵白蛋白与葡萄糖发生美拉德反应生成了具有羟基和吡咯基团的MRPs。而随着孵育时间的延长其Fe2+螯合活性出现轻微下降可能是因为某些具有Fe2+螯合活性的MRPs随着美拉德反应的继续进行进一步发生了反应,生成了更加复杂的MRPs,而失去了Fe2+螯合活性。至于在更高温度下Fe2+螯合活性下降得更快的原因如前所述,是因为美拉德反应在更高温度下的速率更快,因此更多具有Fe2+螯合活性的产物进一步反应生成更复杂的物质而失去抗氧化活性。

图9 不同温度孵育的卵白蛋白-葡萄糖体系Fe2+螯合活性随孵育时间的变化Fig. 9 Changes in Fe2+-chelating activity of ovalbumin-glucose system incubated at different temperatures for different periods
3 结 论
考察温度对碱处理下卵白蛋白-葡萄糖体系颜色、物化特性及抗氧化活性的影响。孵育温度越高,卵白蛋白-葡萄糖体系的颜色、紫外吸收、褐变程度以及荧光强度等指标展现出更显著的变化。FTIR表明,碱作用下,卵白蛋白与葡萄糖发生了美拉德反应,氨基酸分析表明两者发生美拉德反应的主要结合位点为Ser、His和Cys,最主要的结合位点为Cys。孵育后的卵白蛋白-葡萄糖体系的抗氧化活性与卵白蛋白葡萄糖混合相比有显著提升,但随孵育时间的延长有轻微的下降。总之,温度对碱处理下卵白蛋白-葡萄糖体系颜色、物化性质及其抗氧化活性具有显著影响,卵白蛋白可能在皮蛋腌制过程中对皮蛋蛋白颜色的形成起很大的作用。

