鱼鳞明胶对鱼糜肌原纤维蛋白的冷冻保护作用及其机制
朱士臣,俞杰航,金 燕,丁玉庭,周绪霞,*,杨 青,位正鹏,王金梅
(1.浙江工业大学食品科学与工程学院,浙江省深蓝渔业资源高效开发利用重点实验室,国家远洋水产品加工技术研发分中心(杭州),浙江 杭州 310014;2.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;3.泰祥集团-荣成泰祥食品股份有限公司,农业农村部冷冻调理海洋食品加工重点实验室,山东 荣成 264300)
鱼糜制品营养丰富且质构特性独特,深受广大消费者喜爱。冷冻可以抑制因微生物和内源酶作用引发的鱼糜腐败变质,是目前稳定鱼糜品质、延长货架期的主要手段。但由于冷冻贮藏过程中温度的波动性,导致冰晶重结晶现象严重,冰晶的力学效应会破坏鱼糜组织细胞,诱发蛋白质聚集、降解、氧化以及脂质氧化等系列生化反应[1-2],从而进一步降低鱼糜制品的质构特性和营养价值。
添加抗冻剂是控制鱼糜冷冻变性的有效手段之一。目前应用最为普遍的抗冻剂为蔗糖、多元醇或多聚磷酸盐及其复配物,尽管此类抗冻剂抗冻效果较好,但存在一定的健康风险。如蔗糖等糖类会带入高热量及甜味而导致肥胖、龋齿等,且不适于糖尿病患者食用;多聚磷酸盐的摄入存在加重高血压或慢性肾病等风险[3-4]。近年来,广大学者开发了几种具有较高安全性的食品用抗冻剂,如多糖类胶体及抗冻蛋白和抗冻肽等[4-6]。多糖的胶凝特性能够使冰晶的融化-生长过程局限于其三维网络结构中,从而抑制冰重结晶[7]。抗冻蛋白的抗冻特性与其聚脯氨酸II型结构(PPII结构)亲水基团与疏水基团相隔分布的构象特点密切相关[8];抗冻多肽Gly-X-Y的序列排布也是其发挥抗冻特性的关键结构特征。尽管上述新型抗冻剂表现出一定的冷冻保护效果,但由于其抗冻能力或制备条件的局限性,限制了它们的广泛应用。
作为胶原部分变性的产物,明胶在保留部分PPII结构的同时,还包括分子质量分布广泛的多肽组分。明胶小分子多肽链(<10 kDa)由Gly-Pro-X单元序列重复组合而成,与抗冻多肽的重复序列Gly-X-Y非常类似,已被证实具有较强的抗冰晶形成能力[9]。明胶的成凝胶性是其另一重要的结构特征,是由一定较大分子质量的多肽组分在一定理化条件下自组装形成的具有三维网络结构凝胶体的过程。明胶上述结构或组分均赋予了其抑制冰晶形成或生长能力,这为明胶作为一种新型蛋白抗冻剂提供一定的分子结构基础。
本课题组前期的研究结果表明,酶法制备明胶具有较强的抗冻潜力[10-11]。本研究将酶型鱼鳞明胶加入到鱼糜中,探究鱼鳞明胶对鱼糜在冻融过程中的冷冻保护作用,旨在为食品级绿色安全、健康高效新型冷冻保护剂的开发提供借鉴。
1 材料与方法
1.1 材料与试剂
鱼鳞、黑鱼 杭州朝晖六区农贸市场。
胃蛋白酶(1∶3 000) 上海蓝季科技发展有限公司;Ca2+-ATP酶活性测定试剂盒 江苏省南京建成科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
HH-6数显恒温水浴锅 上海力辰邦西仪器科技有限公司;LGJ-12D真空冷冻干燥机 北京四环起航科技有限公司;BECKMAN A高速冷冻台式离心机 美国贝克曼库尔特有限公司;IKA-T25高速分散均质机 德国IKA公司;XW-80A旋涡混合器 上海驰唐电子有限公司;UV-6100S紫外-可见分光光度仪 上海美普达仪器有限公司;MCR 52流变仪 奥地利安东帕(中国)有限公司;PHS-3E pH计 上海仪电科学仪器股份有限公司;TA-XT Plus质构仪 英国Stable Micro System公司;Gemini 500场发射扫描电子显微镜 德国Zeiss公司。
1.3 方法
1.3.1 明胶的制备
取洗净晒干的黑鱼鱼鳞,加入20 倍体积的0.1 mol/L NaOH溶液在30 ℃恒温水浴中处理2 h,用清水彻底清洗处理后的鱼鳞,以除去鱼鳞中的杂蛋白,重复1 次上述步骤。加入20 倍体积的0.4 mol/L HCl溶液在30 ℃恒温水浴中脱钙处理1 h,用清水反复清洗鱼鳞,重复1 次上述步骤。加入10 倍体积的纯水,同时添加2 g/100 mL胃蛋白酶,调节pH值至2.0,置于37 ℃恒温水浴中处理4 h,然后在90 ℃水浴中灭酶处理10 min。反复清洗酶处理后的鱼鳞,加入10 倍体积的纯水,调节pH值至6.0左右,60 ℃恒温水浴提取5 h,用3~4 层纱布过滤,将滤液缓慢冷却至室温,冻干得到样品,将样品粉碎后置于阴凉处密封保存。
1.3.2 鱼糜的制备
新鲜黑鱼经过采肉、漂洗(清水漂洗2 次、0.1%盐水漂洗1 次)和脱水(控制水分质量分数在80%左右)处理后得到新鲜黑鱼鱼糜。
将新鲜鱼糜分为5 组:对照组(C);添加0.5%、1%、2%(m/m)明胶组(0.5G、1G、2G);添加商业抗冻剂组(4%(m/m)蔗糖+4%(m/m)山梨醇)(S)。将样品混合均匀后置于-18 ℃保存18 h,然后置于4 ℃解冻6 h为1 个冻融循环,定期取样测试。
1.3.3 肌原纤维蛋白提取
参考Gao Wenhong等[12]的方法并稍作修改。取2 g鱼糜,加入10 倍体积冷却(4 ℃)的Tris-马来酸缓冲液(50 mmol/L KCl+20 mmol/L Tris-马来酸,pH 7.0),于10 000 r/min匀浆,每匀浆20 s冰浴20 s,重复3 次。匀浆液4 ℃、10 000×g离心10 min,弃去上清液。在沉淀中加入10 倍体积冷却(4 ℃)的Tris-马来酸缓冲液(0.6 mol/L KCl+20 mmol/L Tris-马来酸,pH 7.0),重复上述匀浆操作,匀浆液于4 ℃静置提取1 h,在4 ℃、10 000×g离心10 min,得到上清液,即为肌原纤维蛋白溶液。
1.3.4 蛋白溶解度测定
参考Kittiphattanabawon等[13]的方法并稍作修改。取1.5 g鱼糜,加入10 倍体积冷却(4 ℃)的Tris-马来酸缓冲液(50 mmol/L KCl+20 mmol/L Tris-马来酸,pH 7.0),10 000 r/min匀浆,每匀浆20 s冰浴20 s,重复3 次。匀浆液4 ℃、10 000×g离心10 min,弃去上清液。在沉淀中加入10 倍体积冷却(4 ℃)的Tris-马来酸缓冲液(0.6 mol/L KCl+20 mmol/L Tris-马来酸,pH 7.0),重复上述匀浆操作,匀浆液于4 ℃静置提取1 h,4 ℃、10 000×g离心10 min,得到上清液,准确量取上清液体积,用双缩脲法测定上清液中蛋白浓度。按式(1)计算蛋白溶解度:

1.3.5 总巯基含量测定
参考Benjakul等[14]的方法并稍作修改。将肌原纤维蛋白溶液稀释至4 mg/mL。取0.5 mL稀释液,加入4.5 mL 0.2 mol/L Tris-HCl缓冲液(含8 mol/L尿素、2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、10 mmol/L乙二胺四乙酸,pH 6.8),充分振荡混匀后取4 mL混匀液。加入0.4 mL 0.1% 5,5’-二硫代双(2-硝基苯甲酸)溶液(含0.2 mol/L Tris-HCl,pH 8.0),40 ℃下孵育25 min,测定412 nm波长处的吸光度。以0.6 mol/L KCl溶液(pH 7.0)作为空白对照,以13 600 L/(mol·cm)的摩尔消光系数计算总巯基含量。
1.3.6 Ca2+-ATP酶活性测定
采用试剂盒测定Ca2+-ATP酶活性。肌原纤维蛋白的Ca2+-ATP酶活性以单位时间内单位蛋白中Ca2+-ATP酶分解三磷酸腺苷产生无机磷的量表示,单位为μmol/(mg·h)。
1.3.7 羰基含量测定
参考Lin Jun等[15]的方法并稍作修改。将肌原纤维蛋白溶液稀释至2 mg/mL。取1 mL稀释液加入1 mL 10 mmol/L二硝基苯肼溶液(含2 mmol/L HCl溶液)中,充分混匀,置于暗处反应1 h。加入1 mL 20%三氯乙酸溶液终止反应,在4 ℃、14 000 r/min离心5 min,收集沉淀。用1 mL乙醇-乙酸乙酯(1∶1,V/V)溶液洗涤沉淀3 次,除去游离的二硝基苯肼。沉淀中加入3 mL 6 mol/L盐酸胍溶液,混匀,37 ℃下孵育15 min。反应得到的溶液以14 000 r/min离心5 min除去不溶物。在370 nm波长处测定上清液的吸光度,羰基含量以nmol/mg表示(蛋白质量计),摩尔消光系数为22 000 L/(mol·cm)。
1.3.8 表面疏水性测定
参考Chelh等[16]的方法并稍作修改。用20 mmol/L磷酸盐缓冲液(pH 6.0)将肌原纤维蛋白溶液稀释至2 mg/mL。取2 mL稀释液,加入80 μL 1 mg/mL溴酚蓝溶液(去离子水溶解),混合均匀,暗处静置10 min,以4 000×g离心15 min。将上清液稀释10 倍后,测定595 nm波长处的吸光度。肌原纤维蛋白溶液的表面疏水性以溴酚蓝质量表示。按式(2)计算溴酚蓝质量:
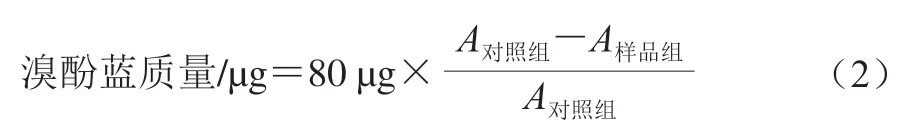
1.3.9 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)
对经过8 次冻融循环的样品中肌原纤维蛋白进行SDS-PAGE分析。将5 mg/mL样品与SDS上样缓冲液以1∶4(V/V)混合,沸水浴5 min。采用12%分离胶和5%浓缩胶,样品上样量为15 μL,以浓缩胶80 V、分离胶120 V的恒定电压进行电泳。电泳结束后,凝胶用考马斯亮蓝R250染液染色30 min,然后用脱色液(甲醇-冰醋酸水溶液)脱色。
1.3.10 鱼糜动态流变特性测定
采用配备75 mm平行钢板的MCR 52流变仪测定升温过程中鱼糜样品的储能模量(G’)变化。取适量鱼糜样品置于流变仪平台上,平板周围涂上一层甲基硅油防止水分蒸发。测试条件为:平板间隙1 mm;应变2%;频率0.1 Hz;升温扫描范围20~90 ℃;升温速率3 ℃/min。
1.3.11 鱼糜凝胶制备
将解冻的鱼糜样品与2% NaCl溶液(m/m)均匀混合,擂溃5 min。将擂溃后的鱼糜灌入肠衣(直径20 mm),排气扎紧。采用两段式加热:首先将鱼肠置于40 ℃恒温水浴30 min,再置于90 ℃恒温水浴20 min制成鱼糜凝胶。置于冷水中冷却,并于4 ℃冰箱贮存用于后续指标分析测试。
1.3.12 鱼糜凝胶强度测定
将制备的鱼糜凝胶切成圆柱体(Φ20 mm×15 mm),在室温下平衡30 min,采用TA-XT Plus质构仪测定鱼糜凝胶的凝胶强度。使用P/5S球形探头,以1 mm/s的恒定速率穿刺10 mm,记录破断力和破断距离,按下式计算鱼糜凝胶的凝胶强度:

1.3.13 鱼糜凝胶持水性测定
参考Ogawa等[17]的方法并稍作修改。将鱼糜切成小块,50 mL离心管中垫入滤纸,准确称量离心管和滤纸的质量记为m0,再称取5 g左右切碎的鱼糜样品放置在滤纸中,准确称质量为m1,在4 ℃、10 000 r/min离心15 min。离心完毕后,准确称量离心后的鱼糜质量为m2。持水性按式(4)计算:

1.3.14 鱼糜凝胶微观结构
将鱼糜凝胶切成2 mm左右的薄片,用pH 7.2 2.5%戊二醛溶液在4 ℃固定12 h,再用pH 7.2 0.1 mol/L磷酸盐缓冲液漂洗3 次,每次15 min。然后依次用35%、50%、70%、85%、90%乙醇溶液漂洗脱水,每次15 min,再用无水乙醇脱水两次,每次15 min。处理好的样品经过冷冻干燥和喷金处理后使用扫描电子显微镜放大100 倍观察鱼糜凝胶的微观结构。
1.3.15 差示扫描量热测定
按照1.3.3节的方法提取肌原纤维蛋白,将鱼糜质量1%的明胶添加到肌原纤维蛋白中,在4 ℃条件下通过磁力搅拌充分混匀,然后按照1.3.2节的条件进行3 次冻融循环处理。将样品冻干后采用差示扫描量热分析明胶与肌原纤维蛋白的相互作用,参数如下:扫描范围为20~100 ℃,升温速率为20 ℃/min,全程在20 mL/min的N2环境下进行,记录升温曲线。
1.4 数据处理
采用Excel 2016进行数据整理计算,采用SPSS 22软件进行数据分析,用Duncan法进行差异显著性分析(P<0.05,差异显著),利用Origin 2017软件进行绘图。
2 结果与分析
2.1 明胶对冻融循环过程中肌原纤维蛋白的影响
2.1.1 肌原纤维蛋白溶解度分析
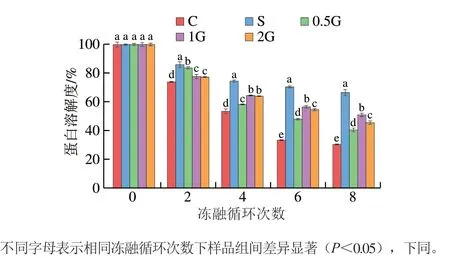
图1 明胶添加量对不同冻融循环处理的鱼糜肌原纤维蛋白溶解度的影响Fig. 1 Effect of gelatin on the solubility of myofibril protein subjected to different freeze-thaw cycles
肌原纤维蛋白溶解度变化是反映蛋白质结构转变的重要指标,可反映蛋白质的变性程度。由图1可知,随着冻融循环次数的增加,鱼糜肌原纤维蛋白溶解度总体呈现下降趋势。其中,对照组肌原纤维蛋白溶解度下降最为显著;经过8 次冻融循环后,对照组和添加0.5%、1%、2%明胶实验组以及商业抗冻剂组的蛋白溶解度分别下降至未冻融初始值的30.2%、40.4%、50.8%、45.5%和66.4%。结果表明,明胶的添加可在一定程度上减少冻融过程中肌原纤维蛋白的结构变化。在冻融过程中,肌原纤维蛋白在冰晶破坏作用和冷冻诱导的变性作用等多重作用下蛋白结构发生变化,导致疏水相互作用、氢键、二硫键以及离子相互作用形成,从而使其溶解度降低[17-18]。明胶富含亲水性氨基酸,亲水性氨基酸残基侧链与蛋白质表面水分子相互作用,稳定了蛋白质结构;同时,明胶自身的成凝胶性降低了水分迁移及冰晶形成能力,从而抑制了冷冻诱导的蛋白变性[19]。但明胶组的蛋白质溶解度仍低于商业抗冻剂组,有必要在未来的研究中对明胶进一步修饰改性,以进一步增强明胶的抗冻能力。
2.1.2 总巯基含量分析
由图2可知,在冻融处理过程中,对照组的总巯基含量下降最显著,而添加商业抗冻剂组和不同比例明胶的实验组的总巯基含量下降相对缓慢。经8 次冻融循环处理后,添加0.5%、1%、2%明胶实验组和商业抗冻剂组的总巯基含量显著高于对照组,分别比初始值降低了22.4%、17.4%、21.8%、12.3%和28.3%。

图2 明胶添加量对不同冻融循环处理的鱼糜肌原纤维蛋白总巯基含量的影响Fig. 2 Effect of gelatin on the sulfydryl content of myofibril protein subjected to different freeze-thaw cycles
巯基是肌原纤维蛋白中最为活跃的反应性基团之一,在长期的冻藏和冻融过程中,蛋白质结构发生变化导致埋藏在蛋白质内部的巯基暴露在表面,半胱氨酸的巯基发生氧化或二硫键的交换转化为二硫键[15,19]。在冻融过程中,冰晶的反复形成导致蛋白质结构发生变化,蛋白质分子内部的巯基暴露在活性氧中,被氧化形成二硫键。明胶的添加能够通过水约束效应在一定程度上抑制冰晶的破坏作用,同时稳定蛋白质结构,从而抑制冻融过程中巯基转化为二硫键。
2.1.3 表面疏水性分析
肌原纤维蛋白的表面疏水性通常与蛋白质溶解度的下降呈负相关[15]。如图3所示,对照组、添加商业抗冻剂组和不同比例明胶的实验组在冻融循环过程中表面疏水性总体呈现上升趋势,但在整个冻融过程中对照组表面疏水性始终高于其他组别。冻融8 个循环后,对照组和添加0.5%、1%、2%明胶实验组和商业抗冻剂组的表面疏水性分别比各自初始值增加了100.6%、88.1%、57.9%、86.3%和58.5%。

图3 明胶添加量对不同冻融循环处理的鱼糜肌原纤维蛋白表面疏水性的影响Fig. 3 Effect of gelatin on the surface hydrophobicity of myofibril protein subjected to different freeze-thaw cycles
肌原纤维蛋白表面疏水性的增加表明肌原纤维蛋白的展开和非极性氨基酸的增加,冻融过程中诱导蛋白质肽链展开变性导致蛋白质构型发生转变,埋藏在分子内部的疏水性氨基酸残基逐渐暴露于蛋白质表面并发生氧化,从而导致肌原纤维蛋白表面疏水性的增加[20-21]。明胶的添加可以抑制水分子的迁移,延缓冻融过程中冰晶对蛋白质表面水分子保护层的破坏,从而减少蛋白质的展开并保护疏水性氨基酸不被暴露于蛋白质表面[22];此外,明胶中丰富的亲水性氨基酸残基与蛋白质表面的亲水基团相互作用,从而稳定蛋白质结构限制蛋白质肽链的展开,并降低蛋白质之间利用分子间疏水作用导致的蛋白质聚集[23]。
2.1.4 Ca2+-ATP酶活性分析
肌球蛋白球状头部具有Ca2+-ATP酶活性,Ca2+-ATP酶活性可以反映冻融过程中肌原纤维蛋白完整性[24]。如图4所示,在8 次冻融循环过程中,所有组别的Ca2+-ATP酶活性总体呈下降趋势,但不同处理组间肌球蛋白的变性程度有所差异。其中,冻融8 个循环后,对照组的Ca2+-ATP酶活性损失最大,达到了49.4%。而添加0.5%、1%、2%明胶实验组和商业抗冻剂组的Ca2+-ATP酶活性分别损失了42.8%、31.2%、40.1%和18.0%。因此,明胶的添加能够较为有效地保持冻融过程中肌球蛋白的完整性。

图4 明胶添加量对不同冻融循环处理的鱼糜肌原纤维蛋白Ca2+-ATP酶活性的影响Fig. 4 Effect of gelatin on the Ca2+-ATPase activity of myofibril protein subjected to different freeze-thaw cycles
冷冻或冻融过程中,Ca2+-ATP酶活性的丧失主要与肌球蛋白球状头部的构象变化及聚集有关。此外,冻融过程中蛋白质间相互作用的蛋白质重排以及体系离子强度的增强会使Ca2+-ATP酶活性丧失[25]。Ca2+-ATP酶活性与肌球蛋白头部的巯基密切相关,肌球蛋白球状头部活性位点上反应性巯基的氧化可能导致该区域Ca2+-ATP酶活性的降低[26],这一结果与上述肌原纤维蛋白总巯基含量的变化一致。明胶的添加可以延缓鱼糜肌球蛋白Ca2+-ATP酶活性的丧失,可能是通过明胶中大量的亲水性氨基酸稳定蛋白质周围的水合水分子从而维持肌球蛋白的完整性和Ca2+-ATP酶的活性。
2.1.5 羰基含量分析
在冷冻或冻融过程中,一些氨基酸(如赖氨酸、脯氨酸、组氨酸和精氨酸)被氧化形成羰基化合物[27]。由图5可知,在冻融初期鱼糜肌原纤维蛋白羰基含量基本保持不变,随着冻融循环次数的增加,蛋白质羰基含量整体呈明显上升趋势。冻融8 次循环后,对照组、添加0.5%、1%、2%明胶实验组和商业抗冻剂组的羰基含量分别增加了2.77、1.97、0.69、0.85 nmol/mg和1.32 nmol/mg;其中,1%的明胶处理组抑制肌原纤维蛋白的氧化能力显著高于商业抗冻剂组和对照组。

图5 明胶添加量对不同冻融循环处理的鱼糜肌原纤维蛋白羰基含量的影响Fig. 5 Effect of gelatin on the carbonyl content of myofibril protein subjected to different freeze-thaw cycles
冻融过程中,大量细胞内外冰晶的形成会对细胞结构造成破坏,使得各促氧化剂得到释放,进一步促进了蛋白质氧化[28]。明胶的添加可能通过控制冰晶的生成,抑制其对细胞结构的破坏,从而延缓促氧化剂对蛋白质氧化的作用。
2.1.6 SDS-PAGE分析
由图6可知,SDS-PAGE上肌原纤维蛋白的成分主要包括肌球蛋白重链(myosin heavy chain,MHC,约220 kDa)、肌动蛋白链(约45 kDa)和原肌球蛋白链(tropomyosin,TM,约37 kDa);此外还有一些颜色较浅的条带,如100~135 kDa范围内的副肌球蛋白链,是典型的肌原纤维蛋白条带分布[29-30]。与新鲜鱼糜肌原纤维蛋白相比,冻融8 次后鱼糜肌原纤维蛋白条带具有明显差异,主要表现在MHC条带的减弱和副肌球蛋白条带的增强。表明冻融处理导致鱼糜肌原纤维蛋白中MHC发生一定程度的降解,鱼糜在冻藏过程中主要是肌球蛋白发生了变性。而对比冻融8 次后的各组样品可以观察到对照组MHC条带含量最低,发生降解程度较大。结果与蛋白溶解度、总巯基含量以及Ca2+-ATP活性等一致,表明一定量明胶的添加可以有效抑制肌球蛋白含量的下降,减缓冻融期间蛋白质的降解。
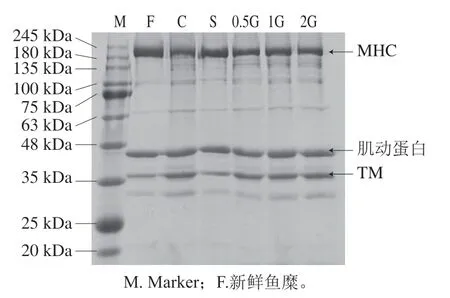
图6 冻融处理后鱼糜肌原纤维蛋白的SDS-PAGE图谱Fig. 6 SDS-PAGE patterns of myofibril protein subjected to freeze-thaw treatment
2.2 明胶对冻融循环过程中鱼糜动态流变学特性的影响


图7 不同温度扫描下鱼糜凝胶的G’Fig. 7 G’ of surimi gels as a function of temperature
图7显示了鱼糜中G’的温度依赖性。同一温度下,随着冻融循环次数的增加,所有样品的G’总体呈上升趋势,表明经过一定程度的冻融循环鱼糜样品的弹性有所增加,鱼糜变得更硬。这可能是由于冷冻过程中肌原纤维蛋白容易发生变性,表面疏水性增加,蛋白质分子间通过二硫键和离子键等相互作用发生交联聚集[31-32],导致鱼糜变硬。此外,反复冻融导致鱼糜机械结构的破坏造成水分大量流失,也可能是鱼糜变硬的原因之一。其中,对照组鱼糜样品的G’变化最大,经过8 次冻融循环后对照组样品G′较初始值上升93.7%(80 ℃),而添加0.5%、1%、2%明胶实验组和商业抗冻剂组分别增长65.1%、64.1%、67.6%和41.6%。因此,明胶的添加能够有效延缓鱼糜硬化。明胶具有抑制冰晶形成和稳定蛋白质结构的能力,从而能在一定程度上延迟蛋白质变性和分子间交联。
2.3 明胶对冻融循环过程中鱼糜凝胶特性的影响
2.3.1 凝胶强度分析
在长期冷冻贮藏或冻融过程中,鱼类蛋白质很容易受到冷冻诱导变性的影响,进而降低凝胶形成能力[33]。冻融过程中鱼糜凝胶的相对凝胶强度能够反映鱼糜凝胶的形成能力。由图8可知,随着冻融循环次数的增加,鱼糜凝胶的凝胶强度整体呈下降趋势,冻融循环显著降低了鱼糜凝胶的形成能力。冻融循环8 次后,添加0.5%、1%、2%明胶的实验组和商业抗冻剂组的凝胶强度分别为未冻融处理组凝胶强度的77.8%、82.1%、81.3%和80.86%;而对照组的凝胶强度最低,为67.0%。

图8 冻融循环过程中明胶对鱼糜凝胶强度的影响(n=3)Fig. 8 Effect of gelatin on surimi gel strength during freeze-thaw cycles (n = 3)
明胶的添加有效抑制了鱼糜蛋白凝胶形成能力的下降,这得益于明胶中的大量亲水性氨基酸等活性成分与蛋白质外层相互作用,抵抗冻融过程对鱼糜蛋白结构的破坏,延缓鱼糜蛋白冷冻变性。此外,明胶蛋白与鱼糜蛋白的相互作用、蛋白质与内在水分的相互作用等也可能对鱼糜凝胶的形成和结构稳定起到了积极作用[15]。此前也有研究表明,肌球蛋白的完整性与鱼糜肌球蛋白凝胶化有着密切的联系[14],而肌球蛋白球状头部的Ca2+-ATP酶活性又是反映肌球蛋白完整性的主要指标。在本研究中,鱼糜凝胶强度随冻融循环变化的下降趋势与Ca2+-ATP酶活性的变化一致。
2.3.2 凝胶持水性分析
鱼糜凝胶持水性的下降表明鱼糜凝胶结构中水的稳定性降低和流动性增加[34],因此鱼糜凝胶的持水性可以反映凝胶结构的强弱及其稳定性。如图9所示,在未冻融的新鲜鱼糜中,添加明胶实验组鱼糜凝胶的持水性高于对照组和商业抗冻剂组,明胶具有丰富的亲水基团,可以将鱼糜凝胶中的游离水转化为结合水,从而提高鱼糜凝胶的持水性[35]。在整个冻融过程中除了商业抗冻剂组,其余处理组鱼糜凝胶持水性都呈现下降趋势;经过8 次冻融循环后,对照组鱼糜凝胶持水性显著下降(P<0.05),而添加1%、2%明胶实验组和商业抗冻组在整个冻融过程中持水性变化差异不显著(P>0.05)。结果与鱼糜凝胶强度的变化趋势一致。

图9 冻融循环过程中明胶对鱼糜凝胶持水性的影响(n=3)Fig. 9 Effect of gelatin on the WHC of surimi gel during freeze-thaw cycles (n = 3)
2.3.3 鱼糜凝胶微观结构分析

图10 冻融循环过程中明胶对鱼糜凝胶微观结构的影响Fig. 10 Effect of gelatin on the microstructure of surimi gel during freeze-thaw cycles
如图10所示,新鲜未冻融鱼糜凝胶表面呈现光滑致密的结构,随着冻融次数的增加,鱼糜凝胶表面变得粗糙,凝胶孔隙逐渐增大,蛋白聚集形成团簇。这可能是由于冻融处理导致蛋白质变性,严重影响其凝胶形成能力。相比于对照组凝胶样品,8 次冻融后添加商业抗冻剂和明胶的组别凝胶孔隙分布较为均匀,蛋白质聚集程度相对较小,反映了冻融处理对其凝胶形成能力的影响较小。通过对凝胶微观结构的观察进一步直观反映了明胶对鱼糜在冻融过程中的低温保护作用。
2.4 差示扫描量热分析
由图11可知,未冻融处理前,与对照组相比,添加明胶组的肌原纤维蛋白的峰值温度从47.9 ℃增加至58.3 ℃,表明明胶与肌原纤维蛋白间存在一定的非共价相互作用[36]。经3 次冻融循环后,对照组与明胶组的肌原纤维蛋白变性温度均增大,这可能是由于冻融过程中巯基含量增加,表面疏水性增强,蛋白质氧化修饰导致肌原纤维蛋白发生一定程度的交联[37]。明胶组肌原纤维蛋白热变性峰值温度均明显高于对照组,表明明胶与肌原纤维蛋白之间的相互作用增强。杨玉玲等[38]的研究结果表明,疏水相互作用可能是维持高温条件下明胶与肌原纤维蛋白的主要作用力。这一结果与鱼糜凝胶微观结构的结果一致。
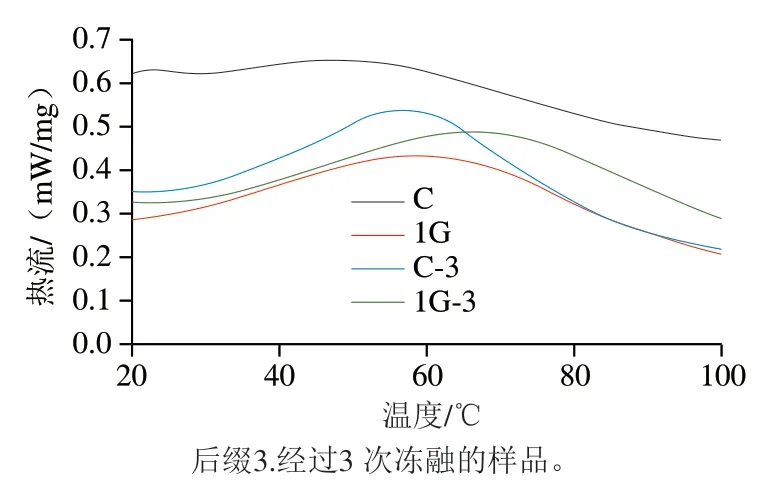
图11 明胶-肌原纤维蛋白复合物的差示扫描量热曲线Fig. 11 Differential scanning calorimetry curves of gelatin-myofibrillar protein complex
3 结 论
鱼鳞明胶的添加能够有效抑制冻融期间鱼糜肌原纤维蛋白的氧化和变性,8 次冻融后,鱼糜肌原纤维蛋白溶解度、总巯基含量和Ca2+-ATP酶活性显著高于对照组(P<0.05),具有较低的表面疏水性和羰基含量,其动态流变学特性、凝胶强度和持水性均优于对照组;其中,添加1%明胶鱼糜实验组在抑制蛋白质氧化、凝胶强度与持水性方面均优于商业抗冻剂组,但明胶对鱼糜的整体冷冻保护能力仍不及商业抗冻剂组。因此,未来的研究应聚焦于明胶的修饰改性以进一步提高其抗冻能力。

