苦参碱衍生物ZS10基于PI3K/AKT信号通路诱导人肝癌细胞BEL-7402凋亡
王 湘,张 森,韩科研,曾攀科,李雪娇,王立升
(广西大学医学院,广西 南宁 530004)
原发性肝癌是人类消化系统最常见的癌症之一, 在我国为高发癌症,具有恶性程度高、复发率高、转移率高的特点[1]。临床治疗多采用手术、放疗、化疗以及免疫疗法。虽然随着酪氨酸激酶抑制剂的出现,患者的存活率得到了很大改善,但仍然伴有新的问题,如耐药性问题等[2-3]。因此,研发能够有效地抑制肝癌细胞增殖和转移的新型化学药物,克服其耐药性,具有重大意义。
AKT是一种在人类癌症中通常被激活的丝氨酸/苏氨酸激酶,被认为与细胞增殖、转移、凋亡和癌变有关[4],PI3K/AKT信号通路通过调节多种与细胞相关的通路,在肿瘤发生中发挥重要作用[5]。AKT激活后,能够转移至细胞核和细胞质,同时激活细胞增殖、转移、周期、凋亡相关靶点,这些机制不是孤立的,可能在肿瘤发生过程中共存。因此,PI3K/AKT可能是肝癌治疗的关键部位。
苦参碱(Matrine,Fig 1)是豆科植物苦参(SophoraflavescensAit.)、苦豆子(S.alopecuroidesL.)等中草药活性成分的单体提取物,其化学式为C15H24N2O,具有喹诺里西啶结构。已经上市的复方苦参注射液作为一种抗癌药物,可与其它抗癌药物联合治疗肝癌和非小细胞肺癌[3,6-8]。临床研究表明,将标准疗法与苦参碱联合使用,癌症患者的生活质量和免疫功能得到了极大的改善[9-10]。由于苦参碱具有良好的溶解性、安全性和柔韧性结构,已被认为是一种理想的先导化合物[11]。苦参碱衍生物ZS10(Fig 1),具有较好的体外抗肿瘤活性。本文报道了ZS10的合成,以及ZS10对BEL-7402细胞增殖,周期和凋亡的影响,基于PI3K/AKT通路对相关蛋白进行了初步研究,为ZS10进一步开发成为临床药物奠定了基础。

Fig 1 The structural formula of matrine and its derivative ZS10
1 材料
1.1 细胞株人肝癌细胞BEL-7402,人正常肝细胞LO2由广西中药药效研究重点实验室提供。
1.2 药品与试剂苦参碱为陕西昂盛生物医药公司产品;二氯甲醚、无水四氯化锡、1-氟萘均为萨恩化学技术(上海)有限公司产品;乙酸乙酯、石油醚、二氯甲烷均为广东汕头市西陇化工股份有限公司产品;氢化钠为国药集团化学试剂有限公司产品,四氢呋喃为成都市科龙化工试剂厂产品;RPMI 1640高糖培养液为美国赛默飞公司生产;胎牛血清为杭州四季青公司产品;四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)为美国默克公司产品;蛋白质定量试剂盒(BCA)试剂盒,LDH乳酸脱氢酶试剂盒为上海碧云天生物科技有限公司生产产品;凋亡抑制剂Z-VAD(OH)-FMK(Z-VAD-FMK)(HY-16658),丝裂霉素购于中国MedChemExpress公司;Cyclin D1、CDK2、EGFR、N-codherin、E-codherin、Vimentin、Bax、Bax、caspase-3、caspase-9为艾博抗(上海)贸易有限公司生产;4%细胞组织固定液(多聚甲醛)为北京索莱宝生物科技有限公司生产;碘化丙啶/核糖核酸酶染色缓冲液(PI/Rnase)细胞周期试剂盒为上海拜力生物科技有限公司生产;膜联蛋白-V/碘化丙啶(Annexin Ⅴ-FITC/PI)细胞凋亡试剂盒为上海拜力生物科技有限公司生产。
1.3 主要仪器高内涵细胞成像分析系统(美国PerkinElmer公司);高通量酶标仪筛选系统(美国PerkinElmer公司);高速离心机(湖南湘仪实验仪器开发有限公司;倒置显微镜(OLYMPU奥林巴斯公司);生物安全柜(Thermo);细胞计数仪(Bio-Rad公司);细胞培养箱(德国Binder 公司);Attune NxT流式细胞仪(Thermo Fisher Scientific)。
2 方法
2.1 化学合成将10 g(100 mmol)2,2,2-三氟乙醇和14.3 g(140 mmol)三乙胺溶于无水120 mL乙醚中。在室温下加入适量17.2 g(90 mmol)甲苯磺酰氯。搅拌混合物约48 h,直到甲苯磺酰氯完全反应。过滤,用30 mL×2乙醚洗涤滤饼。将滤液浓缩。用硅胶柱层析法,正己烷 ∶乙醚=9 ∶1为洗脱剂,得2,2,2-三氟乙基-4-甲基苯磺酸酯。
氮气保护,将34 g(236 mmol)1-萘酚、40 g(157 mmol)2,2,2-三氟乙基对甲苯磺酸酯、33 g(240 mmol)碳酸钾和80 mL二甲基亚砜的悬浮液,100 ℃加热搅拌12 h。冷却后,加入100 mL水和200 mL甲苯,分离出有机层。有机层用100 mL 5%氢氧化钠水溶液洗涤5次,再用100 mL水洗涤4次,浓缩得到36 g油状物质。在真空条件下蒸馏,得28 g 1-(2,2,2-三氟乙氧基)萘,产率76%。

Fig 2 Synthetic route of matrine derivative ZS10
在0 ℃、氮气保护条件下,7.47 g(65 mmol)1,1-二氯甲醚溶于30 mL二氯甲烷中,缓慢滴加16.94 g(65 mmol)无水四氯化锡,保持0 ℃反应1 h,溶液变为淡黄色,将7.458 g(32.5 mmol)1-(2,2,2-三氟乙氧基)萘溶于20 mL二氯甲烷并注入反应液中,然后反应液从冰浴条件下缓慢加热至室温,过夜搅拌,反应结束后加入100 mL冰水,分离出有机相,水洗多次,无水硫酸钠干燥,减压浓缩得8.86 g粗品,经快速硅胶柱层析纯化得8.83 g白色固体,即化合物4-(2,2,2-三氟乙氧基)-1-萘甲醛,产率93%。
于100 mL圆底烧瓶中分别加入2.8 g(116 mmol)氢化钠、50 mL无水四氢呋喃,搅拌均匀,加入1.24 g(5 mmol)苦参碱,回流,加入2.5 g(10 mmol)4-(2,2,2-三氟乙氧基)-1-萘甲醛,TLC检测反应至终点。冷却,用3N的盐酸调节反应液至中性。20 mL×3二氯甲烷萃取,合并有机相,无水硫酸钠干燥,抽滤、浓缩,得黄色油状物。经硅胶柱层析,V乙酸乙酯 ∶V石油醚=5 ∶4纯化得白色粉末固体,即14-[1-(4-三氟乙氧基)萘甲烯基]苦参碱,乙酸乙酯-甲醇重结晶得1.81 g白色粉末,产率44%。
2.2 细胞培养人体肝癌细胞系BEL-7402用RPMI 1640培养基外加10%胎牛血清(Gibco,CA,USA)和1%青霉素/链霉素双抗(Gibco,CA,USA)培养,细胞培养在37 ℃、5% CO2培养箱中。
2.3 MTT法检测ZS10对细胞增殖-毒性影响取对数生长期BEL-7402细胞,胰酶消化,种于96孔板(1×107·L-1),每孔加入100 μL培养基,37 ℃孵育24 h,贴壁。设置给ZS10实验组(有细胞+不同浓度的ZS10)、空白组(不含细胞,用于调零酶标仪)、阴性对照组(有细胞,无ZS10的培养基)、苦参碱对照组(有细胞+不同浓度苦参碱)、阳性药对照组(有细胞+不同浓度伊替立康),抑制剂对照组(有细胞+ZS10+Z-VAD-FMK)。设置药物组浓度均分别为:0、0.5、1、2、4、6、8、16、32、64 μmol·L-1,每个浓度设置3个复孔。分别培养24 h、48 h 和72 h。配制5 g·L-1的MTT溶液,每孔加10 μL MTT孵育4 h。弃上清液,每孔加200 μL二甲基亚砜,振荡10 min,酶标仪检测OD值,重复实验3次。
抑制率/%=[1-(实验组OD值-空白组OD值)/(阴性对照组OD值-空白组OD值)]×100%
取对数生长期LO2细胞,同上操作。
2.4 微板法检测BEL-7402细胞 LDH 释放率取对数生长期BEL-7402细胞,胰酶消化,种于96孔板(1×108L-1),孵育24 h后,贴壁,分别加入含浓度为1、2、4、6、8 μmol·L-1ZS10的无血清培养基,置于培养箱中培养48 h后,将细胞分为背景空白对照组、样品对照组、样品最大酶活性对照组、给药组,每组设5个复孔,收集细胞培养液,按照试剂盒说明书进行样本处理,在450 nm测定LDH吸光度值,进行计算。
2.5 DAPI染色取对数生长期BEL-7402细胞,胰酶消化,种于6孔板(1×108L-1),37 ℃孵育24 h,贴壁,分别加入含浓度为1、2、4、6、8 μmol·L-1ZS10的培养基,置于培养箱中培养48 h后,吸除培养基,PBS清洗1遍,使用多聚甲醛固定20 min,用PBS清洗2遍,加入DAPI溶液,染色10 min,PBS清洗2遍,采用高内涵细胞成像分析系统进行拍照分析。
2.6 划痕实验取对数生长期BEL-7402细胞,胰酶消化,种于6孔板上(5×108L-1)。37 ℃孵育24 h,贴壁。吸弃培养基,用不含胎牛血清的培养基饥饿细胞6 h,用0.5 mg·L-1丝裂霉素处理细胞3 h,用100 μL枪头均匀于6孔板背面划痕,宽度一致,PBS清洗3次,用不含胎牛血清的培养基稀释ZS10。稀释后的ZS10浓度为:0、1、2、4、6、8 μmol·L-1。给药后,采用荧光倒置显微镜在0 h,24 h、48 h拍照。
2.7 克隆形成实验取对数生长期BEL-7402细胞,胰酶消化,种于6孔板上(500 mL),24 h后弃去原培养液,分别加入浓度为1、2、4、6、8 μmol·L-1的ZS10培养基,置于培养箱中培养6 d后,终止培养,弃去培养基,磷酸缓冲液(PBS)清洗3次,4%多聚甲醛固定20 min后,结晶紫染色,PBS冲洗,室温风干,采用菌落计数分析系统拍照并计数。
2.8 流式细胞术检测细胞周期取对数生长期BEL-7402细胞,胰酶消化,种于6孔板上(5×108L-1)。37 ℃孵育24 h,贴壁。胰酶消化成细胞悬液,1 000 r·min-1离心5 min,尽可能吸尽上清液。PBS吹打洗涤细胞,1 000 r·min-1离心5 min弃上清液,重复2次后,70%乙醇固定,4 ℃放置12 h,1 000 r·min-1离心10 min后弃上清液,PBS清洗并离心2次,弃上清液后加入5 μL的碘化丙啶(PI)染液混匀,避光室温孵育30 min,采用流式细胞仪进行细胞周期分析。
2.9 流式细胞术检测细胞凋亡取对数生长期BEL-7402细胞,胰酶消化,种于6孔板上(5×108L-1)。37 ℃孵育24 h,贴壁。经1、2、4、6、8 μmol·L-1ZS10干预48 h后,胰酶消化,1 000 r·min-1离心5 min,收集细胞,弃上清液,加入195 μL染色缓冲液(binding buffer)重悬细胞,5 μL碘化丙啶(PI),混匀,孵育15 min,采用流式细胞仪进行细胞凋亡分析。
2.10 Western blot检测ZS10对BEL-7402细胞PI3K/AKT通路及相关蛋白表达水平的影响取对数生长期BEL-7402细胞,胰酶消化,种6孔板上(5×108L-1)。37 ℃孵育24 h,贴壁。胰酶消化,1 000 r·min-1离心5 min,弃上清液,加含1% 蛋白酶抑制剂的裂解液吹打,冰上放置30 min,4℃、12 000 r·min-1离心15 min,取上清液,用蛋白定量法测定蛋白含量。采用湿式转印法将蛋白转印到聚偏二氟乙烯膜(95 mA湿转150 min),封闭1 h,采用一抗4 ℃孵育过夜,二抗孵育1 h,充分洗膜后,显色,凝胶成像系统中成像,采用Image Lab软件对条带灰度值进行分析,每组重复检测3次,取平均值。
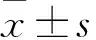
3 结果
3.1 ZS10化学合成在强碱氢化钠作用下,苦参碱与4-(2,2,2-三氟乙氧基)-1-萘甲醛在无水四氢呋喃溶液中回流,经缩合、脱水反应制得相应的目标化合物。
m.p.204.5-206.9 ℃;1H NMR (500 MHz, Chloroform-d) δ: 8.24(dd, J=7.4, 1.6 Hz,1H), 7.63(dd, J=7.3, 1.7 Hz,1H), 7.53(td, J=7.5, 1.6 Hz,1H), 7.48(td, J=7.4, 1.6 Hz,1H), 7.37(d, J=1.3 Hz,1H), 7.33(d, J=7.5 Hz,1H), 7.00(d, J=7.5 Hz,1H), 5.20~5.04(m,2H), 3.98 (dd, J=12.4, 6.6 Hz,1H), 3.07~2.90(m,4H), 2.19(dtd, J=14.3, 7.1, 1.1 Hz,1H), 2.15~2.03(m,3H), 1.87~1.78(m,1H), 1.72~1.61(m, 4H), 1.56~1.44 (m, 5H), 1.44~1.32(m,1H), 1.18~1.03(m,2H);13C NMR (125 MHz, Common NMR Chloroform-d) δ 172.97, 155.81, 133.98, 133.50, 132.48, 130.08, 129.09, 128.54, 126.80, 126.22, 125.40, 123.55, 109.15, 57.11, 57.04, 56.27, 47.17, 42.39, 35.84, 27.71, 25.84, 23.90, 23.58, 21.78, 21.37。
3.2 ZS10对BEL-7402细胞增殖能力的影响不同浓度ZS10干预24 h、48 h、72 h后,MTT法检测结果显示,与空白组比较,ZS10对BEL-7402细胞的增殖具有明显的抑制作用(P<0.05)。随着ZS10浓度逐渐增加,其对BEL-7402细胞抑制率也逐渐增加,呈剂量依赖性。MTT结果显示,ZS10作用于BEL-7402细胞24、48、72 h后,半数抑制浓度(IC50)分别为(17.02±2.25)、(6.62±1.11)、(5.72±0.8) μmol·L-1(Fig 3A),相比之下,苦参碱作用于BEL-7402细胞24、48、72 h后,半数抑制浓度均远大于100 μmol·L-1,见Fig 3C。ZS10药物浓度小于8 μmol·L-1时,与苦参碱相比,ZS10对人正常肝细胞无明显毒性,见Fig 3B。Z-VAD-FMK是一种泛caspase抑制剂,能够抑制caspase家族蛋白酶活性,同时阻断线粒体途径和死亡受体途径的凋亡。将抑制剂与ZS10联合使用作用于BEL-7402细胞,癌细胞活力明显升高,见Fig 3D。乳酸脱氢酶主要位于细胞质中,其存在于细胞外培养液中可用于检测细胞膜完整性的破坏。结果表明,不同浓度的ZS10作用于BEL-7402细胞48 h后,LDH释放呈剂量依赖性,见Fig 3E。

Fig 3 A: Effect of ZS10 on viability of BEL-7402 cells; B: Toxicity of ZS10 on human normal liver LO2 cells; C: Effect of matrine on viability of BEL-7402 cells; D: Effect of combination of ZS10 and Z-VAD-FMK on viability of BEL-7402 cells; E: Cytotoxicity detected by lactate dehydrogenase (LDH) assay (48 h) n=3).*P<0.05,**P<0.01 vs control group.
由此可得,对苦参碱14位的改造能够明显提升抗肿瘤活性,ZS10对BEL-7402细胞的增殖具有明显的抑制作用,能够诱导细胞凋亡。
根据上述结果,由于ZS10在48 h和72 h的IC50相差不大,药物浓度超过8 μmol·L-1时,对人正常肝细胞具有毒性,综合考虑,为确保ZS10对肝癌细胞增殖有抑制作用且对正常肝细胞无毒,ZS10给药时间选择48 h,药物浓度选择0、1、2、4、6、8 μmol·L-1进行后续实验。
3.3 ZS10对BEL-7402细胞的形态学变化的影响DAPI染色实验结果表明,ZS10干预BEL-7402细胞24 h后,随着ZS10浓度的增加,显示与凋亡相关的明显形态学改变,细胞核大小不一,核固缩,染色质凝聚成团,进一步导致死亡,见Fig 4。
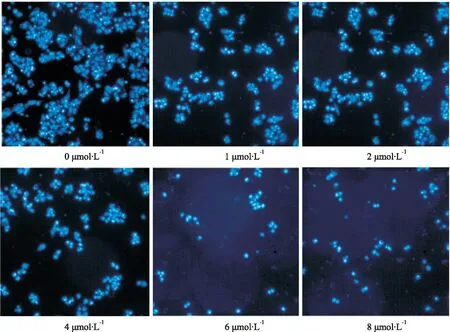
Fig 4 Effect of ZS10 on morphology of BEL-7402 cells(×40)
3.4 ZS10对肝癌细胞BEL-7402迁移能力的影响细胞划痕实验结果表明,ZS10能明显抑制BEL-7402细胞的迁移,呈现出浓度依赖性。与空白组相比,在24 h和48 h,各实验组BEL-7402细胞的迁移能力均明显下降。
Western blot实验结果表明,ZS10能明显下调N-cadherin、Vimentin和EGFR蛋白的表达,并同时明显上调E-cadherin蛋白的表达,且呈浓度依赖性,见Fig 5。
Fig 5 Effect of ZS10 on migration ability of BEL-7402 cells n=3)
3.5 ZS10对BEL-7402细胞克隆形成的影响克隆形成实验结果表明, 随着ZS10给药浓度的增加, BEL-7402细胞的集落形成数量逐渐减少,呈剂量依赖性。与空白组相比,各实验组BEL-7402细胞的集落形成数量均明显下降,见Fig 6。
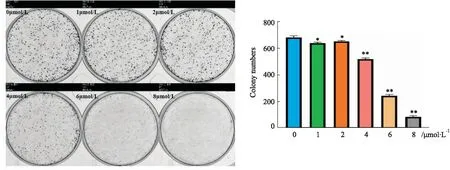
Fig 6 Colony formation of BEL-7402 cells inhibited by ZS10 ( n=3)**P<0.01 vs control group.
3.6 细胞周期实验经ZS10处理的BEL-7402细胞,与空白组相比,细胞周期S期比例明显增加,G2期明显下降。ZS10处理24 h后,随着ZS10的浓度逐渐增加,细胞周期发生明显变化,G0/G1期的细胞比例基本保持不变,S期的细胞比例从(37.27±1.54)%增加至(50.49±0.76)%,G2/M期细胞比例从(25.66±0.67)%减少至(12.1±0.55)%。
采用Western blot检测参与S期阻滞的调控因子,ZS10能明显抑制周期相关蛋白Cyclin D1和CDK2的表达,且呈现出浓度依赖性,见Fig 7。
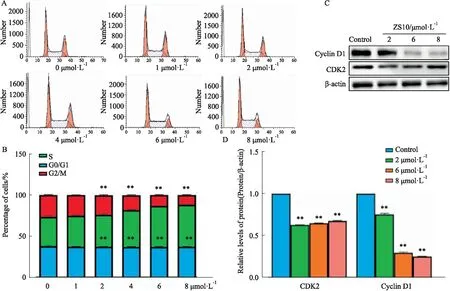
Fig 7 Effect of ZS10 on cell cycle distribution arrest of BEL-7402 cells ( n=3)
3.7 细胞凋亡实验分别取0、1、2、4、6、8 μmol·L-1ZS10给药48 h,BEL-7402细胞的凋亡率由(3.451±0.316)%明显增加至(50.16±2.1)%,处于早期凋亡的细胞比率明显增加为(17.1±1.4)%。根据实验结果显示,ZS10能够在BEL-7402细胞内诱发细胞凋亡,并且随着ZS10作用浓度的增加,细胞凋亡的比例也明显增加。
Western blot实验结果显示,与对照组相比,ZS10下调了BEL-7402细胞中PI3K、AKT、P-AKT,以及抗凋亡Bcl-2蛋白,上调了BEL-7402细胞中促凋亡蛋白Bax、caspase-3、caspase-9蛋白的表达(P值均<0.05),见Fig 8。
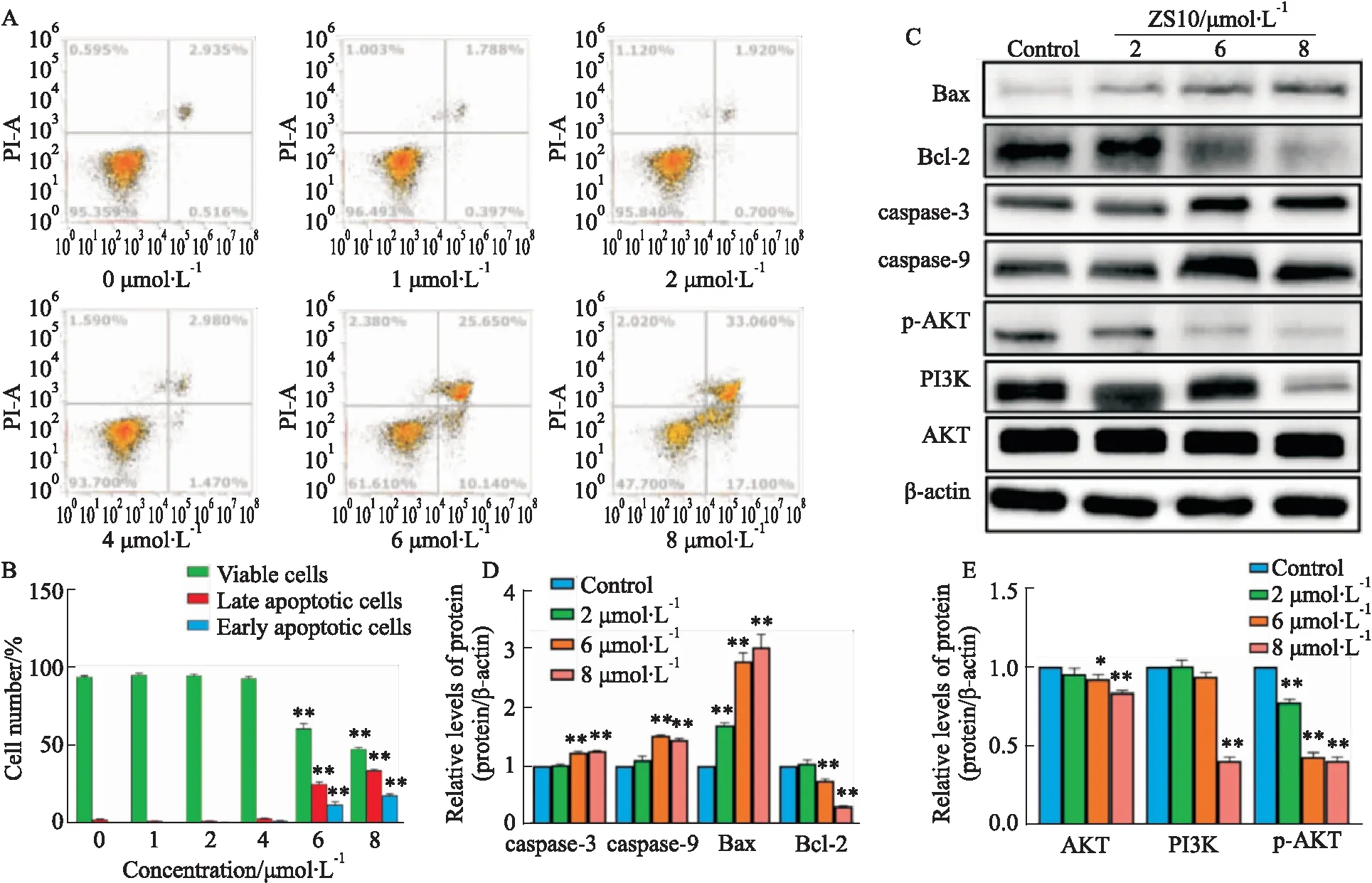
Fig 8 Effect of ZS10 on cell apoptosis of BEL-7402 cells n=3)
4 讨论
本实验室选用2,2,2-三氟乙醇和甲苯磺酰氯为起始原料,参考文献中的方法,成功合成了4-(2,2,2-三氟乙氧基)-1-萘甲醛,收率较高。进一步与苦参碱反应,得到苦参碱衍生物ZS10。最后一步反应需要在保证无水的条件下才有利于反应发生。另外,回流温度有利于提高收率。ZS10中含有三氟乙氧基,使化合物脂溶性大大增强。同时,经MTT实验验证,ZS10明显抑制BEL-7402细胞增殖,且对正常肝细胞无明显毒性。
肝癌死亡率高的主要原因是肝癌细胞的转移,细胞迁移能力可反映癌细胞在体内的转移能力。划痕实验是在体外考察细胞迁移运动能力最经典的实验之一,采用划痕实验考察了ZS10对BEL-7402细胞迁移能力的影响(Fig 5A),ZS10明显抑制BEL-7402细胞的迁移。采用Western blot实验考察ZS10对BEL-7402细胞上皮间质转化(epithelial-mes-enchymalt transition, EMT)过程的影响,研究结果表明,在肝癌患者中,上皮表型标志蛋白E-cadherin 低表达,而间质表型标志蛋白N-cadherin高表达,这与肝癌的预后效果不佳密切相关(Fig 5C),ZS10抑制PI3K、AKT、p-AKT、N-cadherin以及Vimentin的表达,且呈剂量依赖性,同时抑制EGFR的表达,并促进E-cadherin的表达,从而抑制细胞迁移。
细胞周期与细胞增殖密切相关,S期是细胞DNA合成的关键时期,S期阻滞可使细胞增殖周期延长,增殖速度减慢。实验结果显示,与空白组相比,ZS10使BEL-7402细胞周期S期明显增加,G2/M期细胞相应减少,诱导S期阻滞。因此,ZS10抑制BEL-7402细胞增殖的机制之一可能是延长细胞周期。在癌细胞增殖中,PI3K激活AKT信号通路,调控G1,G2细胞周期进展和Cyclin D1的表达,促进癌细胞生长[12]。细胞周期蛋白依赖性激酶(CDKs)与相应的细胞周期蛋白复合物参与细胞周期进展。Cyclin D1和CDK2作为细胞周期调节因子[13],Cyclin D1在多种肿瘤细胞中都呈现过度表达,是多种人类原发性肿瘤的特征之一,具有重要的参考意义。ZS10能够抑制AKT、p-AKT、Cyclin D1和CDK2表达,呈浓度依赖性下调,进而调节癌细胞周期,诱导BEL-7402细胞S期阻滞。
AKT的磷酸化可以调控Bax、Bcl-2蛋白表达,Bax和Bcl-2是细胞凋亡的主要调控蛋白之一[14],据报道,Bcl-2可自制细胞色素C释放到胞质中,并与其同源物一起维持线粒体膜的完整性[15],在细胞内二者通常以二聚体形式发挥作用[16],通过二者比值,可以判断细胞凋亡状态。比值升高导致线粒体外孔膜形成,细胞色素C释放进入胞质,和Apaf-1形成凋亡体,激活caspase-3和caspase-9,导致细胞死亡[17]。caspase蛋白酶家族在细胞凋亡中起到重要作用。其中caspase-3和caspase-9的激活与细胞凋亡密切相关。
实验结果表明,随着ZS10给药浓度的升高,PI3K、AKT、P-AKT以及抗凋亡蛋白Bcl-2表达均下调,促凋亡蛋白Bax表达上调,同时,其下游的caspase-3和caspase-9表达也上调,Bax/Bcl-2比值升高,说明PI3K/AKT通路在ZS10诱导细胞凋亡中发挥重要作用。
与未使用抑制剂的ZS10组对比,将Z-VAD-FMK与ZS10共同作用于BEL-7402细胞,细胞依旧存在增殖抑制现象,然而,ZS10浓度低于8μmol/L时,对人正常肝细胞未见明显毒性,推测原因可能是Z-VAD-FMK抑制了与caspase相关通路的BEL-7402细胞的凋亡,但是,ZS10可能同时作用于多条信号通路,诱导BEL-7402细胞凋亡。
在本研究中,合成了一种苦参碱衍生物ZS10,该化合物在体外明显抑制肝癌细胞的增殖(Fig 3~5),基于PI3K/AKT通路诱导BEL-7402细胞凋亡并阻滞S期,为该化合物进一步开发成治疗肝癌的药物提供了实验依据,但ZS10可能对多条信号通路具有明显作用,抑制BEL-7402细胞增殖,诱导细胞凋亡,这需要进一步的研究证实。

