黄芩苷通过TLR4/MyD88/NF-κB通路抑制链脲佐菌素诱导的阿尔茨海默病大鼠模型神经炎症反应
于文静,杨 苗,贺春香,金怡杰,李 泽,李 平,邓思思,成绍武,宋祯彦
(湖南中医药大学 中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208)
阿尔茨海默病(AD)是一种以进行性认知功能障碍、记忆功能减退、生活能力下降并伴有精神行为异常为主的神经退行性疾病。我国现有约1 000万痴呆患者,随着中国及全世界老龄化水平的增加,AD对全世界的经济负担将持续加重,据统计,到2030年将达到2.54万亿美元,到2050年将达到9.12万亿美元[1]。脑内的慢性炎症是AD的重要标志,小胶质细胞作为脑内重要的免疫细胞被活化及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)等促炎细胞因子被大量释放,使神经细胞凋亡或死亡,最终导致AD相关的行为[2]。TLR4大量表达于小胶质细胞上,通过髓样分化因子(myeloid differentiation factor 88,MyD88)衔接诱导核因子-κB(nuclear factor kappaB,NF-κB)磷酸化和促炎细胞因子产生[3]。
目前证据表明,传统的非甾体类抗炎药虽然能在一定程度上减轻炎症,延缓AD的进展,降低认知功能的损害,但是其胃肠道并发症等副作用限制了长期作为临床药物使用的可能性,副作用小、性能更安全的天然产品作为AD患者的临床长期用药是更好的选择,大量研究证明,天然产品对于缓解AD脑内神经炎症发挥着重要作用[4]。黄芩作为传统中药之一,有清热燥湿、泻火解毒之效,研究表明,黄芩及茎叶具有抗神经炎症、抗氧化应激、缓解兴奋性神经毒性及抑制神经细胞凋亡的作用,可能对AD的治疗有效。黄芩苷是从黄芩中提取出来的一种黄酮类化合物,已被证明具有抗炎和神经保护作用[5]。课题组前期研究表明,黄芩苷可以通过抑制TLR4/NF-κB信号通路减轻脂多糖/干扰素γ诱导的BV2细胞的炎症反应[6],但是,黄芩苷是否对动物模型有作用还尚不明确。本实验采用大鼠侧脑室注射STZ构建AD大鼠模型,从TLR4/MyD88/NF-κB信号通路探讨黄芩苷对AD大鼠脑内炎症反应的作用及神经保护机制。
1 材料
1.1 实验动物SPF级SD ♂大鼠50只,体质量(150±20)g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004,大鼠饲养在湖南中医药大学动物实验中心SPF级动物屏障系统中,分笼喂养(每笼3只),使用标准动物饲料和水喂养,恒温(25±2)℃,室内明暗周期设置为12 h一循环,实验过程均符合动物伦理学要求(LLBH202105100001)。
1.2 药物与试剂黄芩苷(110715,中国食品药品检定研究院);STZ、米诺环素、山羊抗兔二抗(S0130、H1928056、AP132P,美国Sigma-Aldrich);β-actin、IL-1β、IL-6、TNF-α引物由上海生工生物工程有限公司合成;TRIzol Reagent(15596018,美国Thermo Fisher Scientific);逆转录试剂盒(0521751,苏州近岸蛋白质科技股份有限公司);SYBR Green预混液(MQ00401,上海莫纳生物);NF-κB p65/RelA和phospho-NF-κB p65/RelA-s276抗体(A2547和AP0123,武汉ABclonal);β-actin(AF7018,中国Affinity Biosciences);TLR4抗体(D220102,生工生物工程(上海)股份有限公司);MyD88抗体(AH10163311,北京Bioss公司);Histone H3抗体(#4499,Cell Signaling Technology);Iba1抗体(011-27991,日本WAKO和光纯药株式会社);细胞核蛋白与细胞质蛋白抽提试剂盒和PMSF(100 mmol·L-1)(P0027和ST506,碧云天生物科技有限公司);RIPA蛋白裂解液(cw2333s,北京康为世纪生物科技有限公司);BCA试剂盒(A00445,杭州联科生物科技股份有限公司);TritonX-100和抗荧光衰减封片剂(含DAPI)(T8200和S2110,北京索莱宝);Donkey anti-Goat IgG(H+L) Highly Cross-Adsorbed Secondary Antibody、Alexa Fluor 647(A32849,美国Invitrogen);通用二步法检测试剂盒(小鼠/兔增强聚合物法检测系统)(PV-9000,北京中杉金桥)。
1.3 仪器石蜡切片机(Thermo Fisher,美国);AI+共聚焦激光显微镜(Nikon,日本);TissueFAXS Plus全景组织扫描成像系统(Tissue Gnostics GmbH,奥地利);SorvallTMLegendTMMicro 17R微量离心机(Thermo Fisher,美国);Cytation3型多功能酶标仪(Bio-Tek,美国);T100TMThermal Cycler型实时荧光定量聚合酶链式反应扩增仪、Mini-PROTEAN Tetra型电泳槽、Mini Trans-Blot型转印槽、Gel Doc XR+凝胶成像系统(Bio-Rad,美国)。
2 方法
2.1 STZ侧脑室注射构建AD大鼠模型将21.6 mg STZ溶于300 μL柠檬酸缓冲液中配置成72 μg·μL-1的注射液。SD大鼠禁食12 h后造模,麻醉给予3%戊巴比妥钠,大鼠头部固定于脑固定装置,以《大鼠脑立体定位图谱》的第六版作为参照,以前囟为基准,距离前囟向后0.8 mm;距颅骨正中线左右各1.5 mm;距颅骨表面进针3.7 mm,往除假手术组外大鼠双侧侧脑室各注5 μL STZ(2.4 mg·kg-1)[7],假手术组注射5 μL生理盐水,控制速度1 μL·min-1,结束后留针5 min。缓慢出针,伤口及时止血并涂碘伏,最后对伤口手术缝合,将动物放回饲养笼观察,等待自然苏醒。
2.2 分组与黄芩苷干预适应性饲养1周后,将50只大鼠随机分为假手术组、模型组、黄芩苷干预低剂量组(60 mg-1·kg-1·d-1)、高剂量组(120 mg-1·kg-1·d-1)[2]、米诺环素组(36 mg-1·kg-1·d-1)[8]5组。造模2 d后,进行药物干预治疗14 d,每天给药分为2次,固定时间在早晨9点和晚6点,药物干预组按上述剂量灌胃,其余两组以等体积生理盐水灌胃。
2.3 Morris水迷宫实验药物干预14 d后,进行水迷宫实验,用Smart 3.0软件记录大鼠的行动轨迹及时间路程数据。(1)定位航行实验:实验前5 d,每天固定时间,从4个象限分别将大鼠放进水池中,头面向筒壁,软件设置大鼠寻找平台时间(逃避潜伏期)为1 min。若1 min内爬上平台且停留>2 s,测试结束,记录所需时间;若未爬上平台,则逃避潜伏期记录时间60 s,然后需由实验者将大鼠引导至平台,停留10 s左右进行学习记忆。(2)空间探索实验:实验d 6取出平台,再从4个象限位置将大鼠放入水池,记录60 s内大鼠穿梭原平台区域的次数及在第一象限即平台象限停留的时间。
2.4 取材及保存行为学测试结束,麻醉大鼠给予3%戊巴比妥钠,固定大鼠四肢暴露腹部,消毒并打开腹腔,注射器吸取提前预冷生理盐水,左心室进针,剪右心耳行心脏灌注,至内脏发白,断头取脑。提前准备冰盒放置取出的脑组织,分离左脑保存固定在4%多聚甲醛中,右脑海马放入冻存管置于液氮中速冻,后放入-80 ℃冰箱保存。
2.5 免疫荧光检测NF-κB核转移情况和小胶质细胞活化情况石蜡切片,于65 ℃烘烤1 h,脱蜡后,3% H2O2灭活10 min后,使用0.3% Triton X-100(PBS配制)透膜5 min,然后5%正常驴血清封闭1 h,分别使用NF-κB p65(1 ∶200)、Iba1(1 ∶50)4 ℃孵育过夜,次日荧光二抗Alexa Fluor 647(红色,1 ∶500)避光室温1.5 h,PBS洗3次,每次10 min,最后滴加抗荧光淬灭剂(含DAPI),加盖盖玻片,使用全景组织扫描成像系统分析。
2.6 PCR法检测细胞表型标志物和炎性因子表达取一半海马组织,加入1 mL TRIzol研磨,加入氯仿200 μL,离心取上清加入500 μL异丙醇,离心弃上清加75%乙醇1 mL,离心晾干乙醇,加DEPC水50 μL溶解RNA,测定RNA浓度,计算调整RNA量为每20 μL体系1 μg,逆转录成cDNA,采用SYBR染料法使用Bio-Red CFX96 real-time PCR仪进行扩增检测。PCR扩增体系为20 μL,cDNA 2 μL,上下游引物各1 μL;程序:95 ℃ 5 min,1循环;95 ℃ 5 s,58 ℃ 30 s,40循环;采用2-ΔΔCt法分析各目的基因的mRNA相对表达水平,引物序列见Tab 1。
2.7 Western blot法检测TLR4/MyD88/NF-κB信号通路相关蛋白的表达另一半海马组织破碎仪破碎后取一部分加入RIPA裂解液(内含磷酸蛋白酶抑制剂),离心,上清即为海马细胞总蛋白;另一部分按照胞核与胞质蛋白抽提试剂盒说明书分别提取出细胞核和细胞质蛋白。使用BCA试剂盒于酶标仪上测定各部分蛋白浓度,标曲R2>0.99,计算并配置浓度为2 g·L-1的上样缓冲液,-20 ℃保存。电泳80 V,30 min;100 V,90 min;200 mA湿转90 min至0.45 μm或0.22 μm的PVDF膜;5%脱脂牛奶或5% BSA(磷酸蛋白)(TBST配制)室温摇床封闭1 h后孵育一抗(TLR4 1 ∶1 000、MyD88 1 ∶1 000、phospho-NF-κB p65 1 ∶1 000、NF-κB p65 1 ∶1 000、β-actin 1 ∶10 000、Histone H3 1 ∶8 000)4 ℃过夜;次日二抗(1 ∶8 000)37 ℃恒温1 h,凝胶成像系统显影成像;全细胞以β-actin作为参照,胞核以Histone H3为参照,使用ImageJ软件对条带进行分析。
2.8 统计学方法使用SPSS 26.0软件进行数据的统计分析,计量资料均以均数±标准差表示,采用单因素方差分析(One Way ANOVA)及t检验;统计图使用Prism Graphpad 8.0软件制作。
3 结果
3.1 黄芩苷对AD大鼠模型学习记忆能力的影响大鼠双侧侧脑室注射STZ诱导AD大鼠模型,造模后连续14 d给予不同浓度黄芩苷(60 mg-1·kg-1·d-1,120 mg-1·kg-1·d-1)和米诺环素组(36 mg-1·kg-1·d-1)灌胃治疗。Morris水迷宫结果显示,与假手术组相比,AD大鼠学习记忆能力有一定程度下降,寻找平台时间增加(P<0.01);与模型组相比,黄芩苷低(P<0.05)、高剂量和米诺环素(P<0.01)治疗后能明显减少AD大鼠寻找平台时间,行动目标明确。在空间探索实验中,与假手术组相比,AD大鼠第一象限停留的时间减少(P<0.01),且救生平台穿梭的次数明显减少(P<0.01);与模型组比较,黄芩苷低(P<0.05)、高剂量(P<0.01)和米诺环素(P<0.05)治疗后AD大鼠穿梭平台次数和第一象限停留时间增加(Fig 1)。
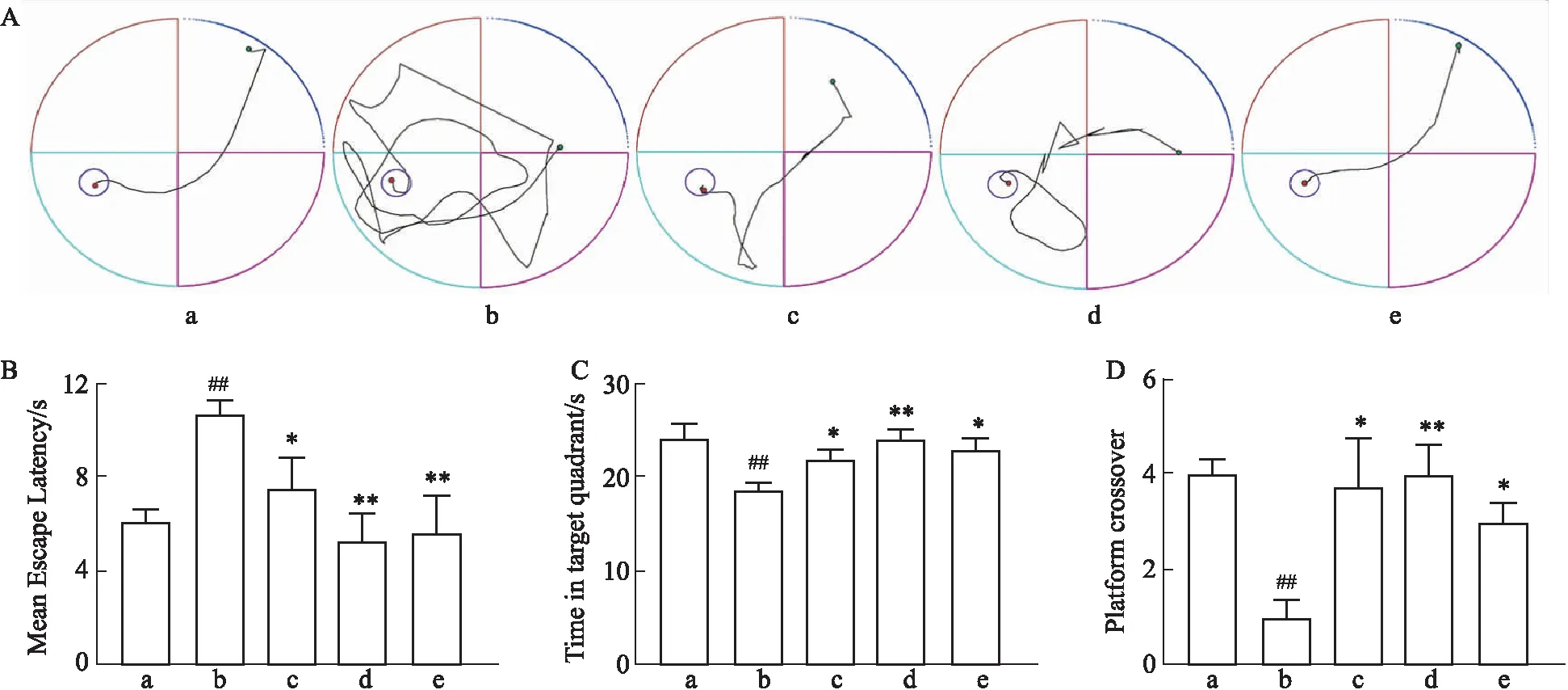
Fig 1 Effect of baicalin on learning and memory of AD
3.2 黄芩苷对AD大鼠模型海马区小胶质细胞活化的影响通过免疫荧光结果显示,假手术组小胶质细胞少有活化,模型组中小胶质细胞活化数量较假手术组明显增多(P<0.01),且呈现聚集性,多分布在海马CA2和CA3区;与模型组比较,在不同剂量的黄芩苷和米诺环素干预后均能抑制小胶质细胞活化(P<0.01)(Fig 2)。
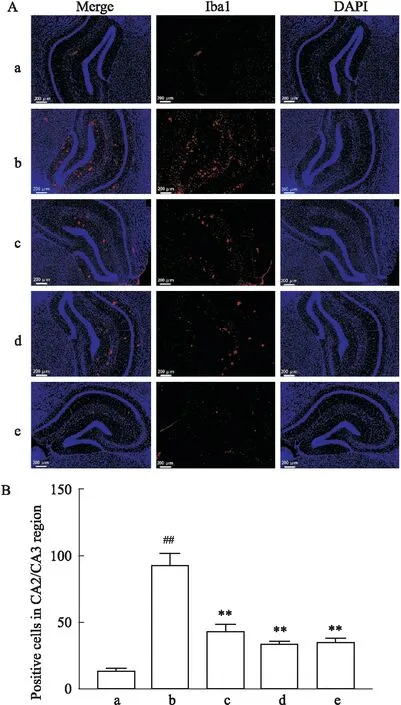
Fig 2 Effect of baicalin on microglia activation in hippocampus of AD
3.3 黄芩苷对AD大鼠模型海马区炎症因子表达的影响采用qPCR检测各组大鼠海马区炎症因子的mRNA表达水平,与假手术组比较,模型组的TNF-α、IL-6的表达升高(P<0.05),IL-1β的表达明显上升(P<0.01),差异有统计学意义;与模型组比较,黄芩苷低、高剂量和米诺环素处理能有效抑制TNF-α、IL-6(P<0.05)、IL-1β(P<0.01)的表达,差异有统计学意义(Fig 3)。
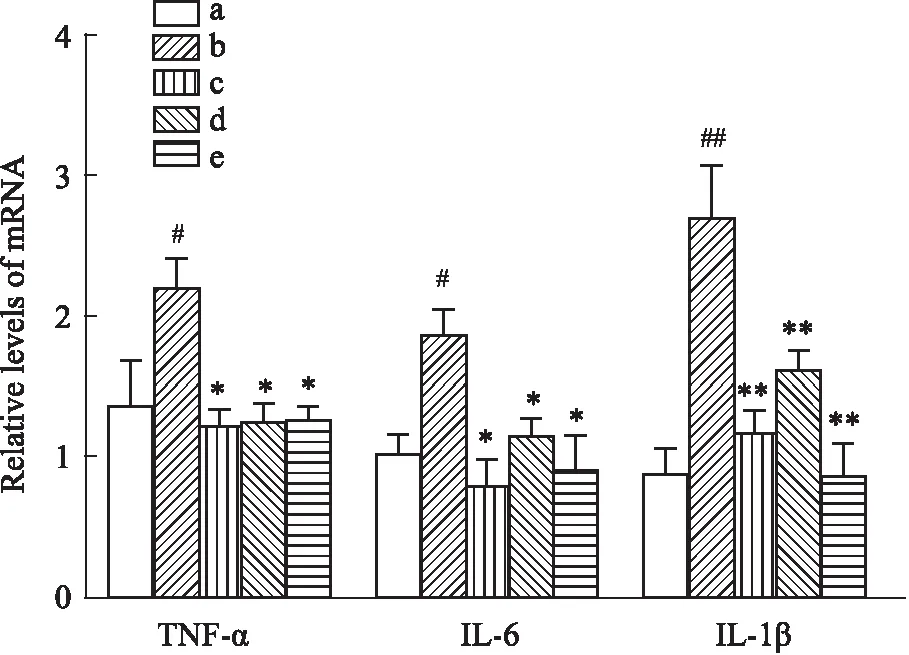
Fig 3 Effect of baicalin on TNF-α,IL-6 and IL-1β mRNA expression in hippocampus of AD
3.4 黄芩苷对AD大鼠模型海马区TLR4/MyD88/NF-κB信号通路的影响TLR4/MyD88/NF-κB信号通路调控促炎因子的产生,是经典的炎症通路。通过Western blot法检测各组大鼠海马区TLR4、MyD88、NF-κB p65、p-NF-κB p65的蛋白表达情况,提取各组大鼠海马区全蛋白,与假手术组相比,模型组TLR4、MyD88的蛋白表达量(P<0.01)及p-NF-κB p65/NF-κB p65比值明显上升(P<0.05)。不同浓度的黄芩苷及米诺环素处理能有效抑制TLR4、MyD88的表达量,减少NF-κB p65活化(P<0.01),差异有统计学意义。
提取各组大鼠海马区胞质和胞核蛋白,通过Western blot法检测NF-κB蛋白表达情况,结果见Fig 4。与假手术组相比,模型组NF-κB p65胞核/胞质比增加(P<0.05),说明NF-κB p65入核增加,差异有统计学意义。不同浓度黄芩苷处理可降低NF-κB p65胞核/胞质比,减少NF-κB p65入核,米诺环素处理后与黄芩苷高剂量组干预结果一致(P<0.01)(Fig 4)。
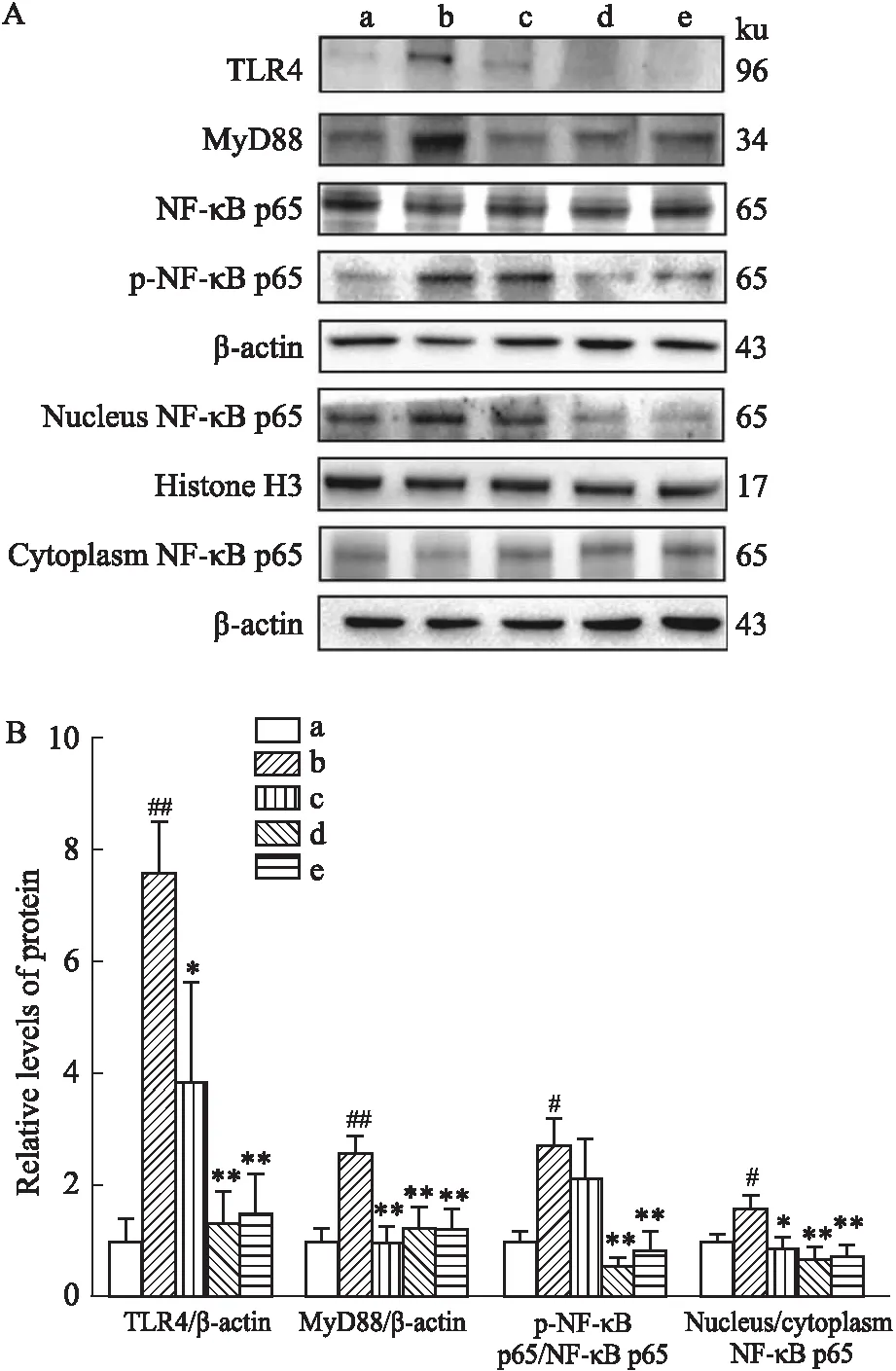
Fig 4 Effect of baicalin on TLR4/MyD88/NF-κB signaling pathway in hippocampus of AD
3.5 黄芩苷对AD大鼠模型海马区NF-κB核转移的影响免疫荧光结果显示,假手术组组织中NF-κB p65主要位于胞质,而在模型组中NF-κB p65出现散点状入核的细胞数量增多,在不同剂量的黄芩苷或米诺环素干预下,一定程度上抑制NF-κB p65进入细胞核,与Western blot结果一致(Fig 5)。
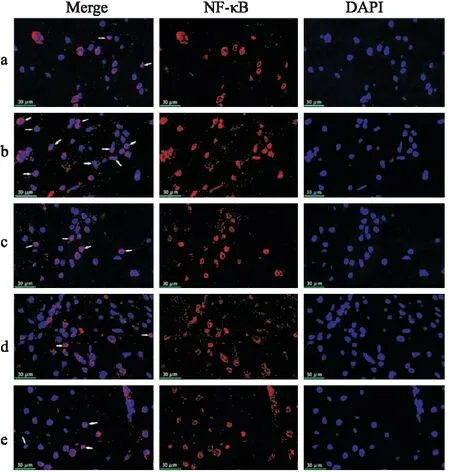
Fig 5 Effect of baicalin on intracellular nuclear transfer of NF-κB p65 in hippocampus of AD rats
4 讨论
AD是以进行性认知功能障碍和记忆功能减退为主的神经退行性疾病,多种证据表明脑内炎症是AD的重要病理学特征。STZ是一种亚硝基脲衍生物,会优先破坏胰岛β细胞,通常用作糖尿病实验动物模型。研究表明,侧脑室注射低剂量STZ可引起脑胰岛素信号稳态的破坏及脑内葡萄糖代谢障碍但不会诱发全身性糖尿病,这与散发型阿尔茨海默病(SAD)的病理学变化类似,其主要病理改变包括突触功能障碍、tau过度磷酸化、神经炎症、大脑中Aβ沉积、氧化应激和胰岛素抵抗等引起脑内神经元损失,最终导致学习记忆能力进行性缺失及认知行为改变[9],目前已成为较为成熟的AD动物模型。相较于APP/PS1小鼠,从基因层面促进Aβ生成模拟AD发病过程,本模型模拟的是在AD发病类型中占比约为90%的SAD,更具有代表性。STZ侧脑室注射的AD模型已被证明脑内TNF-α、IL-1β、IL-6等促炎因子升高[10]及NF-κB的上调[11],说明神经炎症在此AD模型中是关键性病理特征。本研究探索了黄芩苷对STZ侧脑室注射损伤的AD大鼠模型的脑内炎症的抗神经炎症作用,发现黄芩苷可以对AD大鼠起到神经保护作用,在水迷宫实验中,模型组大鼠找到平台的时间明显较正常组、药物组及阳性对照组延长,说明STZ侧脑室注射损伤了大鼠的学习记忆能力,而给与黄芩苷的AD大鼠的逃避潜伏期则明显缩短,提示黄芩苷对AD大鼠模型具有一定的保护作用。
黄芩性味苦寒,入肺、胃、胆、大肠经,有清热燥湿、泻火解毒之效,用于治疗各种炎性疾病。黄芩苷是黄芩的有效成分,有抗菌抗病毒、抗过敏、镇痛消炎、抗肿瘤、保护肝损伤、改善糖尿病肾病、脑损伤修护等功效,同时也具有很好的神经保护作用[5]。黄芩苷可以改善AD小鼠模型的突触可塑性及线粒体功能[12],促进AD大鼠神经干细胞增殖和分化[13]、抗氧化应激及细胞凋亡[14],尤其是在抗炎及神经保护方面的作用尤为突出[2],这也与中药黄芩本身的功效相适应。TLR4表达于中枢神经系统神经元、小胶质细胞、星形胶质细胞、少突胶质细胞和血管内皮细胞上,可被多种病原体和细胞因子激活[3]。多项研究表明,TLR4与先天免疫激活密切相关,可参与中枢神经系统损伤时的免疫调节,在炎症调节中起重要作用[15],MyD88作为TLR4接头分子有依赖性和非依赖性两种,其依赖途径介导NF-κB的活化和细胞因子的产生,在AD的发生发展中起着关键作用[16]。正常状态下,NF-κB p65 和NF-κB p50结合在一起,其抑制蛋白IκB也结合在其上,此时NF-κB无活性。IκB的激酶IKK可以促进其磷酸化,磷酸化后的IκB会被泛素化降解,NF-κB脱离出来入核,激活下游基因的转录,可以上调编码各种促炎蛋白或酶的基因[17],如升高TNF-α、IL-1β、IL-6等的表达。在本实验中,黄芩苷可以降低AD大鼠脑中的TLR4、MyD88的表达,减少NF-κB p65的磷酸化和抑制NF-κB入核,从而下调TNF-α、IL-1β、IL-6等炎症因子的表达。提示黄芩苷改善STZ诱导的AD大鼠认知功能障碍可能与调控TLR4/MyD88/NF-κB信号通路抑制神经炎症密切相关。有趣的是,炎症因子的表达与黄芩苷的干预无剂量依赖关系,研究表明,黄芩苷通过下调SIRT1/HMGB1通路,减少小胶质细胞相关的神经炎症,并改善了LPS诱导的小鼠急性神经认知缺陷[18],因此,我们推测黄芩苷抑制神经炎症可能是多途径共同参与的。
综上所述,STZ侧脑室注射导致大鼠学习记忆能力减退可能与脑内神经炎症有关,黄芩苷灌胃可改善STZ诱导的大鼠认知障碍,其机制可能与抑制TLR4/MyD88/NF-κB信号通路,减轻AD脑内神经炎症有关,本研究为黄芩苷用于AD的防治的后续研究提供了科学依据。

