玻璃体腔注射曲安奈德联合玻璃体切割术治疗特发性黄斑前膜的疗效及其对血清VEGF、HIF-1α水平的影响
李奕萍,张新
(绵阳市第三人民医院·四川省精神卫生中心眼科,四川 绵阳 621000)
特发性黄斑前膜(idiopathic macular epiretinal membrane,IMEM)是与年龄有关的眼科增生性疾病,表现为黄斑区视网膜结构改变,可能与促进血管新生相关因子的过度表达有关[1]。IMEM多发于老年人群,是损害其视力的重要原因之一[2]。玻璃体切割术(pars plana vitrectomy,PPV)是眼科显微高精手术,可切除浑浊玻璃体、缓解视网膜牵拉,达到提高屈光间质透明度、复位视网膜的目的,恢复视功能,是临床IMEM治疗的常用手段[3]。但PPV操作精细且复杂,出血风险高,术野不清将降低病变处理质量和效率[4]。曲安奈德(triamcinolone acetonide,TA)作为糖皮质激素,具有长且持久的抗敏、抗炎效果,近年来常被用于PPV中,发挥辅助标记玻璃体、抑制增生等作用[5]。但关于玻璃体腔注射TA是否可有效提高PPV治疗IMEM中的疗效和安全性尚无定论,且缺乏有关机制的深入研究[6]。基于此,本研究拟分析玻璃体腔注射TA联合PPV对IMEM的治疗效果。
1 资料与方法
1.1 一般资料
选取2018年1月至2021年12月绵阳市第三人民医院收治的110例IMEM患者为研究对象。纳入标准:(1)符合IMEM诊断标准[7];(2)单眼病变;(3)拟行PPV治疗;(4)知情同意参与研究,且配合度高。排除标准:(1)黄斑前膜伴全层或板层黄斑裂孔者;(2)合并葡萄膜炎、糖尿病视网膜病变等影响黄斑功能和结构的疾病者;(3)继发性黄斑前膜者;(4)有糖皮质激素类药物长期治疗史者;(5)有眼外伤、内眼手术史者;(6)存在PPV或TA治疗禁忌症者。按疗法不同将患者分为对照组和观察组,每组各55例。两组一般资料比较,差异均无统计学意义(P>0.05)。见表1。本研究符合伦理且通过审批。

表1 两组一般资料比较
1.2 治疗方法
对照组患者予以PPV治疗,仪器为美国Alcon公司标准23G微创玻璃体切割术操作系统,用3 mL的2% 利多卡因行球后阻滞麻醉,睫状体平坦部三通道入路,行玻璃体切割、黄斑前膜剥除、上下血管间内界膜剥除操作。观察组PPV治疗方式同对照组,但在切除玻璃体后用套管针向玻璃体腔中注射2 mL的TA 1 mL∶40 mg。两组PPV均由同一组医师完成,术后使用妥布霉素地塞米松滴眼液滴术眼,1~2 滴/次,4~6 次/d,持续14 d。
1.3 观察指标
于术前和术后1个月、3个月检测两组术眼最佳矫正视力(best corrected visual acuity,BCVA)、黄斑中心凹视网膜厚度(central macular thickness,CMT)、黄斑中心凹内异位层(ectopic inner foveal layer,EIFL)+外丛状层厚度及血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、低氧诱导因子(hypoxia inducible factor-1α,HIF-1α)水平,并观察术后3个月内并发症发生情况。其中,BCVA用Snellen视力表检测,其结果转化为最小分辨视角(minimum angle of resolution,MAR)对数视力(LogMAR);CMT用光相干断层扫描仪(Cirrus HD-OCT 5000,德国蔡司)检测;EIFL+外丛状层厚度用OCT中的“卡尺”功能进行手动测量;VEGF、HIF-1α用酶联免疫吸附法检测(试剂盒均购自武汉博士德生物),血样为空腹外周静脉血。
1.4 统计学分析

2 结果
2.1 两组患者BCVA比较
术前,两组BCVA比较,差异无统计学意义(P>0.05)。术后1个月、3个月,两组BCVA均较术前显降低(P<0.05);且观察组BCVA均低于对照组(P<0.05)。见表2。
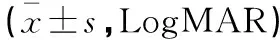
表2 两组BCVA比较
2.2 两组患者黄斑区视网膜参数比较
术前,两组黄斑区视网膜参数比较,差异均无统计学意义(P>0.05)。术后1个月、3个月,两组CMT、EIFL+外丛状层厚度均较术前降低(P<0.05);且观察组CMT、EIFL+外丛状层厚度均低于对照组(P<0.05)。见表3。
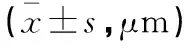
表3 两组黄斑区视网膜参数比较
2.3 两组患者血清VEGF、HIF-1α水平比较
术前,两组血清VEGF、HIF-1α水平比较,差异均无统计学意义(P>0.05)。术后1、3个月,两组血清VEGF、HIF-1α水平均较术前降低(P<0.05);且观察组血清VEGF、HIF-1α水平均低于对照组(P<0.05)。见表4。

表4 两组血清VEGF、HIF-1α水平
2.4 两组患者术后并发症比较
观察组术后3个月内并发症总发生率为9.09%(5/55),对照组术后并发症总发生率为23.64%(13/55),组间比较差异有统计学意义(P<0.05)。见表5。

表5 两组术后并发症发生情况比较[n(%)]
3 讨论
IMEM是临床眼科常见疾患,病因尚不明确,通常认为与视网膜细胞向黄斑区迁移聚集有关,可损伤患者视力,甚至引起失明[8]。经PPV剥除黄斑前膜是IMEM治疗的常用方式,但临床发现,仍存在10%~30%的患者在手术成功的前提下视力未得改善[9]。黄斑水肿和EIFL持续存在是患者术后视力差的常见原因,炎症反应可能与之相关[10]。TA为长效糖皮质激素,可抑制巨噬细胞及白细胞移行、稳定溶酶体膜、调节体液免疫、抑制巨噬细胞处理抗原等,进而发挥强效抗炎作用[11],还可通过减少肥大胞颗粒释放组织胺来缓解血管舒张、提高血管敏感性来减轻局部充血和体液外渗等途径来减轻局部组织水肿[12],另外,TA还可直接抑制纤维母细胞的DNA,避免形成肉芽组织,抑制增生[13]。因此,在玻璃体腔内注射TA是促进PPV术后患者术眼局部炎症、水肿、组织结构异常的改善的合理选择。本研究显示,观察组术后1个月、3个月时BCVA及CMT、EIFL+外丛状层厚度均明显低于对照组,表明玻璃体腔注射TA联合PPV可有效减轻IMEM患者术后黄斑水肿,修复视网膜微结构,改善患者术后视力。王丽英等[14]研究发现,在内界膜剥除治疗继发性黄斑前膜时,增加玻璃体腔注射TA可加速黄斑区局部代谢,促进水肿消散,利于视功能恢复。Chatziralli等[15]在IMEM合并黄斑水肿患者的玻璃体腔中注入地塞米松也取得了同样效果,但是地塞米松药效时间不如TA长,对黄斑水肿仅有治疗而无预防作用。
IMEM的病因病机虽然尚未明晰,其发生发展可能与促进血管新生相关因子的过度表达有关[16]。VEGF具有诱导体内血管新生的重要作用,参与了血管生成依赖性疾病如癌症、糖尿病视网膜病变等的发生发展,VEGF过表达与视网膜血管及脉络膜新生密切相关[17]。抗VEGF治疗对多种黄斑变性、水肿、脉络膜新生血管等疾病均具有较好的效果[18]。HIF-1α是决定HIF-1活性的唯一亚单位,对缺氧刺激敏感,且参与多种缺氧相关生理反应。视网膜缺氧将增加VEGF的表达,HIF-1α则在此过程中作为核转录调节因子而起到重要作用[19]。王雪等[20]发现,HIF-1α在增生性玻璃体视网膜疾病患者中得水平较正常人群明显更高,参与了疾病的发生。因此,降低IMEM患者VEGF、HIF-1α水平对促进其康复具有重要意义。本研究显示,观察组术后1个月、3个月时血清VEGF、HIF-1α水平低于对照组,表明增加玻璃体腔注射TA可有效降低患者血清VEGF、HIF-1α水平,从而有利于康复进展。相关研究[21]也证实了,TA可显著抑制人视网膜色素上皮细胞的VEGF、HIF-1α表达,有效防止视网膜相关疾病血管新生。本研究发现,观察组术后并发症总发生率低于对照组,提示在PPV治疗IMEM时增加玻璃体腔注射TA可有效降低术后并发症发生风险,这可能得益于TA的抗炎、缓解组织水肿等作用,还可能是由于TA可通过增加玻璃体中纤溶酶原激活物抑制剂1浓度并降低组织纤溶酶原激活物及尿激酶纤溶原激活物浓度来抑制局部出血,发挥止血作用,降低术后视网膜出血、玻璃体积血的发生风险[22]。
综上,在PPV治疗IMEM中增加玻璃体腔注射TA可明显提高患者术后术眼视力,促进黄斑解剖结构恢复,降低术后并发症发生风险,且降低血清VEGF、HIF-1α水平可能是其作用机制之一。

