基于MMP7/mTORC1信号通路探讨小鼠脓毒症急性肾损伤的分子机制*
丁 璐,柳红英,王 卉,范桄溥
(1北京人民大学医院重症医学科,北京 100044;2北京人民大学医院心外科,北京 100044)
急性肾损伤(acute kidney injury,AKI)是脓毒症患者常见的并发症,会导致发病率和死亡率增加[1]。由于脓毒症中AKI的病理生理学机制很复杂,目前尚无有效特定疗法[2]。因此,早期发现AKI对于最终制定有效的干预措施至关重要。最近,研究报道基质金属蛋白酶7(matrix metalloproteinase 7,MMP7)是一种早期无创生物标志物,可预测心脏术后患者的严 重AKI[3]。MMP7是一种 分泌型锌 和 钙依赖 性内肽酶,其主要功能是通过消化酪蛋白、明胶、纤连蛋白和蛋白聚糖来分解细胞外基质。MMP7还能够切割其他底物,并在E-cadherin胞外域脱落、TNF-α释放和其他蛋白酶的激活中发挥作用[4-5]。MMP7的这种能够作用于大量底物的能力,使其成为控制广泛生物过程(如组织重塑、细胞凋亡和炎症)的潜在参与者[6]。然而,MMP7在脓毒症AKI发病机制中的作用是完全未知的。在本研究中,我们观察了MMP7在盲肠结扎穿孔(cecal ligation and perforation,CLP)小鼠中的变化,并使用内源性MMP7缺失小鼠和外源性MMP7重组蛋白来分析MMP7在CLP介导的脓毒症期间对肾损伤的作用。
材料和方法
1 动物
从北京维通利华实验动物技术有限公司[生成许可证号:SCXK(京)2016-0006]购买SPF级、8周龄、雄性、具有C57BL/6J遗传背景的MMP7敲除(MMP7-KO)小鼠(18~22 g),以及年龄和性别匹配的C57BL/6J小鼠(18~22 g)用作野生型(wild-type,WT)对照,共88只。
2 细胞、试剂和仪器
人近端肾小管上皮细胞系HKC-8购自ScienCell Research。载体或MMP7重组蛋白购自EMD Chemicals;HE染色试剂盒购自Beyotime;兔抗中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)多克隆抗体购自Invitrogen;HRP偶联的Ⅱ抗购自Jackson ImmunoResearch;DAB反应缓冲液购自武汉谷歌生物科技有限公司;原位细胞死亡检测试剂盒和脂多糖(lipopolysaccharide,LPS)购自Sigma;抗Na+-K+-2Cl-共转运体2(Na+-K+-2Cl-cotransporter 2,NKCC2)抗体购自Alpha Diagnostic International;抗Na+-Cl-共转运体(Na+-Cl-cotransporter,NCC)抗体购自Biosciences;Alexa Fluor 594或Alexa Fluor 488偶联的Ⅱ抗购自Molecular Probes;四棱莲凝集素染色的切片、荧光素标记的四棱莲凝集素、生物素化的Dolicos biflorus凝集素和荧光素avidin D购自Vector Laboratories;蛋白提取试剂盒购自TaKaRa;二辛可宁酸试剂盒购自北京普利莱基因技术有限公司;聚偏氟乙烯膜购自Bio-Rad;兔抗MMP7单克隆抗体、兔抗GAPDH多克隆抗体和辣根过氧化物酶标记的Ⅱ抗购自Cell Signaling Technology;兔抗哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)多克隆抗体购自Abcam。加热垫购自Physitemp Instruments;Vitros 250 Analyzer购 自Johnson & Johnson;荧光显微镜购自Hitachi。
3 主要方法
3.1 小鼠分组在实验1中,WT小鼠随机分配到以下2组:假手术(sham)组和脓毒症(CLP)组,每组18只。假手术组小鼠接受剖腹手术但没有进行CLP术;CLP组小鼠建立CLP模型。分别在术后0、3、6、18、24和48 h处死小鼠,每个时点各组选取3只。实验2检验内源性MMP7缺失对CLP诱导AKI的影响,分别将MMP7-KO小鼠和WT小鼠各自随机分配到假手术组和CLP组,每组8只。在术后24 h处死小鼠。实验3检验外源性MMP7对CLP诱导AKI的影响,MMP7-KO小鼠随机分配到CLP+vector组和CLP+MMP7组,每组10只,在CLP术前24 h通过尾静脉以0.4 mg/kg向小鼠注射载体或MMP7重组蛋白,术后24 h处死小鼠。
3.2 脓毒症模型建立和标本采集参照文献方法建立CLP模型以诱发脓毒症[7]。具体操作为:在用2%异氟醚麻醉的情况下,将动物置于加热垫上以将体温保持在37℃。皮肤消毒后,在腹部中线切开1 cm,暴露盲肠。在远端和盲肠基部之间的中间结扎以诱导中度脓毒症。在结扎部位和盲肠尖端之间用一根21G的针刺穿整个盲肠。少量粪便通过穿刺部位挤出。将盲肠放回腹部,用无菌6-0丝线缝合腹膜、筋膜和腹部肌肉组织。皮肤用金属夹闭合。用0.25%布比卡因浸润至手术部位。手术后再次进行皮肤消毒。对于接受手术的动物,皮下注射50 mL/kg生理盐水。假手术组的动物接受相同的手术程序但没有进行CLP。使用代谢笼来监测术后尿量,尿量<0.5 mL/(kg·h)为少尿[8]。在预先指定的安乐死时间处死小鼠后,立即进行了体内双侧肾切除术,以尽量减少潜在的混杂缺血。一个肾脏立即在4%多聚甲醛中固定24 h,另一个放入液氮中保存。然后通过心脏穿刺对小鼠进行放血,血液用于即时检测。
3.3 血尿素氮和血清肌酐测量收集血液,在室温下保持30 min,并分离血清(3 600×g,10 min)。在Vitros 250 Analyzer使用毛细管电泳测量血尿素氮和血清肌酐。结果以mg/dL表示。
3.4 肾损伤评估将肾组织用4%多聚甲醛固定,包埋在石蜡中,并以4 μm切片。按照标准程序使用HE染色试剂盒染色,具有以下组织病理学变化的肾小管被认为受损:刷状缘缺失、肾小管扩张和破裂、管型形成和细胞溶解。以盲法检查组织损伤,并以损伤小管的百分比评分:0表示无损伤;1表示<25%;2表示25%~50%;3表示50%~75%;4表示>75%。对于免疫组化染色,将石蜡包埋的肾切片与0.1 mmol/L Tris-EDTA缓冲液(pH 9.0)在100℃孵育15 min进行抗原修复。冷却至室温后,将切片浸入0.3%过氧化氢中10 min以阻断内源性过氧化物酶活性。随后与5% BSA和0.1% Triton X-100孵育以减少非特异性结合后,室温下NGAL抗体(1∶200稀释)孵育1 h,然后用HRP偶联的Ⅱ抗室温下孵育1 h。将载玻片浸入DAB反应缓冲液中,随机选择10~15个区域进行量化。对于凋亡检测,通过TUNEL法确定肾脏的细胞凋亡情况。使用原位细胞死亡检测试剂盒进行TUNEL测定,将载玻片脱蜡并在室温下与蛋白酶K(20 g/L)一起孵育15 min,然后将载玻片与TUNEL反应混合物在湿盒中室温孵育1 h。此外,Hoechst 33342用于标记细胞核。随机选择10~15个视野用于量化TUNEL阳性细胞。
3.5 免疫荧光8 μm冷冻切片用磷酸盐缓冲液洗涤,用5% BSA/PBS封闭(室温1 h),与Ⅰ抗(抗MMP7,1∶50;抗NKCC2或抗NCC,1∶200)在4℃下孵育过夜,并通过与Alexa Fluor 594或Alexa Fluor 488偶联的Ⅱ抗(1∶500)检测。在洗涤前,将用四棱莲凝集素染色的切片与荧光素标记的四棱莲凝集素(1∶500)在室温下孵育30 min。用生物素化的Dolicos biflorus凝集素(1∶400)染色的切片在4℃下孵育过夜,并通过荧光素avidin D(1∶500)检测。
3.6 细胞和分组处理HKC-8细胞在含有10%FBS、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养液中,于5% CO2、37℃培养箱中培养。每3~4 d传代一次,取第3代细胞用于实验。将细胞分为:对照(control)组、LPS组、LPS+vector组和LPS+MMP7组。除对照组外,各组细胞暴露于LPS(10 mg/L)中6 h。LPS+vector组和LPS+MMP7组在暴露于LPS前6 h,将细胞与vector或人MMP-7重组蛋白(25 nmol/L)孵育。
3.7 Hoechst 33342染色收集处理后的细胞,弃去培养液。在37℃、黑暗处用Hoechst 33342溶液(10 μL)浸泡10 min。随后用PI(5 μL)在37℃对细胞进行染色。在黑暗中持续10 min。用荧光显微镜观察染色细胞的形态。
3.8 Western blot按照蛋白提取试剂盒说明书提取各组肾脏组织和细胞总蛋白,蛋白含量用二辛可宁酸试剂盒测定。提取的蛋白质与上样缓冲液充分混合,在100℃下煮沸10 min进行变性,每个孔上样30 μg样品。接下来,蛋白质通过10%SDS-PAGE转移到聚偏氟乙烯膜上,并在含有5%脱脂牛奶的吐温20的Tris缓冲盐水中封闭1 h。随后,将膜与抗MMP7、mTORC1或GAPDH抗体(1∶1 000)的Ⅰ抗一起孵育过夜,然后用相应的辣根过氧化物酶标记的Ⅱ抗(1∶1 000)孵育2 h。在暗处加入增强化学发光溶液进行显色。以GAPDH为内参照,用Cel-Pro Analyzer分析目标条带的灰度值。
4 统计学处理
采用SPSS 22.0分析数据。所有数据均以平均值±标准差(mean±SD)表示。通过双向重复测量ANOVA分析来自不同组实验的测试数据。Shapiro-Wilk检验用于确定数据的分布。由于所有数据均呈正态分布,因此采用单因素方差分析和Tukey检验来分析数据。以P<0.05为差异有统计学意义。
结 果
1 CLP引起尿量、血尿素氮和血清肌酐的变化
与假手术组相比,CLP组在CLP后6 h内尿量减少(P<0.05),这种下降趋势在后来的时点持续存在,并且在CLP 18 h后尿量均低于0.5 mL/(kg·h)。此外,与假手术组相比,CLP组血尿素氮水平在CLP后6 h显著升高(7~69 mg/dL,P<0.01);CLP后血清肌酐也于CLP后24 h升高(P=0.05),并且在48 h时仍升高。见图1。
2 CLP对肾脏中MMP7表达的影响
与假手术组相比,CLP后6 h肾脏组织中MMP7蛋白表达降低,这种降低持续到48 h,见图2A。此外,免疫荧光染色显示在假手术组小鼠的肾脏中,MMP7主要在肾皮质中和Na+-Cl-协同转运蛋白阳性小管(远端回旋)中表达,在肾髓质中的表达较少,见图2B。
3 内源性MMP7缺失加重CLP诱导的AKI
接下来我们利用内源性MMP7缺失(MMP7-KO)小鼠研究MMP7在AKI发病机制中的作用,其中MMP7基因被全身敲除(图3A)。MMP7-KO小鼠表型正常,没有明显的物理或形态学异常。在CLP后24 h,与WT CLP小鼠相比,MMP7-KO CLP小鼠肾脏表现出更严重的形态损伤,尤其是在肾皮质和外髓质表现出广泛的小管损伤,包括刷状缘丢失、管状铸型形成及细胞脱落到管状腔中(图3B)。MMP7-KO CLP组小鼠肾小管损伤病理评分、NGAL水平和TUNEL阳性肾小管细胞显著高于WT CLP组小鼠(P<0.01),见图3B~E。

Figure 1.CLP caused changes in urine output,blood urea nitrogen(BUN)and serum creatinine.Mean±SD.n=3.*P<0.05,**P<0.01 vs 0 h;#P<0.05,##P<0.01 vs sham group.图1 CLP引起尿量、血尿素氮和肌酐的变化
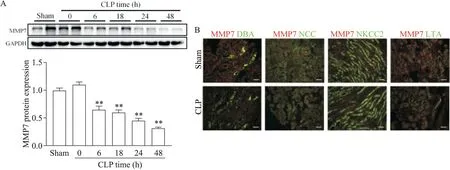
Figure 2.CLP decreased MMP7 expression in mouse kidneys.A:Western blot detection of MMP7 protein expression in kidney tissues at different time points after CLP;B:representative images of co-staining with MMP7 antibody and nephron segmentspecific markers 24 h after CLP(scale bar=20 μm).DBA:Dolichos biflorus agglutinin;LTA:Lotus tetragonolobus agglutinin;NCC:Na+-Cl-cotransporter;NKCC2:Na+-K+-2Cl-cotransporter 2.Mean±SD.n=3.**P<0.01 vs sham group.图2 CLP诱导的脓毒症小鼠肾脏中MMP7的表达减少
4 MMP7在体外可减轻肾小管细胞凋亡
如图4A所示,HKC-8在与LPS孵育后,检测到大量细胞凋亡;而MMP7重组蛋白孵育在很大程度上减轻来自LPS诱导的细胞凋亡。Western blot分析表明,LPS诱导了mTORC1表达,而MMP7可以抑制LPS诱导的mTORC1表达(图4B)。然后我们探讨了MMP7是否可以通过其蛋白水解活性直接消化mTORC1。在无细胞试管中将全长mTORC1蛋白与MMP7一起孵育,如图4C所示,MMP7能够明显切割mTORC1,产生分子量为18 kD的较小片段。此外,MMP抑制剂II(一种MMP7选择性抑制剂)阻止了MMP7介导的mTORC1降解(图4D)。
5 外源性MMP7对CLP诱导AKI的肾脏保护
为了进一步证实MMP7在AKI中的作用,我们通过在MMP7-KO小鼠中注射外源性MMP7进行了救援实验,结果显示小鼠肾组织中MMP7表达显著增加(图5A)。在CLP后1 d,与载体对照相比,接受外源性MMP7的MMP7-KO小鼠肾小管损伤病理评分、NGAL水平、TUNEL阳性肾小管细胞和mTORC1蛋白表达显著降低(P<0.01),见图5B~E。
讨 论
在本研究中,我们使用体内MMP7-KO小鼠作为研究对象,并采用CLP法诱导脓毒症模型。与啮齿动物中使用的许多其他脓毒症模型(例如内毒素血症)相比,CLP能更可靠地概括了人类疾病的许多方面[9]。此外,在代谢笼中单独饲养小鼠可能会重现慢性日常压力,这被证明是动物脓毒症建模的重要组成部分[10]。脓毒症是一种异质的临床实体关于部位、物种和对感染的反应,限制了所有标准化尝试在体内模拟该综合征的适用性。尽管有这些限制,我们的研究结果在病理生理学上与大型哺乳动物和人类患者的研究结果一致[11]。在此基础上,我们调查了MMP7对脓毒症期间AKI的影响。结果显示,MMP7通过减轻肾小管细胞凋亡具有肾脏保护作用。此外,MMP7的肾保护机制可能与直接降解mTORC1有关。这些结果表明,MMP7可作为脓毒症AKI的潜在治疗靶点。
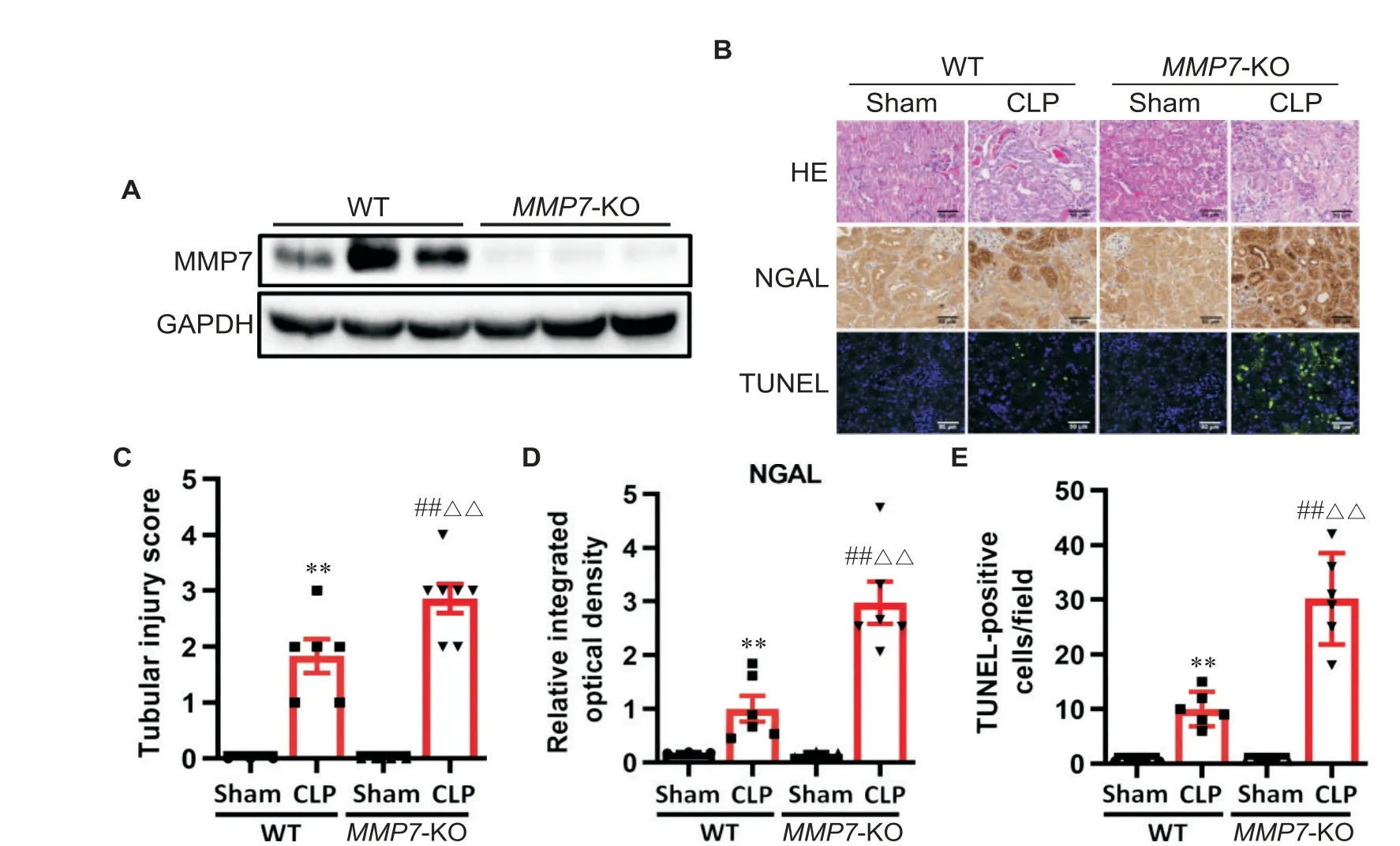
Figure 3.Endogenous MMP7 deletion(MMP7-KO)aggravated CLP-induced AKI.A:the protein levels of MMP7 in kidney tissues of wild-type(WT)and MMP7-KO mice;B:HE staining,NGAL immunohistochemical staining and TUNEL staining were used to assess renal pathology,tubular damage and tubular apoptosis after CLP,respectively(scale bar=50 μm);C:pathological score of renal tubular injury;D:densitometry of NGAL signal after CLP;E:quantification of TUNEL-positive cells.Mean±SD.n=8.**P<0.01 vs sham(WT)group;##P<0.01 sham(MMP7-KO)group;△△P<0.01 vs CLP(WT)group.图3内源性MMP7缺失(MMP7-KO)加重CLP诱导的AKI
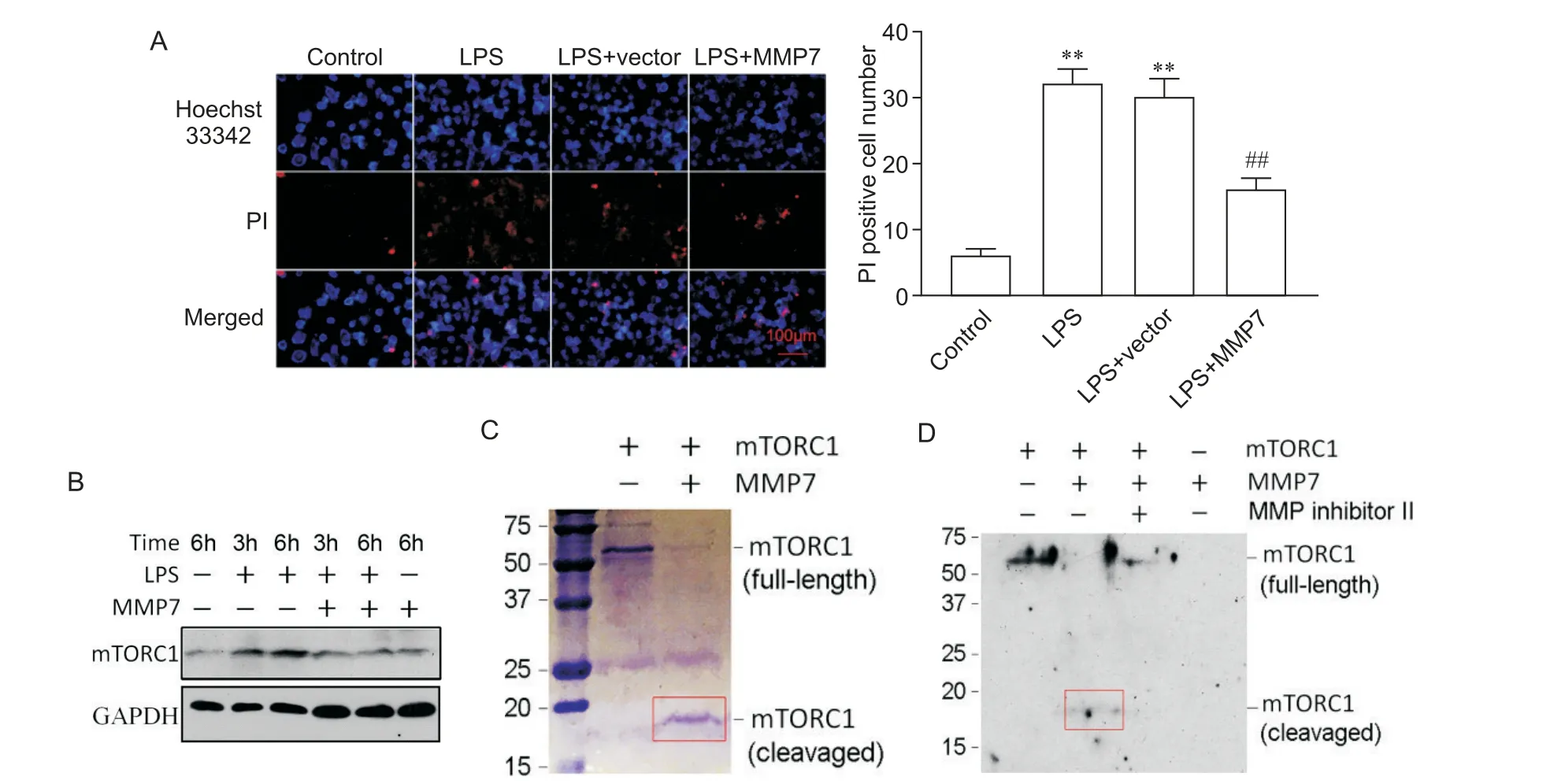
Figure 4.MMP7 protected renal tubular cells from apoptosis by cleaving mTORC1 in vitro.A:Hoechst 33342/PI staining evaluated the effect of MMP7 recombinant protein on LPS-induced apoptosis of HKC-8 cells;B:representative Western blot showing the effect of MMP7 recombinant protein on LPS-induced mTORC1 protein expression in HKC-8 cells;C:representative SDS-PAGE showing that MMP7 directly degrades mTORC1;D:Western blot analysis showing mTORC1 and its degraded fragments after incubation with MMP7 in the absence or presence of MMP inhibitor II.Mean±SD.n=3.**P<0.01 vs control group;##P<0.01 vs LPS+vector group.图4 MMP7在体外通过切割mTORC1减轻肾小管细胞凋亡
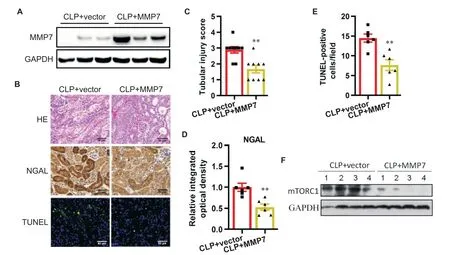
Figure 5.Renal protective effect of exogenous MMP7 on CLP-induced AKI.A:MMP7 recombinant protein up-regulated the protein level of MMP7 in kidney tissues of MMP7-KO mice;B:HE staining,NGAL immunohistochemical staining and TUNEL staining were used to evaluate the effects of MMP7 recombinant protein on renal pathology,renal tubular injury and renal tubular apoptosis in MMP7-KO mice after CLP,respectively(scale bar=50 μm);C:pathological score of renal tubular injury;D:densitometry of NGAL signal;E:quantification of TUNEL-positive cells;F:Western blot showing the effect of MMP7 recombinant protein on mTORC1 protein expression in MMP7-KO mouse kidney tissues.Mean±SD.n=10.**P<0.01 vs CLP+vector group.图5外源性MMP7对CLP诱导AKI的影响
众所周知,由于高能量消耗,近端肾小管上皮特别容易受到CLP损伤[12]。大量研究表明,在急性肾功能衰竭的病理生理学中,肾小管上皮从基底膜上脱落[13-14]。然而,并非所有从基底膜脱落的管状细胞都是细胞坏死或凋亡性死亡,有些仍然存活。此外,肾小管上皮的连接不稳定性会进一步促进肾损伤[15]。本研究证实了CLP后肾小管细胞凋亡显著增加,并且肾小管中MMP7显著下调。MMP7是一种锌和钙依赖性内肽酶,它可以降解多种底物,例如细胞外基质和细胞-细胞粘附蛋白,调节细胞迁移和炎症反应[16-17]。从肾上皮合成的MMP7减少可导致蛋白尿性慢性肾病中的肾素耗竭和肾小球通透性受损[18]。此外,MMP7的缺失还与AKI中几种促炎细胞因子(如MCP-1、TNF-α和RANTES)的表达增加有关,它们调节炎症反应和机体免疫参与AKI进展[5]。与AKI患者尿液中MMP7降低一致[4],本研究中CLP诱导的AKI模型中肾脏MMP7的表达显著降低。MMP7蛋白主要定位于近端小管。这些结果表明AKI患者的尿MMP7减少最有可能与受伤的小管释放减少有关。
mTORC1在肾脏疾病中的作用已被广泛研究。用雷帕霉素抑制mTORC1可抑制TGF-β1诱导的肾小管上皮细胞间质转化[19]。此外,肾组织中mTORC1的异常激活会导致一系列以细胞生长、增殖和分化异常为特征的疾病,如PKD、肾细胞癌和肾小球硬化[20]。本研究在CLP诱导的AKI中观察到MMP7的敲 除诱 导mTORC1表 达,表明MMP7抑制mTORC1介导的凋亡途径。这一结论得到了几条证据的支持。首先,MMP7的缺失会进一步增加CLP诱导的肾小管凋亡细胞。其次,MMP7可以在非细胞系统中直接切割纯化的mTORC1蛋白,证实了其通过蛋白水解降解破坏mTORC1的能力。第三,救援实验证实MMP7通过抑制MMP7缺失小鼠中的mTORC1活化来减轻CLP后的细胞凋亡。
总之,本研究表明,肾脏MMP7下调可促进小鼠脓毒症AKI发生发展。MMP7通过降解mTORC1减轻细胞凋亡,从而具有肾脏保护作用。因此,脓毒症AKI后早期诱导MMP7可能是肾脏启动肾小管存活所必需的。

