上海南汇东滩湿地不同植被沉积物孔隙水的地球化学特征及对碳循环过程的指示
邢亚茹, 陈琳莹, 陈多福, 2
上海南汇东滩湿地不同植被沉积物孔隙水的地球化学特征及对碳循环过程的指示
邢亚茹1, 陈琳莹2*, 陈多福1, 2
(1. 上海海洋大学 海洋生态与环境学院, 上海 201306; 2. 上海海洋大学 海洋科学学院 上海深渊科学工程技术研究中心, 上海 201306)
滨海湿地有较高的沉积速率和固碳能力, 在缓解全球变暖方面发挥重要作用。研究碳沉积埋藏过程对理解滨海湿地碳收支具有重要意义。前人对长江口湿地碳循环的研究较为广泛, 但对沉积物孔隙水溶解无机碳(DIC)来源及影响因素鲜有报道。本研究分析了位于长江口南侧的南汇东滩湿地5个不同植被覆盖站位沉积物的孔隙水阴阳离子(SO2− 4、Cl−、Mg2+、Ca2+)、DIC浓度及δ13CDIC等地球化学特征, 探讨影响孔隙水DIC的生物地球化学过程及其来源。结果表明, 南汇东滩湿地DIC主要来源于上覆水体和沉积物有机质的早期矿化, 并受不同植被和在潮滩中的位置控制。位于低潮滩的光滩站位的沉积物孔隙水SO2− 4和DIC浓度在剖面上基本保持不变, δ13CDIC为−7.7‰ ~ −6.1‰, 有机质硫酸盐还原(OSR)作用产生的DIC约占孔隙水的20%, 海水来源占80%。位于中潮滩的海三棱藨草和堤内芦苇站位沉积物孔隙水SO2− 4浓度在浅表层快速下降, δ13CDIC分别为−12.5‰ ~ −7.5‰和−16.7‰ ~ −11.5‰, 存在较强的OSR作用。海三棱藨草站位的OSR作用和海水来源DIC分别约为43%和57%, 堤内芦苇沉积有机质的OSR作用产生了约59%的DIC, 上覆水体来源的DIC约41%。位于高潮滩的堤外芦苇和互花米草站位沉积物孔隙水的SO2− 4浓度在浅表层快速下降, δ13CDIC在剖面上大部分为正值, 最大值分别为10.8‰和5.4‰, 表明存在产甲烷作用, SO2− 4浓度在浅表层的快速下降可能同时与OSR和甲烷缺氧氧化(AOM)作用有关。了解湿地沉积物孔隙水地球化学特征及其影响因素, 为深入研究滨海湿地碳的生物地球化学循环及准确评估滨海湿地碳的来源具有重要意义。
有机质降解; 孔隙水; 溶解性无机碳; 碳循环; 上海南汇东滩湿地
0 引 言
滨海湿地是海岸带演化形成的特殊生态系统(Huang et al., 2020; Steinmuller et al., 2020; Macy et al., 2021), 是大气CO2重要的汇, 是全球碳循环的重要环节, 在减缓和适应全球气候变化方面发挥重要作用。滨海湿地的碳封存能力不仅归功于将CO2有效地转化为植物生物量, 还在于对异地(运输)和本地(原地)有机碳的有效捕获(Frolking et al., 2001; Chmura, 2013; Zhang et al., 2017; Xiao et al., 2019), 滨海湿地长期碳存储主要以沉积有机质的形式存在, 有机碳除了作为碳汇, 还影响湿地生态系统的结构、功能和稳定性(Osland et al., 2018)。此外, 湿地沉积物孔隙水中的溶解无机碳(dissolved inorganic carbon, DIC)和溶解有机碳(dissolved organic carbon, DOC)也是湿地碳汇的主要来源, 是湿地生态系统的重要组成部分(Mostofa et al., 2018; Pinsonneault et al., 2020; Yuan et al., 2020; Zhao et al., 2020)。
滨海湿地植被种类丰富, 不同植被覆盖的湿地沉积物及其孔隙水的变化在碳循环过程中发挥重要作用(Capooci et al., 2019)。滨海湿地沉积物中有机质主要以孔隙水中可溶性有机质和土壤颗粒有机质形式存在, 产生途径主要有湿地植物的埋藏, 其次是地面径流通过河水或者雨水使陆地有机质和人类活动产生的有机质在积水区滞留(Mostofa et al., 2013)。
滨海湿地作为海洋和陆地之间的交叉地带, 咸淡水混合强烈, 且沿海地区经济发达, 人类干扰严重, 过程复杂。台风和地下水输入等偶发事件也会影响滨海湿地的碳循环(Wang and Cai, 2004; Wang et al., 2016)。近年来, 滨海湿地受到了人为和自然因素的严重干扰和破坏(Kirwan and Megonigal, 2013; Tian et al., 2016), 包括海平面上升(Robinson, 2020)、大坝建设(Kirwan and Megonigal, 2013)和外来植物入侵(Yuan et al., 2015; Tong et al., 2018)。尽管碳排放和碳循环在沿海生境中很重要, 但对碳消耗的测量和途径研究较少(Bae et al., 2015)。因此, 了解湿地不同植被区沉积埋藏有机质的生物地球化学过程及其在碳循环过程中的作用, 在区域范围内揭示滨海湿地碳循环机制, 明确影响滨海湿地不同植被区有机质降解的因素, 以及缓解气候变化等方面具有重要的实际意义。
湿地沉积物孔隙水的DIC与多种生物地球化学活动有关, 例如土壤排放、湿地植物呼吸, 碳酸盐岩风化等, 不仅受潮汐的强烈影响, 而且受季节性植物生产和微生物活动的控制(Taillarda et al., 2018; Kim et al., 2020; Steinmuller et al., 2020; Yu et al., 2020)。湿地沉积物的有机碳埋藏、甲烷的厌氧氧化以及有机质的降解等作用在调节湿地沉积物和孔隙水之间的碳平衡方面发挥重要作用(Berner, 1998)。
海洋沉积物孔隙水硫酸盐消耗主要通过2个微生物反应进行: ①有机质硫酸盐还原(organoclastic sulfate reduction, OSR): 2CH2O+SO2− 4→2HCO− 3+H2S (Li and Gregory, 1974; Berner, 1980); ②甲烷缺氧氧化(anaerobic oxidation of methane, AOM): CH4+SO2− 4→HCO− 3+H2S+H2O(Kaplan, 1975; Borowski et al., 1999)。在大陆边缘的海底沉积物中, 柱状沉积物剖面SO2− 4浓度呈快速下降的梯度变化, 通常主要是由AOM和OSR共同作用所致(Borowski et al., 1999; Kastner et al., 2008)。在OSR和AOM过程中消耗甲烷和有机质的同时形成富轻碳的DIC, 不断增加的DIC浓度会引起孔隙水中碳酸盐岩的沉淀, 使孔隙水中Ca2+和Mg2+离子浓度降低(Luo et al., 2013)。此外, 沉积有机质的原位产甲烷作用(2CH2O+H2O→CH4+HCO− 3+H+)也将影响沉积物孔隙水的DIC(Reeburgh, 1980; Conrad, 2005), 产生富重碳的DIC(Barker and Fritz, 1981; Burns, 1998)。
对于长江口湿地碳循环和埋藏的研究, 目前主要集中在横向通量输送为主要过程的崇明东滩和九段沙区域(席雪飞等, 2009; 王红丽等, 2009; 唐玉姝等, 2013)。南汇东滩湿地是长江口湿地的重要组成部分, 位于长江口和东海的交界处, 受海陆相互作用影响, 不仅具有较大的碳存储能力, 而且由于沉积物有机质矿化分解过程将有机碳转化为DIC进入孔隙水, 并通过垂向扩散和侧向输送方式进入上覆水体, 成为临近海域一个不可忽视的碳源(Zhang et al., 2019; Gao et al., 2020)。由于受淡水和海水的交互影响, 湿地沉积物孔隙水DIC的产生和通量在潮汐和季节变化中具有较大的差异(严格等, 2014; Koebsch et al., 2019)。南汇东滩湿地植被类型丰富, 研究者运用遥感技术对其优势种的植被光谱和理化参数信息提取, 分析统计了植被状况, 显示近年来的湿地开发和海堤建设使沿海大堤两侧湿地环境发生了明显变化, 在海堤外侧主要以海三棱藨草、互花米草和芦苇为主, 在海堤内侧主要以一枝黄花和芦苇为主(马长安等, 2011; 张启明和韩震, 2015; 李伟等, 2018;张雪薇等, 2018)。但对于湿地不同植被区沉积物碳的转化是否存在差异, 目前认识不清。
本研究通过对南汇东滩湿地采集于光滩、海三棱藨草、互花米草、堤外芦苇和堤内芦苇5个不同植被和生境区沉积物孔隙水阴阳离子(SO2− 4、Cl−、Mg2+、Ca2+)、DIC及δ13CDIC等分析, 研究这些地球化学参数在南汇东滩湿地不同植被沉积剖面上的变化, 探索滨海湿地沉积碳转化的生物地球化学过程及影响因素, 为评估滨海湿地碳循环提供重要参考。
1 区域概况和样品采集
1.1 区域概况
南汇东滩位于长江口与杭州湾交接地带(图1), 地理坐标为30°51′04″~31°06′47″N, 121°50′50″~ 121°51′40″E, 总面积约122.5 km2(刘杰等, 2007), 受长江口和杭州湾丰富的泥沙影响以及典型的非正规半日潮作用, 水动力弱, 坡度平缓, 泥沙沉积速率快, 形成了典型的淤泥质海滩(付桂, 2007; 李九发等, 2010; 郭文利等, 2010)。由于该地长期受河流径流以及潮汐、波浪、人类活动的共同作用, 滩涂沉积地貌类型复杂, 总体呈北部冲蚀、南部淤积的态势, 沉积物以黏土质粉砂为主, 粒径总体偏粗, 由分选性好的砂、粉砂组成, 水位−2 m的低潮滩带以下的沉积物粒径较粗, 以上的沉积物粒径逐渐变细(张启明, 2015; 陶燕东, 2017)。南汇东滩气候温暖湿润,四季分明, 年降水量约1222.2 mm, 平均气温在15~ 16 ℃, 属于典型的亚热带季风气候区(陈万逸等, 2012)。
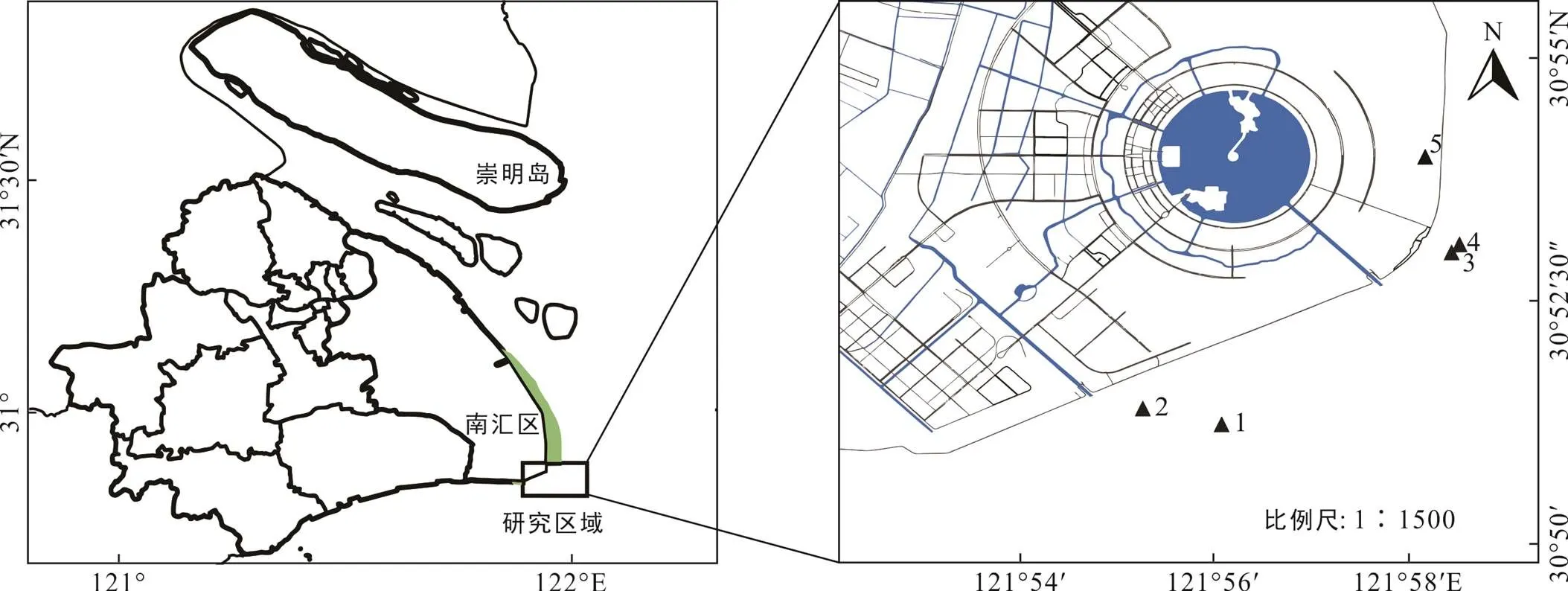
黑色三角形为采样位置: 1. 光滩; 2. 海三棱藨草; 3. 互花米草; 4. 堤外芦苇; 5. 堤内芦苇。
南汇东滩湿地植被类型丰富, 是我国重要的滨海湿地之一, 但由于边滩围垦历史长、强度高、城市化进程快, 南汇东滩湿地破坏严重, 已被列为上海市重点生态修复示范区(马长安, 2015)。南汇潮上带基本位于海堤以内, 海堤建成以后, 潮间带周期性地被海水淹没, 形成较为完整的高、中、低潮滩。海堤内植被群落结构不稳定, 芦苇和一枝黄花交错分布。从大海向大堤方向, 低潮滩受周期性的涨落潮影响, 无高等植物分布, 为广阔的光滩; 中潮滩分布着海三棱藨草和互花米草群落; 高潮滩交错分布着芦苇和互花米草群落。受河流淡水影响, 水体平均盐度为0.21‰~5‰, 总体上夏秋季高于冬春季(尤迪, 2018), 沉积物含水量约为30%~50%, 容重为1.5~1.7 kg/m3(Schulz, 2006; Sun and Turchyn, 2014)。
1.2 样品采集
在2019年7月31和8月1日对南汇东滩湿地光滩、海三棱藨草、互花米草、海堤内外侧芦苇沉积物进行采样(图1; 表1), 使用PD-5手持土壤取样钻机采集柱状沉积物, 采样管直径3.2 cm。使用便携式GPS定位仪对采样点进行定位, 每个站位在退潮时在约0.2 m×0.2 m区域钻取多根沉积物柱状样(表1)。采集的柱状样运回实验室冷藏保存, 按3 cm进行分样, 将同一站位相同深度的重复样品混合装袋, 然后用前端带有孔径为0.2 μm的Rhizon采样器采集孔隙水, 将采集的孔隙水分装在2个棕色玻璃瓶内, 其中1个加入10 μL饱和HgCl2溶液用于DIC浓度及δ13CDIC分析, 另1个加入4 μL高纯浓硝酸用于阴阳离子分析。所有的孔隙水样品都在4 ℃下冷藏保存待机测试。
2 分析方法
孔隙水中的阴离子(SO2− 4、Cl−)和阳离子(Mg2+、Ca2+)在中国科学院南海海洋研究所用Dionex ICS-5000离子色谱仪分析。将孔隙水样品用超纯水稀释100倍, 并作为再生液淋洗液, 用IonPac AS11HC分析柱上机分析阴离子。另取样品用超纯水稀释50倍, 20 mmol/L甲基磺酸作为淋洗液, 用IonPac CS12A分析柱测定阳离子。阴阳离子的进样体积均为50 μL, 流速设定为1 mL/min, 分析结果的标准偏差均小于2%。
孔隙水DIC浓度及δ13CDIC分析在自然资源部第三海洋研究所完成。在12 mL的玻璃瓶加入8滴无水磷酸, 按顺序放入恒温盘上, 固定吹气针, 设定自动进样程序对样品瓶进行5 min的He排空, 然后向排空后的样品瓶中加入0.2 mL的孔隙水样品, 并置于干式恒温器上45 ℃加热, 使孔隙水中的无机碳与无水磷酸在45 ℃下充分反应4 h, 然后将产生的CO2气体通过气相色谱柱分离后用Delta V Advantage质谱仪进行测试。用标准样品的CO2信号强度与DIC浓度建立线性关系, 计算实际样品的DIC浓度, DIC浓度分析精度优于±2%, δ13C值以VPDB(Vienna Peedee Belemnite)国际标准作为参考计算, 分析精度为±0.2‰。
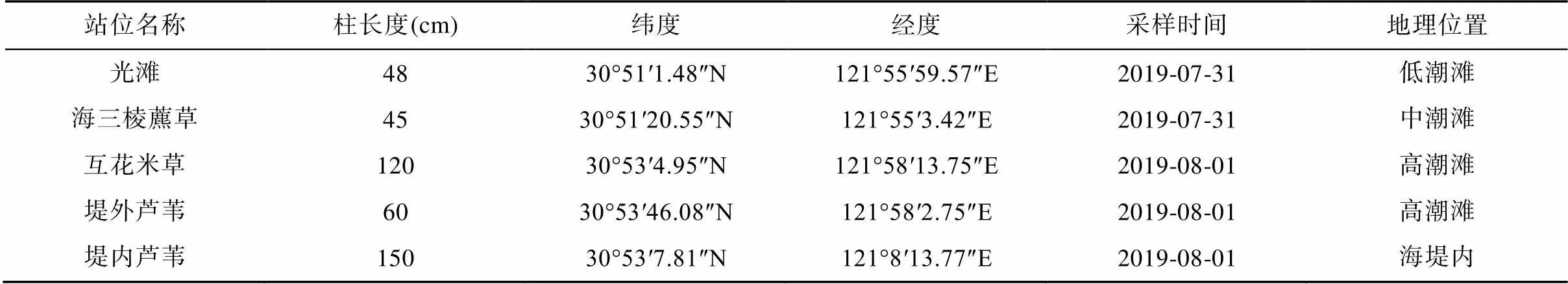
表1 上海南汇东滩湿地沉积物样品采集站位信息
注: 光滩站位采集2根48 cm沉积物柱样; 海三棱藨草站位采集2根45 cm沉积物柱样; 互花米草站位采集3根120 cm沉积物柱样; 堤外芦苇站位采集2根60 cm沉积物柱样; 堤内芦苇站位采集2根150 cm沉积物柱样。
3 结 果
3.1 光滩站位
光滩站位位于低潮滩, 沉积柱长48 cm, 是本文采集的最靠海的站点(图1)。采集的沉积物颜色整体呈黄褐色, 在剖面上基本无变化, 明显可见贝壳等生物壳体。沉积物孔隙水Cl−浓度为143.1~172.8 mmol/L (表2), 平均164.0 mmol/L, 在剖面上随深度无明显变化(图2a)。SO2− 4浓度为7.5~8.9 mmol/L,平均8.3 mmol/L, 在1~9 cm处的浅表层呈降低趋势, 向下随深度略微增加(图2b; 表2)。Mg2+与Cl−浓度随深度变化趋势相似, 在剖面上基本不变(图2c)。Ca2+与SO2− 4浓度随深度变化趋势相似, 向下稍有增加(图2d)。DIC浓度总体较低, 在剖面上变化不大, 为1.9~3.1 mmol/L, 平均2.2 mmol/L, 最大值3.1 mmol/L位于15~18 cm处(图2e)。δ13CDIC在剖面上变化不大, 为−7.7‰ ~ −6.1‰, 最低值−7.7‰与DIC最高值位置相吻合(图2f; 表2)。
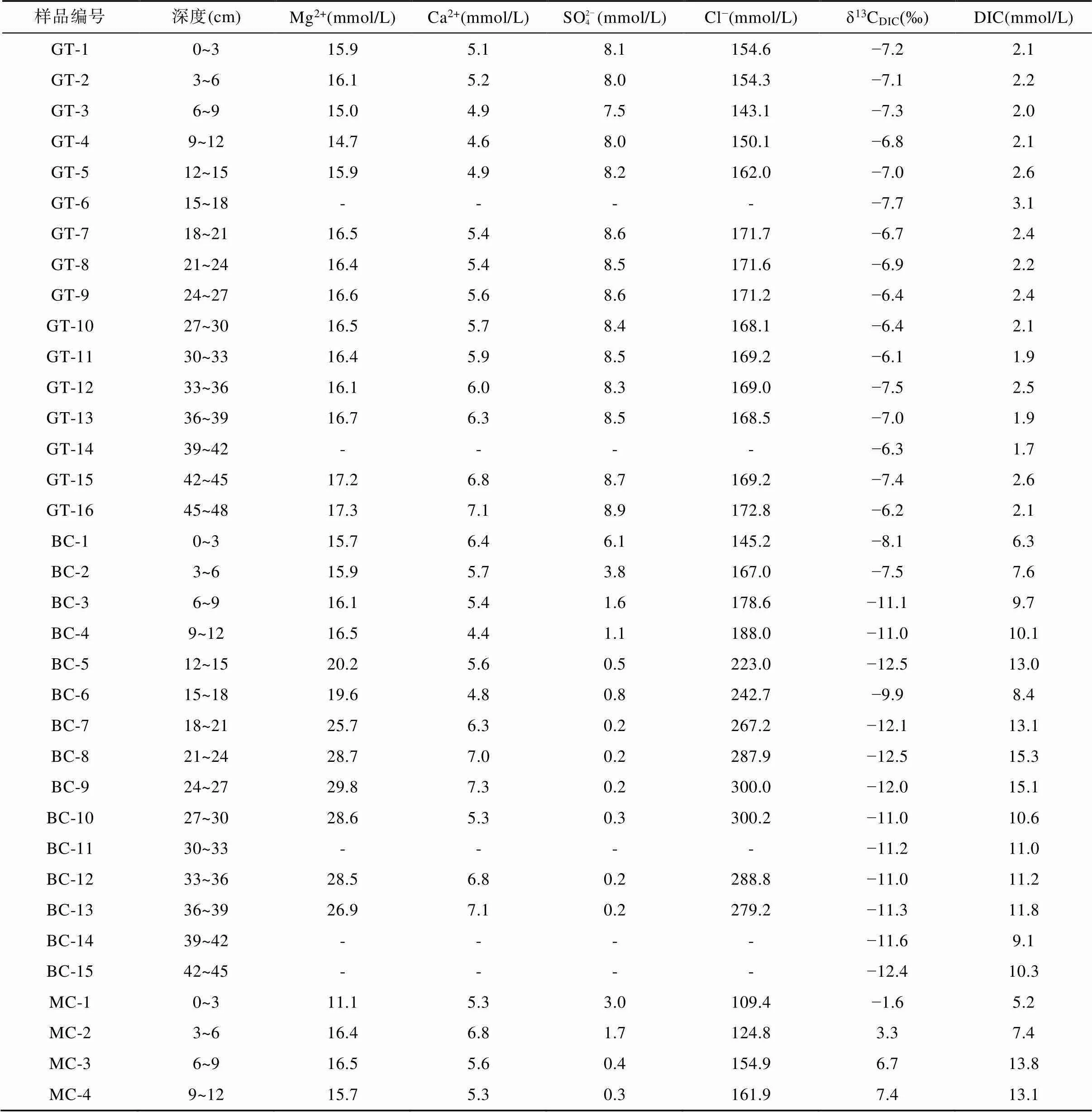
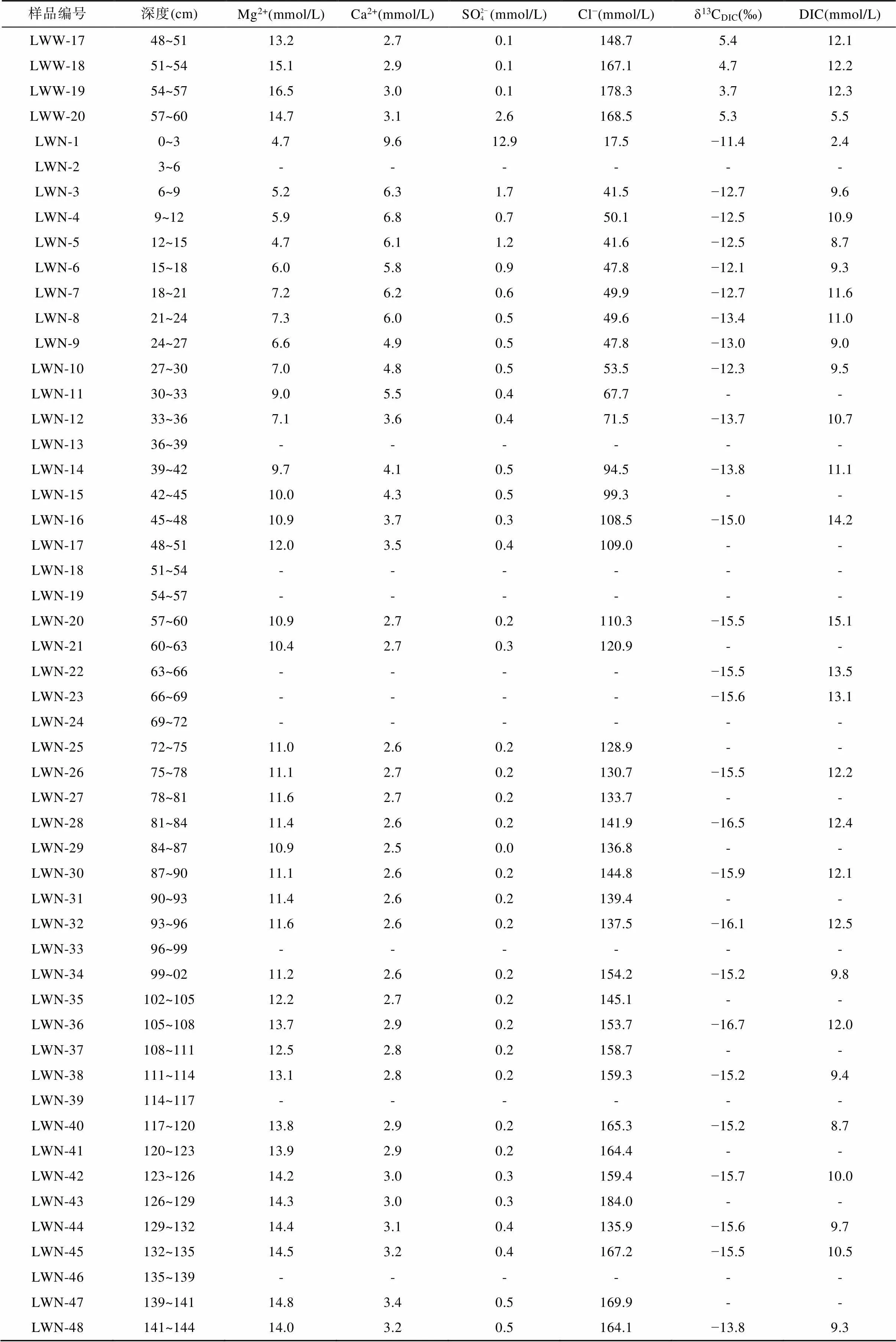
表2 上海南汇东滩湿地5个站位沉积物孔隙水的Mg2+、Ca2+、SO2− 4、Cl−、DIC浓度和δ13CDIC
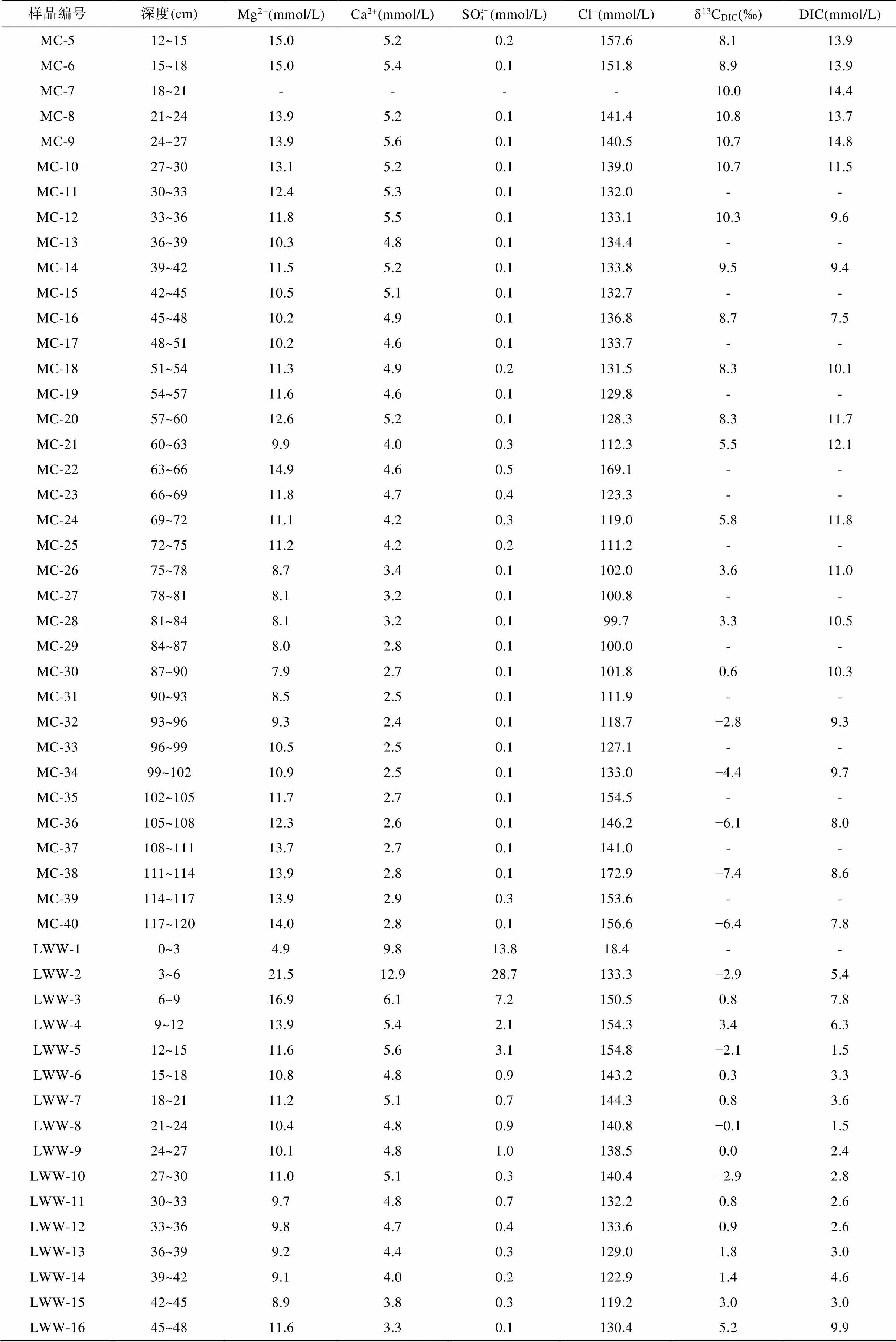
续表2:
续表2:

续表2:
注: GT. 光滩站位; BC. 海三棱藨草站位; MC. 互花米草站位; LWW. 堤外芦苇站位; LWN. 堤内芦苇站位; “-”代表无数据。
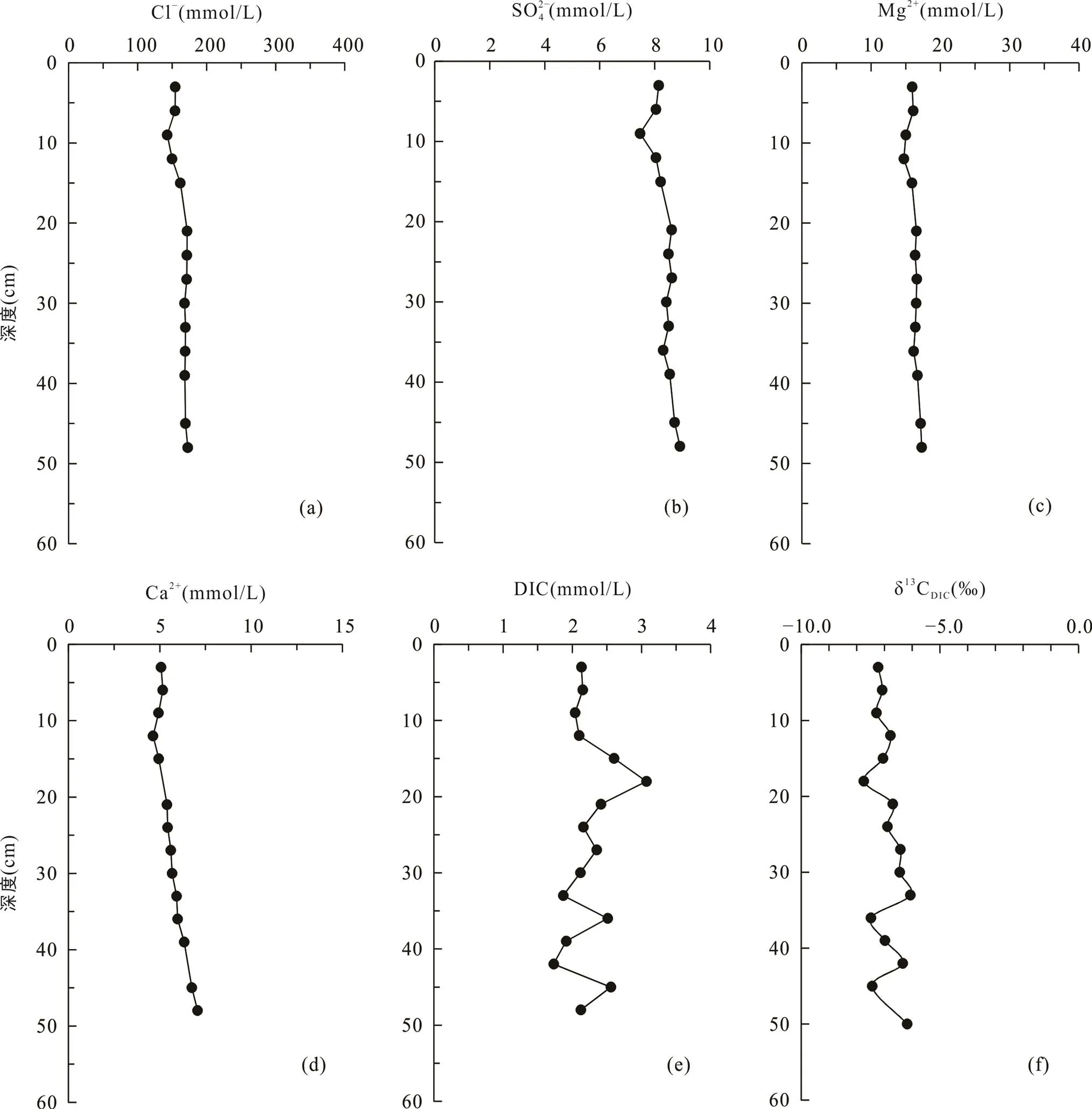
图2 上海南汇东滩湿地光滩站位Cl−(a)、SO2− 4(b)、Mg2+(c)、Ca2+(d)、DIC(e)浓度及δ13CDIC(f)随深度变化
3.2 海三棱藨草站位
海三棱藨草站位位于中潮滩, 沉积柱长45 cm, 呈棕褐色, 颜色在剖面上基本无变化, 存在大量植物根系和植物凋落物。孔隙水Cl−浓度在0~30 cm处随深度明显增加, 从表层的145.2 mmol/L增加到30 cm处的300.2 mmol/L, 向下稍有减小(图3a; 表2)。SO2− 4浓度在表层快速下降, 在21 cm以下接近0(0.2 mmol/L)(图3b; 表2)。Mg2+浓度在0~30 cm处随深度增大, 在24~27 cm处达到最大值29.8 mmol/L,向下基本不变(图3c)。Ca2+浓度随深度变化范围较小, 为4.4~7.3 mmol/L, 平均6.0 mmol/L(图3d)。DIC浓度与Cl−浓度变化特征相似, 在0~25 cm处随深度增加而增加, 在21~24 cm处达到最大值15.3 mmol/L, 向下波动式减小(图3e)。δ13CDIC随深度增加波动较大, 从表层的−7.5‰ ~ −8.1‰向下降低, 同光滩站位相似, DIC浓度最高时, δ13CDIC也最低, 在21~24 cm处δ13CDIC达到最小值−12.5‰。δ13CDIC除15~18 cm处增高到−9.9‰外, 向下基本维持在−12.5‰ ~ −11.0‰ (图3f; 表2)。
3.3 互花米草站位
互花米草站位采集的沉积柱位于高潮滩, 柱长120 cm, 沉积物在剖面上颜色变化较多: 表层0~6 cm处土壤呈棕褐色, 有大量完整的植物根系和凋落物; 6~60 cm处土壤颜色逐渐变深呈黑褐色, 植物碎屑和根系较多; 60 cm以下土壤颜色逐渐向黄褐色转变, 植物碎屑逐渐减少。孔隙水Cl−浓度为99.7~169.1 mmol/L,平均132.4 mmol/L, 在0~12 cm处从109.4 mmol/L逐渐增加到161.9 mmol/L, 然后随深度逐渐降低, 在81~84 cm处达到100.0 mmol/L左右, 从84 cm向下又逐渐增高(图4a)。SO2− 4浓度在表层快速下降, 在18 cm处及以下接近0(0.1 mmol/L)(图4b)。Mg2+和Ca2+在剖面上的变化与Cl−相似, 在浅层随深度增大, 然后向下先降低再增高(图4c、d)。DIC浓度在表层的0~9 cm处从5.2 mmol/L增大到13.8 mmol/L, 在9~27 cm处基本稳定在14.0 mmol/L左右, 然后随深度逐渐下降, 在48 cm处达到最低值7.5 mmol/L, 之后在60~63 cm处增高到12.1 mmol/L, 向下逐渐降低(图4e)。δ13CDIC值从表层的−1.6‰增大到24 cm处的10.8‰, 然后逐渐减小到120 cm处的−6.4‰, 在3~90 cm处均为正值(图4f; 表2)。
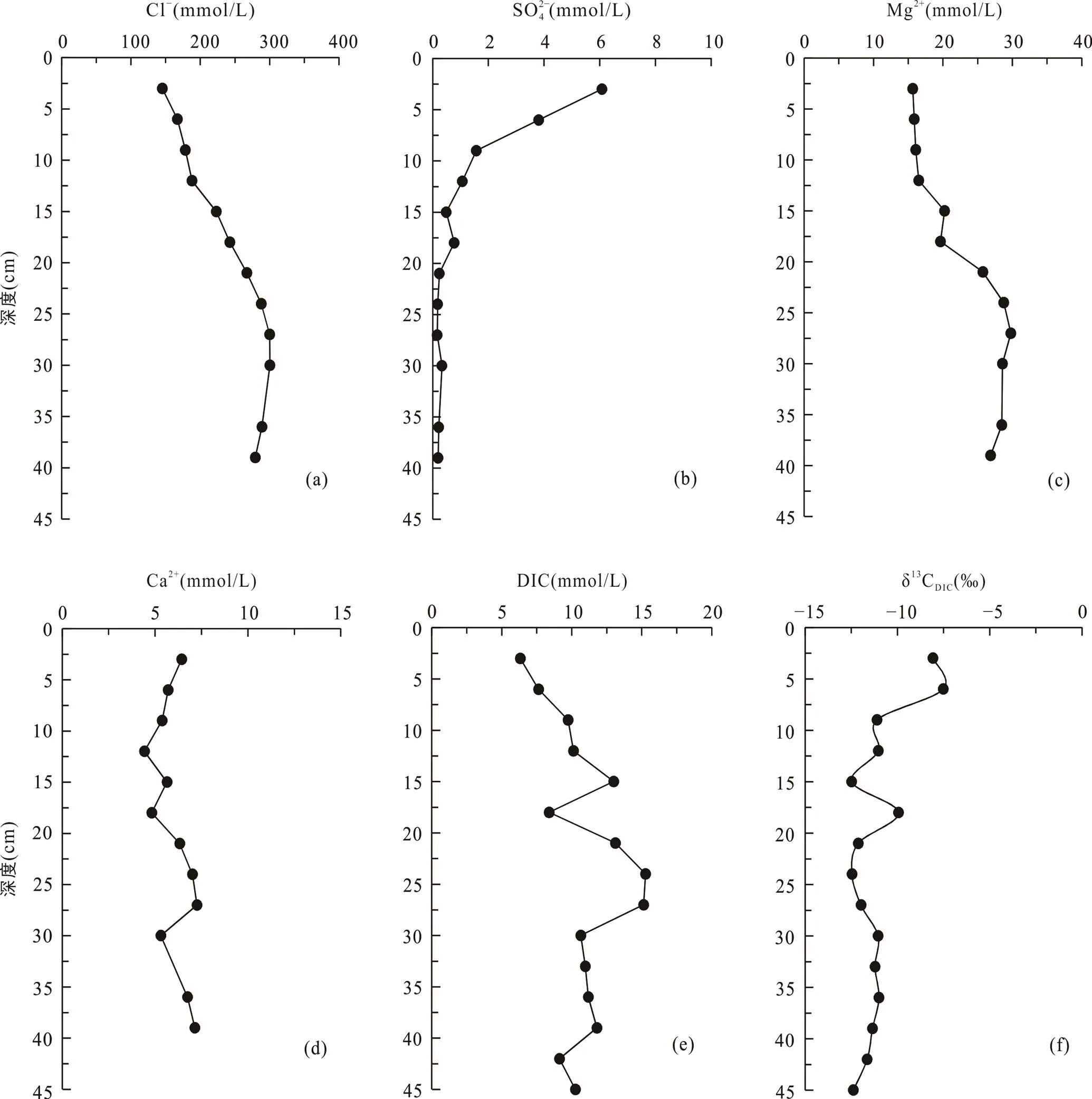
图3 上海南汇东滩湿地海三棱藨草站位Cl−(a)、SO2− 4(b)、Mg2+(c)、Ca2+(d)、DIC(e)浓度及δ13CDIC(f)随深度变化
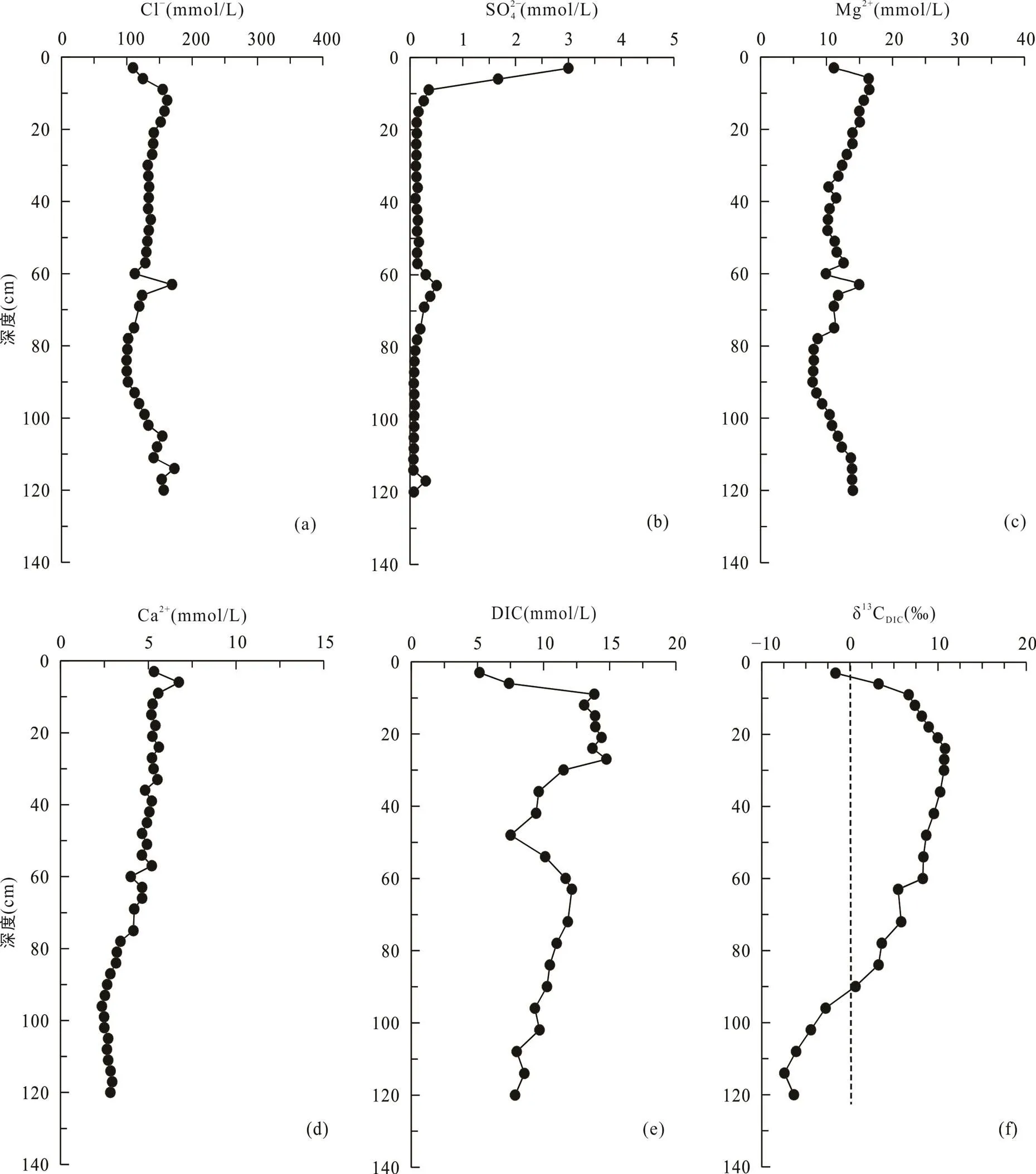
图4 上海南汇东滩湿地互花米草站位Cl−(a)、SO2− 4(b)、Mg2+(c)、Ca2+(d)、DIC(e)浓度及δ13CDIC(f)随深度变化
3.4 堤外芦苇站位
堤外芦苇站位位于高潮滩, 与互花米草站位相邻(图1), 沉积柱长60 cm, 沉积物颜色在剖面上变化较大: 表层0~9 cm处土壤呈黄褐色, 存在大量植物残体; 12~45 cm处土壤呈黑色, 存在大量植物碎屑和植物根系; 45~60 cm处土壤颜色逐渐由黑色转变为灰褐色, 植物根系变少。孔隙水Cl−浓度从表层0~3 cm处的18.4 mmol/L快速增加到12~15 cm处的154.8 mmol/L,向下随深度降低, 在45 cm处为119.2 mmol/L, 然后逐渐增大(图5a)。SO2− 4浓度从表层0~3 cm处的13.8 mmol/L快速增加到3~6 cm的28.7 mmol/L, 然后快速下降, 在39 cm以下接近于0(0.3 mmol/L) (图5b)。Mg2+浓度从表层0~3 cm处的4.9 mmol/L增加到3~6 cm处的21.5 mmol/L, 向下先减小到45 cm处的8.9 mmol/L, 然后增高(图5c)。Ca2+浓度从表层0~3 cm处的9.8 mmol/L增加到3~6 cm处的12.9 mmol/L,向下呈降低趋势(图5d)。DIC浓度在剖面上可以分为3段: 3~12 cm为5.4~6.3 mmol/L; 12~45 cm为1.5~4.6 mmol/L; 45~57 cm为9.9~12.3 mmol/L(图5e)。δ13CDIC总体上为正值, 随深度增大, 最高为5.4‰, 最低为−2.9‰(图5f; 表2)。
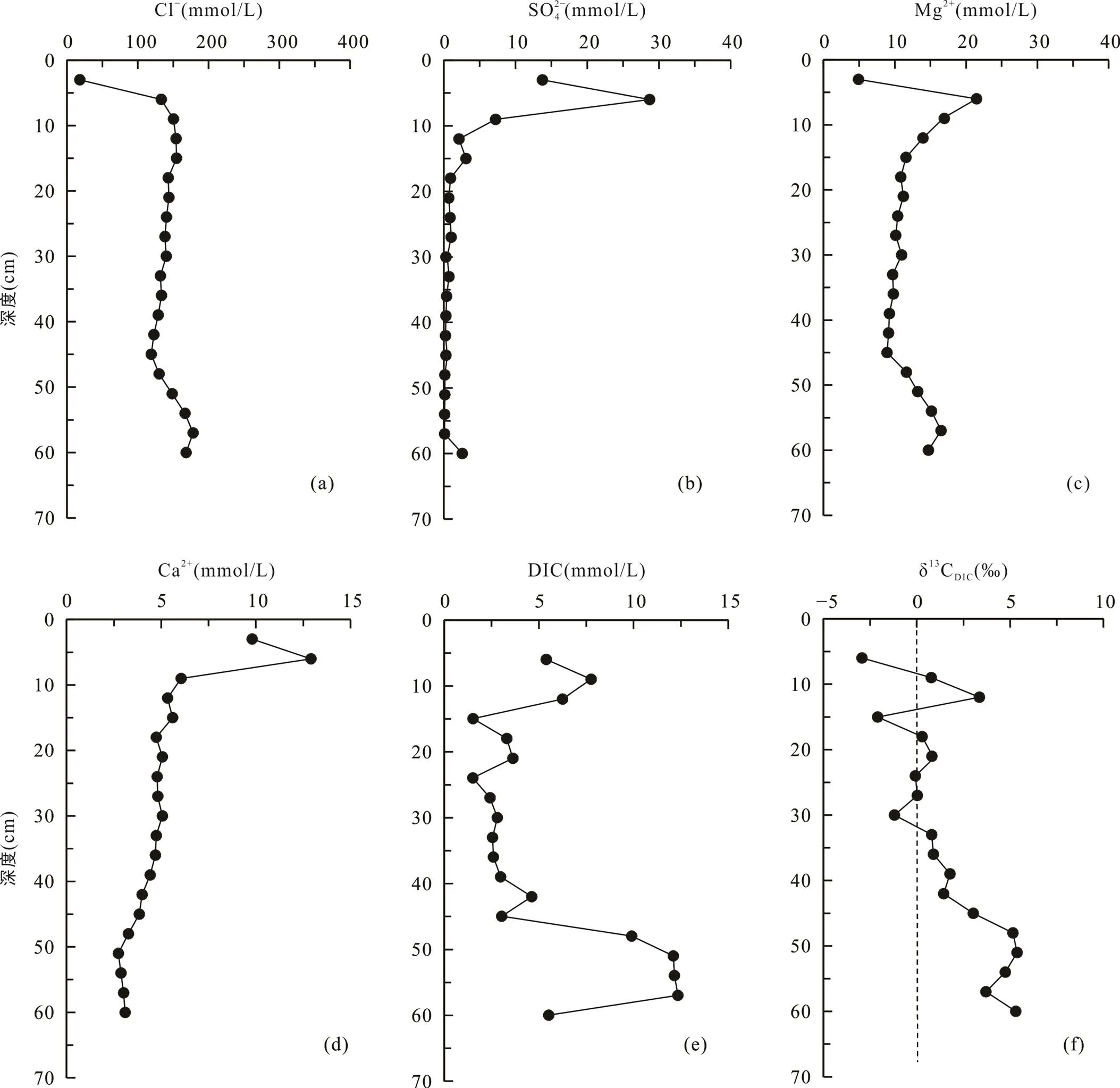
图5 上海南汇东滩湿地堤外芦苇站位Cl−(a)、SO2− 4(b)、Mg2+(c)、Ca2+(d)、DIC(e)浓度及δ13CDIC(f)随深度变化剖面
3.5 堤内芦苇站位
堤内芦苇站位与其他4个采样点不同, 该站位位于海堤内侧, 在海堤建设完成后, 该站位不再遭受周期性海水淹没。采集的沉积物柱长为150 cm, 沉积物在0~12 cm处土壤颜色呈棕褐色, 有大量植物根系和植物凋落物, 在12 cm以下土壤颜色呈灰褐色。堤内芦苇站位的Cl−和Mg2+离子浓度随深度增加逐渐增大, Cl−浓度从17.5 mmol/L增大到174.6 mmol/L(图6a), Mg2+离子浓度从4.7 mmol/L增大到14.2 mmol/L (图6c)。SO2− 4浓度在0~20 cm深度内从表层的12.9 mmol/L快速下降, 在60 cm处及以下接近0(0.2 mmol/L)(图6b)。Ca2+浓度从表层的9.6 mmol/L先逐渐降低至84~87 cm处的2.5 mmol/L, 然后再增高至150 cm处的3.4 mmol/L(图6d)。DIC浓度从表层的2.4 mmol/L向下增大, 至60 cm处达到最大值15.1 mmol/L, 然后在60~140 cm处随深度波动式减小(图6e)。δ13CDIC从表层的−11.4‰降低至84 cm处的−16.5‰, 然后向下变化不大, 约−15.5‰左右(图6f; 表2)。
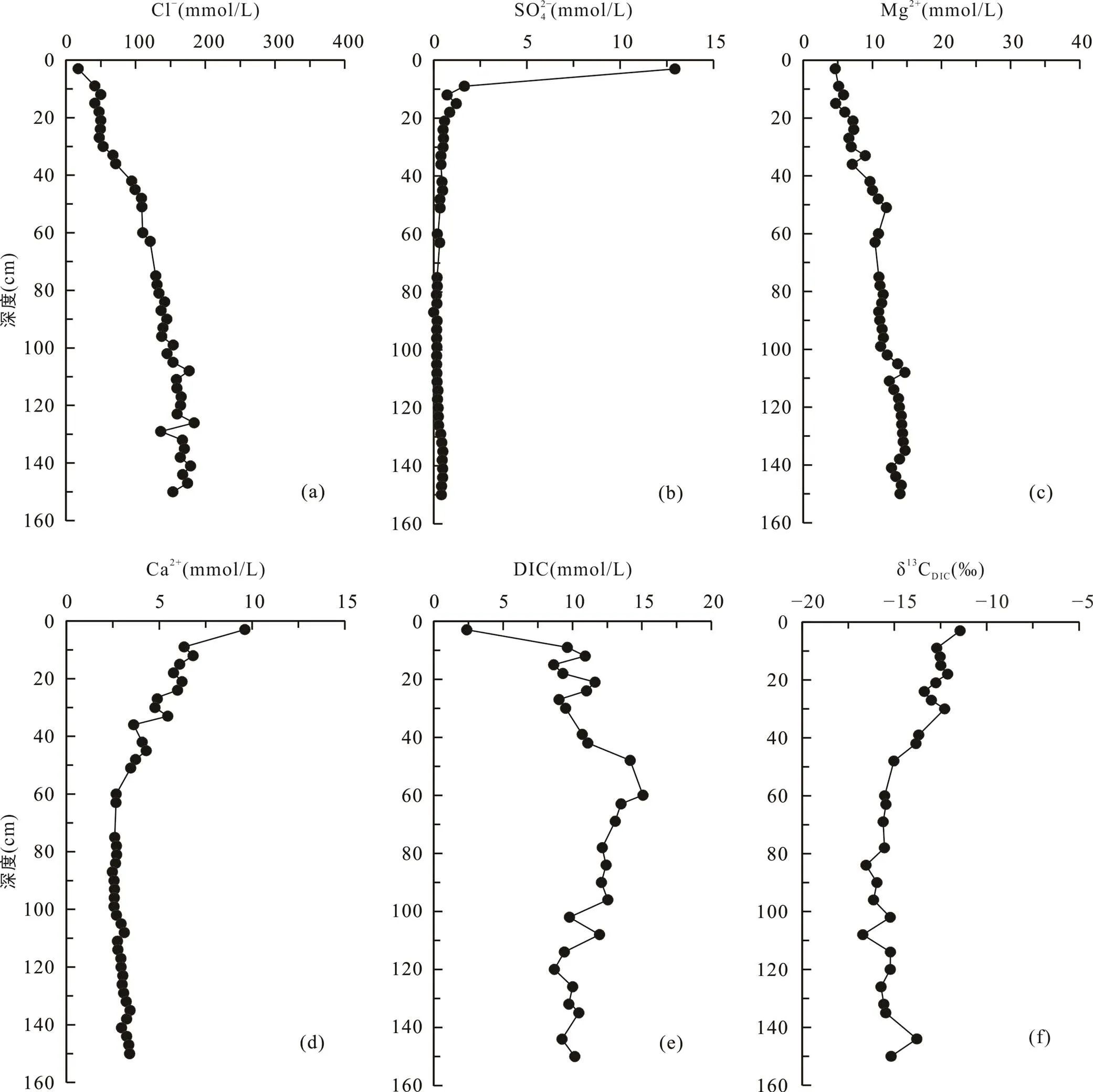
图6 上海南汇东滩湿地堤内芦苇站位Cl−(a)、SO2− 4(b)、Mg2+(c)、Ca2+(d)、DIC(e)浓度及δ13CDIC(f)随深度变化
4 讨 论
沉积物孔隙水中δ13CDIC是示踪DIC来源的重要依据, 海水的δ13CDIC为0‰, AOM产生的δ13CDIC为−60‰ ~ −30‰, 而OSR生成的δ13CDIC为−25‰ ~ −20‰(Chen et al., 2010; 李宁, 2011; 陈法锦等, 2012; Hu et al., 2015; Sun et al., 2016; 冯俊熙等, 2017; Wu et al., 2017)。海洋浅表层沉积物孔隙水DIC主要有3个来源: ①从海底海水扩散进入沉积物或者随沉积物埋藏进入沉积物; ②沉积物中有机质的降解(OSR和产甲烷作用); ③AOM作用。因此, 可以用质量平衡模型计算不同来源孔隙水的DIC库:
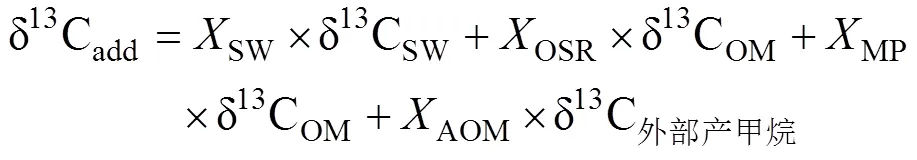
式中: δ13Cadd表示孔隙水DIC库δ13C的总收支;是各个来源产生的DIC占沉积物孔隙水总DIC的比例; SW、OM、OSR、AOM和MP分别代表沉积表层海水、有机质、有机质缺氧氧化、甲烷缺氧氧化和有机质原位产甲烷产生的DIC。如果把OSR、AOM和MP合并为沉积物有机质转化来源的DIC, 式(1)可以简化为:
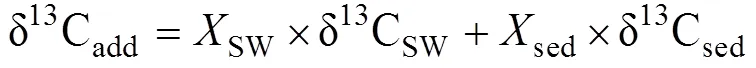
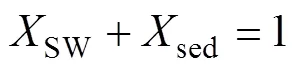
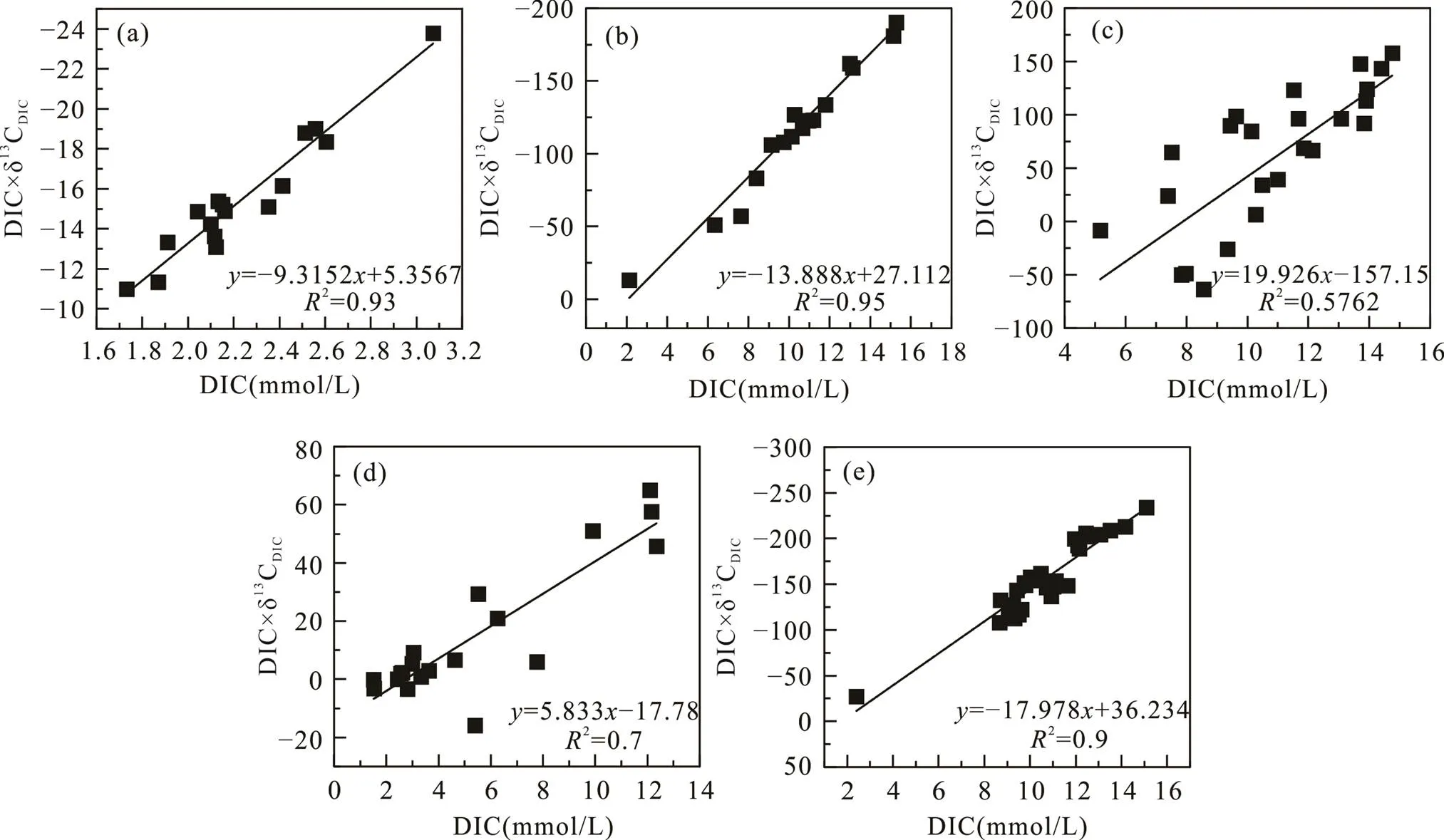
式中: sed表示沉积埋藏有机质矿化产生的DIC, δ13Csed常用δ13CTOC替代。沉积物中δ13CDIC×DIC与DIC常有良好的线性关系, 因此可以简单地从δ13CDIC×DIC与DIC的线性趋势线斜率获得δ13Cadd(Benedict et al., 1980; Ussler Ⅲ and Paull, 2008; Chatterjee et al., 2011; Li et al., 2019)。
南汇东滩湿地光滩站位孔隙水Mg2+与Cl−浓度在剖面上基本不变, Ca2+与SO2− 4浓度稍有增加, DIC含量低(平均2.2 mmol/L)且无明显变化, δ13CDIC为−6.2‰ ~ −7.7‰(平均−6.9‰; 图2; 表3)。DIC与δ13CDIC×DIC存在较好的相关性(图7a), δ13Cadd为−9.3‰, δ13CTOC平均值为−24.7‰(表3), 该站位低潮时采集的残积海水δ13CDIC为−5.5‰, 由此计算获得光滩站位海水来源的DIC约占总DIC库的80%, 沉积有机质产生的DIC仅占20%(表3), 表明光滩站位存在弱的OSR作用, DIC主要来源于表层海水。
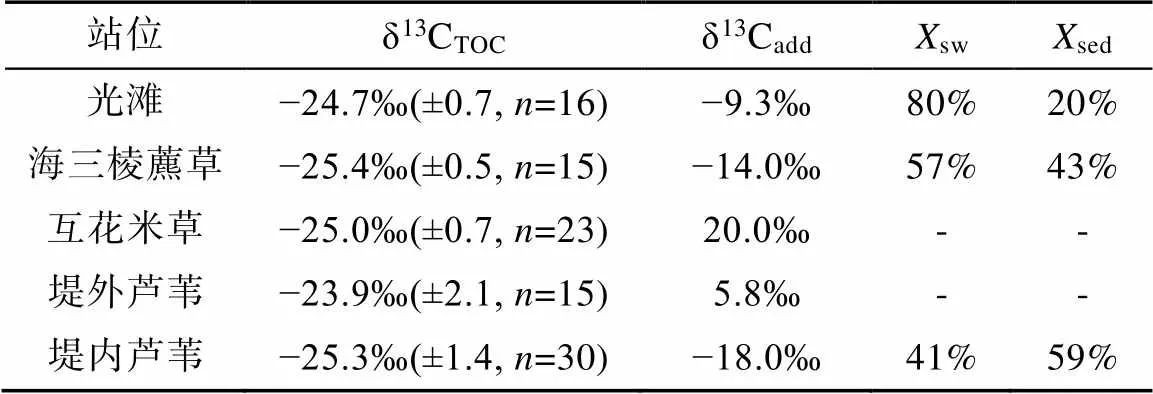
表3 上海南汇东滩湿地5个站位不同来源的DIC比例
(a) 光滩; (b) 海三棱藨草; (c) 互花米草; (d) 堤外芦苇; (e) 堤内芦苇。
海三棱藨草站位位于中潮滩, DIC和Cl−浓度整体随深度增加(图3e), 可能存在表层水的混合作用。孔隙水SO2− 4浓度在表层的21 cm处快速下降至0.2 mmol/L,表明存在OSR作用。孔隙水的δ13CDIC为−7.5‰ ~ −12.5‰, 随深度增大(图3f), 有较高的DIC浓度(平均10.8 mmol/L), 且DIC与δ13CDIC×DIC有很好的相关性(图7b)。δ13Cadd约为−14‰, δ13CTOC为−25.4‰, 应用光滩站位海水δ13CDIC值−5.5‰计算, 海三棱藨草站位海水来源的DIC占总DIC库的57%, 沉积物OSR作用产生的DIC约占43%(表3)。
互花米草站位位于高潮滩, 孔隙水SO2− 4浓度在表层的18 cm处快速下降至0.1 mmol/L, DIC浓度平均10.8 mmol/L, δ13CDIC值为−7.4‰~10.8‰, 在3~90 cm处均为正值(图4; 表3), 随着DIC浓度的增大, δ13CDIC存在大量正值。互花米草属于外来入侵种, 根系特殊的微生物群落对甲烷产生和排放产生重要影响(Borowski et al., 1996)。因此浅层SO2− 4的消耗除OSR作用外, 还可能存在原位形成甲烷的AOM作用。δ13CDIC×DIC与δ13CDIC相关性较差(图7c), δ13Cadd为20‰, δ13CTOC为−25‰(表3)。由于该站位产甲烷作用强烈, 产甲烷过程生成的甲烷可能没有完全被AOM所消耗, 因此无法计算沉积物孔隙水DIC库的海水来源和沉积有机质来源的比例。
堤外芦苇站位沉积物孔隙水SO2− 4浓度在表层的3 cm快速增加, 然后向下快速下降, 在18 cm处降至0.3 mmol/L, δ13CDIC总体上以正值为主, 随深度增大, 最大值为5.4‰。该站位与互花米草站位相邻, 孔隙水DIC沉积有机质来源中除OSR作用外, 也明显存在原位产甲烷作用, 并且可能存在AOM作用。δ13CDIC×DIC与δ13CDIC相关性较差(图7d), δ13Cadd为5.8‰, δ13CTOC为−23.9‰(表3), 无法计算海水来源和沉积有机质来源的比例。
堤内芦苇站位的Cl−和Mg2+浓度随深度增加逐渐增大, 表明存在表层水的混合。SO2− 4浓度在20 cm表层沉积物中快速下降至接近0, δ13CDIC为−11.4‰ ~ −16.7‰(图6; 表3), 表明存在显著的OSR作用。δ13CDIC×DIC与δ13CDIC相关性较好(图7e), δ13Cadd为−18‰, δ13CTOC为−25.3‰, 堤内芦苇站位沉积界面之上的水体δ13CDIC值为−7.5‰, 计算可得上覆水体来源的DIC占总DIC库的41%, 沉积物有机质的OSR作用产生的DIC约占59%(表3)。
5 结 论
南汇东滩湿地光滩、互花米草、海三棱藨草, 堤外芦苇、堤内芦苇5个站位沉积物孔隙水的地球化学特征显示滨海湿地孔隙水DIC来源复杂, 不同站位DIC产生的来源具有较大差异。低潮滩的光滩站位存在较弱的OSR作用, 产生的DIC约占孔隙水总DIC的20%, 其余的80%来源于表层海水。海三棱藨草和堤内芦苇站位存在较强的OSR作用, 海三棱藨草站位的OSR作用和海水来源的DIC分别约为43%和57%, 堤内芦苇OSR作用产生了约59%的DIC, 上覆水体来源的DIC约41%。互花米草和堤外芦苇2个站位存在明显的δ13CDIC正值, 显示存在显著的产甲烷作用, 因此孔隙水的DIC来源可能同时包括海水、OSR、产甲烷作用和AOM作用。
致谢:感谢天津大学宋照亮教授和另一位匿名审稿专家的详细意见。
陈法锦, 陈建芳, 金海燕, 李宏亮, 郑连福, 张海生. 2012. 南海表层沉积物与沉降颗粒物中有机碳的δ13C对比研究及其古环境再造意义. 沉积学报, 30(2): 340–345.
陈万逸, 张利权, 袁琳. 2012. 上海南汇东滩鸟类栖息地营造工程的生境评价. 海洋环境科学, 31(4): 561–566.
冯俊熙, 杨胜雄, 梁金强, 方允鑫. 2017. 南海北部神狐东南海域沉积物孔隙水地球化学特征及其对天然气水合物的指示. 海洋地质前沿, 33(7): 32–44.
付桂. 2007. 南汇嘴岸滩及邻近海床冲淤演变过程研究. 上海: 华东师范大学硕士学位论文: 25–57.
郭文利, 袁晓, 裴恩乐, 夏述忠, 严晶晶, 王天厚. 2010. 上海南汇东滩湿地鸟类资源调查. 四川动物, 29(5): 596–604.
李九发, 戴志军, 刘新成, 赵建春, 冯凌旋. 2010. 长江河口南汇嘴潮滩圈围工程前后水沙运动和冲淤演变研究. 泥沙研究, 9(3): 31–37.
李宁. 2011. 长江口邻近海域的溶解有机碳和溶解无机碳系统. 青岛: 中国海洋大学硕士学位论文: 43–52.
李伟, 袁琳, 张利权, 赵志远, 李蕙, 朱晓泾, 潘家琳, 陈雅慧. 2018. 海三棱藨草及互花米草对模拟盐胁迫的响应及其耐盐阈值. 生态学杂志, 37(9): 2596–2602.
刘杰, 陈吉余, 陈沈良. 2007. 长江口南汇东滩滩地地貌演变分析. 泥沙研究, 12(6): 47–52.
马长安. 2015. 围垦对南汇和崇明东滩湿地大型底栖动物的影响. 上海: 华东师范大学博士学位论文: 35–54.
马长安, 徐霖林, 田伟, 吕巍巍, 赵云龙. 2011. 南汇东滩围垦湿地大型底栖动物的种类组成、数量分布和季节变动. 复旦学报(自然科学版), 50(3): 274–281.
唐玉姝, 王磊, 席雪飞, 胡煜, 张艳楠, 陈金海, 陈秀芝, 孙瑛. 2013. 典型气候/环境因子变化对九段沙湿地碳固定潜力的影响. 农业环境科学学报, 32(4): 874–880.
陶燕东. 2017. 南汇东滩湿地海三棱藨草群落构建与生态修复效果研究. 上海: 上海海洋大学硕士学位论文: 28–42.
王红丽, 肖春玲, 李朝君, 李艳丽, 张文佺, 付小花, 乐毅全, 王磊. 2009. 崇明东滩湿地土壤有机碳空间分异特征及影响因素. 农业环境科学学报, 28(7): 1522– 1528.
席雪飞, 贾建伟, 王磊, 唐玉姝, 王红丽, 张文俭, 付小花, 乐毅全. 2009. 长江口九段沙湿地土壤有机碳及微生物陆向分布. 农业环境科学学报, 28(12): 2574– 2579.
严格, 葛振鸣, 张利权. 2014. 崇明东滩湿地不同盐沼植物群落土壤碳储量分布. 应用生态学报, 25(1): 85–91.
尤迪. 2018. 盐沼湿地冲淤变化对大型底栖动物及其生态功能的影响. 上海: 华东师范大学硕士学位论文: 31–45.
张启明. 2015. 长江口南汇东滩优势种植被的光谱和理化参数信息提取与分析. 上海: 上海海洋大学硕士学位论文: 23–36.
张启明, 韩震. 2015. 几种红边位置算法在潮滩区域的适用性研究——以长江口南汇潮滩为例. 海洋湖沼通报, 12(4): 49–55.
张雪薇, 韩震, 王文柳, 刘美君, 曾其明. 2018. 夏秋季节潮滩植被光谱特征的差异性研究. 海洋湖沼通报, 10(5): 32–39.
Bae H S, Holmes M E, Chanton J P, Reddy K R, Ogram A. 2015. Distribution, activities, and interactions of methanogensand sulfate-reducing prokaryotes in the florida everglades., 81(21): 7431–7442.
Barker J F, Fritz P J. 1981. Carbon isotope fractionation during microbial methane oxidation., 293(5830): 289–291.
Benedict C R, Wong W W, Wong J H. 1980. Fractionation of the stable isotopes of inorganic carbon by seagrasses., 65(3): 512–517.
Berner R A. 1998. The carbon cycle and CO2over phanerozoictime: The role of land plants., 353(1365): 75–81.
Berner R A. 1980. Early diagenesis: A theoretical approach. New Jersey: Princeton University Press: 12–39.
Borowski W S, Paull C K, Ussler Ⅲ W. 1996. Marine pore- water sulfate profiles indicatemethane flux from underlying gas hydrate., 24(7): 655–658.
Borowski W S, Paull C K, Ussler Ⅲ W. 1999. Global and local variations of interstitial sulfate gradients in deep- water, continental margin sediments: Sensitivity to underlying methane and gas hydrates., 159(1): 131–154.
Burns S J. 1998. Carbon isotopic evidence for coupled sulfate reduction methane oxidation in amazon fan sediments., 62(5): 797–804.
Capooci M, Barba J, Seyfferth A L, Vargas R. 2019. Experimental influence of storm-surge salinity on soil greenhouse gas emissions from a tidal salt marsh., 686(10): 1164–1172.
Chatterjee S, Dickens G R, Bhatnagar G, Chapman W G, Dugan B, Snyder G T, Hirasaki G J. 2011. Pore water sulfate, alkalinity, and carbon isotope profiles in shallowsediment above marine gas hydrate systems: A numerical modeling perspective., 116, B09103.
Chen Y F, Ussler III W, Haflidason H, Lepland A, Rise L, Hovland M, Hjelstuen B O. 2010. Sources of methane inferred from pore-water δ13C of dissolved inorganic carbon in Pockmark G11, offshore Mid-Norway., 275(3): 127–138.
Chmura G L. 2013. Management C. What do we need to assess the sustainability of the tidal salt marsh carbon sink?, 83(10): 25–31.
Conrad R. 2005. Quantification of methanogenic pathways using stable carbon isotopic signatures: A review and a proposal., 36(5): 739–752.
Frolking S, Roulet N T, Moore T R, Richard J H, Lavoie M, Kuller M D. 2001. Modeling northern peatland decomposition and peat accumulation., 4: 479–498.
Gao L, Gao Y Q, Song S Z, Zhang F F. 2020. Non-conservative behavior of dissolved organic carbon in the Changjiang (Yangtze River) Estuary and the adjacent East China Sea., 197, 104084.
Hu Y, Feng D, Liang Q Y, Xia Z, Chen L Y, Chen D F. 2015. Impact of anaerobic oxidation of methane on the geochemical cycle of redox-sensitive elements at cold-seepsites of the northern south china sea.:, 122(3): 84–94.
Huang Y, Chen Z, Tian B, Zhou C, Wang J T, Ge Z M, Tang J W. 2020. Tidal effects on ecosystem CO2exchange in asalt marsh of an intertidal shoal., 292, 108108.
Kaplan I R. 1975. Natural Gases in Marine Sediments. New York: Plenum Press: 99–139.
Kastner M, Claypool G, Robertson G. 2008. Geochemical constraints on the origin of the pore fluids and gas hydrate distribution at atwater valley and keathley canyon, northern gulf of Mexico., 25(9): 860–872.
Kim J, Lee J, Yun J, Yang Y, Kang H. 2020. Mechanisms of enhanced methane emission due to introduction ofandin a temperatetidal salt marsh., 153(4): 32–45.
Kirwan M L, Megonigal J P. 2013. Tidal wetland stability in the face of human impacts and sea-level rise., 504(7478): 53–60.
Koebsch F, Winkel M, Liebner S, Liu B, Bttcher M E. 2019. Sulfate deprivation triggers high methane production in a disturbed and rewetted coastal peatland., 16(9): 1937–1953.
Li K K, George S C, Cai C F, Gong S, Sestak S, Armand S, Zhang S F. 2019. Fluid inclusion and stable isotopic studies of thermochemical sulfate reduction: Upper permian and lower triassic gasfields, northeast Sichuan Basin, China., 246(5): 86–108.
Li Y H, Gregory S. 1974. Diffusion of ions in sea water and in deep-sea sediments., 38(708): 703–714.
Luo M, Chen L L, Wang S H, Yan W, Wang H B, Chen D F. 2013. Pockmark activity inferred from pore water geochemistry in shallow sediments of the pockmark field in southwestern Xisha Uplift, northwestern South China Sea., 48(5): 247– 259.
Macy A, Osland M J, Cherry J A, Cebrian J. 2021. Changes in ecosystem nitrogen and carbon allocation with black mangrove (Avicennia germinans) encroachment intosalt marsh., 24: 1007– 1023.
Mostofa K M, Li W, Wu F C, Liu C Q, Liao H Q, Zeng L, Xiao M. 2018. Environmental characteristics and changes of sediment pore water dissolved organic matter in four Chinese lakes., 25(3): 2783–2804.
Mostofa K M, Yoshioka T, Mottaleb A. 2013. Photobiogeochemistry of Organic Matter. Berlin: Springer: 12–82.
Osland M J, Gabler C A, Grace J B, Meagan L M, Jennie L M, Andrew S F, Nicholas M E, Laura C F, Camille L S, Stephen B H. 2018. Climate and plant controls on soil organic matter in coastal wetlands., 24(11): 5361–5379.
Pinsonneault A J, Neale P J, Tzortziou M, Elizabeth A C, Christina R P, Hannah M, Jonathan S L, James P M. 2020. Dissolved organic carbon sorption dynamics in tidal marsh soils., 66: 214–225.
Reeburgh W S. 1980. Anaerobic methane oxidation: Rate depthdistributions in skan bay sediments., 47(3): 345–352.
Robinson S. 2020. Climate change adaptation in SIDS: A systematic review of the literature pre and post the IPCC fifth assessment report., 11, e653.
Schulz H D. 2006. Quantification of early diagenesis: Dissolved constituents in pore water and signals in the solid phase // Schulz H D, Zaber M. Marine Geochemistry. Berlin: Springer: 73–124.
Steinmuller H E, Foster T E, Boudreau P, Hinkle C R, Chambers L G. 2020. Characterization of herbaceous encroachment on soil biogeochemical cycling within a coastal marsh., 738, 139532.
Sun X, Higgins J, Turchyn A V. 2016. Diffusive cation fluxes in deep-sea sediments and insight into the global geochemical cycles of calcium, magnesium, sodium and potassium., 373(21): 64–77.
Sun X, Turchyn A V. 2014. Significant contribution of authigenic carbonate to marine carbon burial., 7(3): 201–204.
Taillardat P, Ziegler A D, Friess D A, Widory D, Truong V V, David F, Marchand C. 2018. Carbon dynamics and inconstant porewater input in a mangrove tidal creek over contrasting seasons and tidal amplitudes., 237(3): 32–48.
Tian B, Wu W T, Yang Z Q, Zhou Y X. 2016. Drivers, trends, and potential impacts of long-term coastal reclamation in China from 1985 to 2010., 170(32): 83–90.
Tong C, Morris J T, Huang J F, Xu H, Wan S. 2018. Changes in pore-water chemistry and methane emission followingthe invasion ofinto an oliogohaline marsh., 63(1): 384–396.
Ussler Ⅲ W, Paull C K. 2008. Rates of anaerobic oxidation of methane and authigenic carbonate mineralization in methane-rich deep-sea sediments inferred from models and geochemical profiles., 266(3–4): 271–287.
Wang Z A, Cai W J, 2004. Carbon dioxide degassing and inorganic carbon export from a marsh-dominated estuary (the Duplin River): A marsh CO2pump., 49(2): 341–354.
Wang Z A, Kroeger K D, Ganju N K, Gonneea M E, Chu S N. 2016. Intertidal salt marshes as an important source of inorganic carbon to the coastal ocean., 61(5): 1916–1931.
Wu L B, Liu X D, Xu L Q. 2017. Change of organic δ13C in ornithogenic sediments of the Xisha Archipelago, South China Sea and its implication for ecological development.(), 91(3): 1109– 1119.
Wu M X, Hu Y, Wu P L, He P M, He N, Zhang B L, Zhang S L, Fang S B. 2020. Does soil pore water salinity or elevation influence vegetation spatial patterns along coasts? A case study of restored coastal wetlands in Nanhui, Shanghai., 7(40): 2691–2700.
Xiao D, Deng L, Kim D G, Huang H B, Tian K. 2019. Carbon budgets of wetland ecosystems in China., 25(6): 2061–2076.
Yu X L, Yang X Q, Wu Y J, Peng Y S, Yang T, Xiao F S, Zhong Q P, Shu S F, He Q, Tian Y, Yan Q Y, Wu B, He Z L. 2020.introduction alters methane cycling microbial communities and increases methane emissions in mangrove ecosystems., 144, 107775.
Yuan J, Ding W, Liu D, Kang H, Freeman C, Xiang J, Lin Y X. 2015. Exoticinvasion alters ecosystem-atmosphere exchange of CH4and N2O and carbon sequestration in a coastal salt marsh in China., 21(4): 1567–1580.
Yuan Y Q, Li X Z, Jiang J, Li M X, Christopher B. 2020. Distribution of organic carbon storage in different salt-marsh plant communities: A case study at the Yangtzeestuary., 243, 106900.
Zhang Y F, Li D W, Wang K, Xue B. 2019. Contribution of biological effects to the carbon sources/sinks and the trophic status of the ecosystem in the changjiang (Yangtze) river estuary plume in summer as indicated by net ecosystem production variations., 11(6): 1264–1275.
Zhang Z, Zimmermann N E, Stenke A, Li L, Hodson E L, Zhu G F, oulter B. 2017. Emerging role of wetland methane emissions in driving 21st century climate change., 114(36): 9647–9652.
Zhao G M, Ye S Y, He L, Yuan H M, Laws E A. 2020. Historical change of carbon burial in late quaternary sediments of the ancient yellow river delta on the west coast of bohai bay, China., 193, 104619.
Geochemical characteristics of sediment pore water in different vegetation communities of Nanhui Dongtan wetland, Shanghai: Implications for carbon cycle processes in shallow sediments
XING Yaru1, CHEN Linying2*, CHEN Duofu1, 2
(1. College of Marine Ecology and Environment, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Engineering Research Center of Hadal Science and Technology, College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China)
Coastal wetlands have high carbon deposition rates and carbon sequestration capacities, and play an important role in mitigating global warming. Studying the processes of carbon deposition and burial is essential for understanding the carbon budget in coastal wetlands. Previous studies focused mainly on the carbon cycle in the Yangtze River Estuary wetland, and the sources and influencing factors of dissolved inorganic carbon (DIC) in sediment pore water are poorly known. This study analyzed the anions (SO2− 4, Cl−) and cations (Mg2+, Ca2+), DIC concentrations, and δ13CDICin the pore water of the sediments collected from 5 sites with different vegetation coverage in the Nanhui Dongtan wetland, with the aim of elucidating the biogeochemical processes that govern DIC cycling in pore water. The results show that the DIC in Nanhui Dongtan wetland mainly originates from the mineralization of organic matter and seawater, and is mostly controlled by different vegetation and locations in the tidal beach. The profiles of pore-water SO2− 4 and DIC concentrations at the mudflat site on the low tidal beach were nearly unchanged, with δ13CDICranging between −7.7‰ and −6.1‰. The DIC produced by the sulfate reduction of organic matter (OSR) contributed approximately 20% DIC, and the remaining 80% was from seawater. The SO2− 4 concentrations at the middle-tidalsite and thesite inside the seawall decreased rapidly in the shallow sediments, with δ13CDICranging from −12.5‰ to −7.5‰ and from −16.7‰ to −11.5‰, respectively, indicating an important contribution from OSR. DIC derived from OSR and seawater is approximately 43% and 57% at thesite, respectively, and at thesite inside the seawall approximately 59% DIC was derived from OSR and 41% derived from overlying water. The SO2− 4 concentrations at the sites of theoutside the seawall andon the high tide beach declined rapidly from the surface sediment, and the most of δ13CDICshowed positive values with the maxima of 10.8‰ and 5.4‰, respectively, indicating the presence of methanogenesis. Therefore, the rapid decline of SO2− 4concentrations in the surface sediment layer may be related to the processes of OSR and AOM simultaneously. We postulate that understanding the geochemical characteristics of wetland sediment pore water and its influencing factors is essential for exploring the biogeochemical cycle of coastal wetland carbon and accurately assessing the source of coastal wetland carbon.
degradation of organic matter; pore water; dissolved inorganic carbon; carbon cycle; Nanhui Dongtan wetland in Shanghai
P593; P736.21
A
0379-1726(2022)06-0667-17
10.19700/j.0379-1726.2022.06.006
2020-11-05;
2021-01-27
国家自然科学基金项目(41730528)资助。
邢亚茹(1996–), 女, 硕士研究生, 海洋科学专业。E-mail: xyru2018@163.com
陈琳莹(1988–), 女, 助理研究员, 主要从事地球化学分析研究。E-mail: lychen@shou.edu.cn

